响应面法优化樟树籽油酶法制备二酰甘油的工艺研究
吴学志 郭夏丽 胡蒋宁 肖 萍 洪学斌 罗丽萍
(南昌大学生命科学与食品工程学院1,南昌 330031)
(江西省植物资源重点实验室2,南昌 330031)
樟树(Cinnamomum camphora)为樟科樟属中经济价值最大的树种之一,主要分布在长江以南地区[1]。传统医学上利用樟树治疗风湿病、扭伤、支气管炎、肌肉酸痛等疾病[2]。樟树提取的芳香类精油能够抑制朽木菌[3],甚至能够驱除或杀死昆虫[4]。樟树籽含油量可达40%,且其中C10和C12两种中碳链脂肪酸的质量分数达90%以上[5-6],由中碳链脂肪酸构成的甘油酯可以被用于治疗吸收不良综合症[7]。我国樟树资源丰富,但是对樟树籽却缺乏合理利用,造成极大浪费,因此,若利用樟树籽油(Camphor Seed Oil,CSO)生产富含中碳链三酰甘油,可使樟树籽具有良好的应用前景。
二酰甘油(Diacylglycerol,DAG)是一类三酰甘油(Triacylglycerol,TAG)中一个脂肪酸被羟基取代的结构脂质,是天然植物油脂的微量成分及体内脂肪代谢的内源中间产物,但在自然油脂中产生的量较低。DAG有两种同分异构体,分别为1,2(2,3)-DAG和1,3 -DAG,由于是 GRAS(Generally Recognized as Safe)物质在日本和美国已被作为食用油[8]。富含DAG的常规油在味道、外观、物理性质、功能性等方面都和TAG油相似[9]。在人体内,DAG脂肪氧化消耗明显比TAG快,食用DAG油能够降低血浆TAG水平和抑制身体脂肪堆积[10-12],长期食用还能够抑制肥胖,有利于减肥[13-14],因此也被作为食品和医药的添加剂[15]。
目前酶法制备DAG的方法有酯化反应[16-17]、甘油解反应[18-19]和水解反应[20]3 种。酯化反应通过游离脂肪酸和去除水的甘油反应生成DAG,此反应得到的DAG纯度较高,但所需游离脂肪酸的价格昂贵。甘油解反应是除去TAG的酰基或者使之单甘脂酰化,但在反应过程中难以避免酶颗粒的凝聚,导致反应不充分。水解反应通过水解TAG得到DAG和脂肪酸,虽得到的DAG纯度较低,但单甘酯和DAG的分离比DAG和TAG的分离容易,这也为纯化DAG提供便利,更有利于工业化生产。
在考虑成本及酶利用有效化的前提下,以CSO为原料,采用固定化脂肪酶催化CSO部分水解,生成富含DAG的CSO(CSO-DAG)。由于酶的价格昂贵且随着反应的进行,酶活性逐渐降低甚至失活,导致循环使用次数减少,成本增加[21]。当反应产物中DAG质量分数低于40%时,酶被认为已失去使用价值。Mataumoto等[22]发现不同有机溶剂对lipase PS进行预处理导致酶催化活性提高也不同。故本试验脂肪酶进行预处理以提高反应次数。脂肪酶催化CSO水解反应以产物中DAG质量分数为指标,通过响应面设计选择最优化生产工艺。利用高效液相色谱法-蒸发光散射检测器(HPLC-ELSD)检测产物中甘油酯的组成。研究结果为樟树籽油酶法生产中链DAG油提供理论和试验依据。
1 材料与方法
1.1 试验材料与试剂
樟树籽:采自南昌大学校园,新鲜樟树籽去果皮后晾干备用。
樟树籽油的制备:热压榨法得到的毛油,4 000 r/min离心1 h,收集油层,4%白土吸附20 min脱色,过滤,0.1 MPa的真空条件下,将油吸入脱臭锅,加热至160℃,从锅底部通入少量水蒸汽,持续升温至180℃,恒温脱臭4 h,停止加热,冷却降温至70℃,破真空,放出油脂,过滤,得精炼的 CSO[23-24]。
固定化脂肪酶Lipozyme RM IM(来自Rhizomucor miehei)和 Lipozyme TL IM(来自Thermomyces lanuginosis),均由诺维信(中国)生物技术有限公司提供。乙腈和丙酮均为色谱纯,其他均为国产分析纯。
1.2 试验仪器
Agilent 1200型液相色谱仪:美国安捷伦公司;Model 300S蒸发光散射检测器(ELSD):法国Sedere公司;SHB-ⅢA循环水式多用真空泵:河南太康教材仪器厂;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;DK-S14型电热恒温水浴锅:上海森信实验仪器有限公司;SHA-B恒温振荡器:厦门精艺兴业科技有限公司;JA1003N精密天平:上海博力仪器设备有限公司。
1.3 试验方法
1.3.1 HPLC -ELSD 测定甘油酯的组成[20]
甘油酯组成的测定采用HPLC-ELSD法。待测样品在丙酮中的浓度为1%,经0.45 μm微孔有机滤膜过滤后,取 30 μL样品注入 Nova-Pak C18柱(150 mm ×3.9 mm,4 μm)(美国 Waters公司)中,流动相为丙酮∶已腈 =50∶50(V/V),流速:1 mL/min,柱温30℃。ELSD对产物中的脂类进行定性、定量分析。
1.3.2 脂肪酶的选择
分别称取5.00 g樟树籽油于2个15 mL的锥形瓶中,分别加入0.50 g的固定化脂肪酶(Lipozyme RM IM或Lipozyme TL IM)和蒸馏水,放入预热到反应温度的恒温水浴振荡器中反应3 h,转速为250 r/min。取出锥形瓶,用定性滤纸过滤除去反应液中的固定化酶,滤液7℃低温保存待测。
1.3.3 脂肪酶的预处理工艺[25]
分别称取0.60 g脂肪酶于3个15 mL的锥形瓶中,再分别加入10 mL叔丁醇或丙酮或不加有机溶剂,25℃恒温水浴2.50 h,抽滤除去溶剂,将脂肪酶加入到5.00 g CSO中浸泡1.50 h,抽滤除去CSO之后,再用有机溶剂浸泡10 min,旋转蒸发除去溶剂。然后用处理的酶进行水解反应。
1.3.4 响应面优化Lipozyme RM IM水解工艺
本试验Box-Behnken设计由3个变量组成,3个变量和它们的水平被确定为加酶量(油质量的8% ~12%)、含水量(酶质量的30% ~50%)和温度(55~75℃)。运用Design Expert 7.1产生17个不同试验设置确定优化条件(表1)。
2 结果与讨论
2.1 HPLC-ELSD检测结果
本试验水解底物为樟树籽油,故可以确定产物中仅含油脂类物质。Lee等[26]和汪勇等[27]利用反向HPLC-ELSD测定甘油酯类的出峰顺序为脂肪酸类、单甘脂类、DAGs、TAGs。Hu 等[29]樟树籽油进行GC和反相HPLC检测,确定了酯类组成[28]。天然油脂中DAG质量分数低于10%(m/m)[29]。对比樟树籽油及樟树籽油水解产物的HPLC图,依据图谱的变化可确定各类甘油酯,图1中显示峰1、峰2为脂肪酸和单甘脂,峰3、峰4为DAG,峰5为TAG。

图1 樟树籽油水解产物的HPLC图
2.2 脂肪酶的选择
Lipozyme RM IM、Lipozyme TL IM、Novozym 435为3种常用固定化脂肪酶,Babicz等[30]催化水解生产DAG时发现Lipozyme IM优于Novozym 435。脂肪酶选择的试验结果表明,Lipozyme RM IM催化产物中DAG和TAG质量分数分别为51.34%和37.94%,而Lipozyme TL IM催化产物中DAG和TAG质量分数分别为35.37%和57.85%。以 CSO为底物,经Lipozyme RM IM催化反应后,目标产物DAG的转化率明显高于Lipozyme TL IM,故以Lipozyme RM IM为催化剂,继续进行其水解反应工艺优化的研究。
2.3 预处理对Lipozyme RM IM使用次数的影响
对Lipozyme RM IM进行预处理发现,未经溶剂预处理的Lipozyme RM IM使用次数为9次,而经丙酮或叔丁醇预处理之后,使用次数增加为10和11次。通过预处理不但可以提高酶的反应次数,而且酶的使用寿命也能够有效延长[31],不同的有机溶剂对酶活性的提高影响很大。在适宜条件下,有机溶剂浸泡后的脂肪酶的活性和反应次数都得以增加,其可能的原因是有机溶剂使固定化酶的疏水基由原来的闭合状态转为张开状态,从而使活性部位暴露,构象的改变导致疏水底物趋向与脂肪酶键合,使其活性和使用寿命得以提高[32]。
2.4 模型评价
以DAG和TAG质量分数作为响应值(表1),模型中R2为0.979 1 和0.985 4,校正R2为0.952 2 和0.966 6,方差分析(表2)也显示 P 值均小于0.001,表明该模型极显著,其中两者的失拟项分别为0.068 9 和0.311 9,影响不显著,说明该模型不失拟,表明该模型成功有效。因此,该模型适合CSO制备DAG工艺的优化。

表1 Lipozyme RM IM催化樟树籽油水解生成DAG的Behnken-box设计及产物中DAG和TAG的质量分数
2.5 对DAG质量分数及TAG质量分数影响的主要因素及相互作用
影响脂肪酶催化水解生成DAG的主要因素有:加酶量、含水量、反应温度。通过DAG和TAG质量分数的后项消去回归的系数及P值分析表明(表3),在3个因素中,含水量对DAG的生成影响最大,其次为温度,加酶量影响最小。本试验中,加酶量对DAG质量分数的影响呈曲线,表明在反应过程中加酶量的最优值为10%(图2a)。酶的持续增加可以增加反应速度,但DAG总量不变,过量甚至可能会导致形成颗粒而减少接触面积,从而减缓反应速度。DAG含有一个羟基,在自然环境中亲水,导致DAG在水解反应过程中比 TAG更敏感[30],故含水量对DAG质量分数的影响最为显著。水作为反应介质,在水解过程中,DAG质量分数增加和TAG质量分数减少,最终形成动态平衡。起始反应过程中,TAG水解率大于DAG水解率,但随着反应进行而逐渐相反(图2b)。
温度影响脂肪酶反应的活性,较低温度使酶活性降低,进而降低反应速度;较高温度能够使反应速度加快,但超过最适宜温度时,温度升高则抑制酶活性,甚至会使酶失活。虽然升温能够增加水解作用,但由于升温使酶钝化而敏感,65℃为最适合反应温度(图2c)。

图2 影响DAG质量分数的主要因素

表2 方差分析表

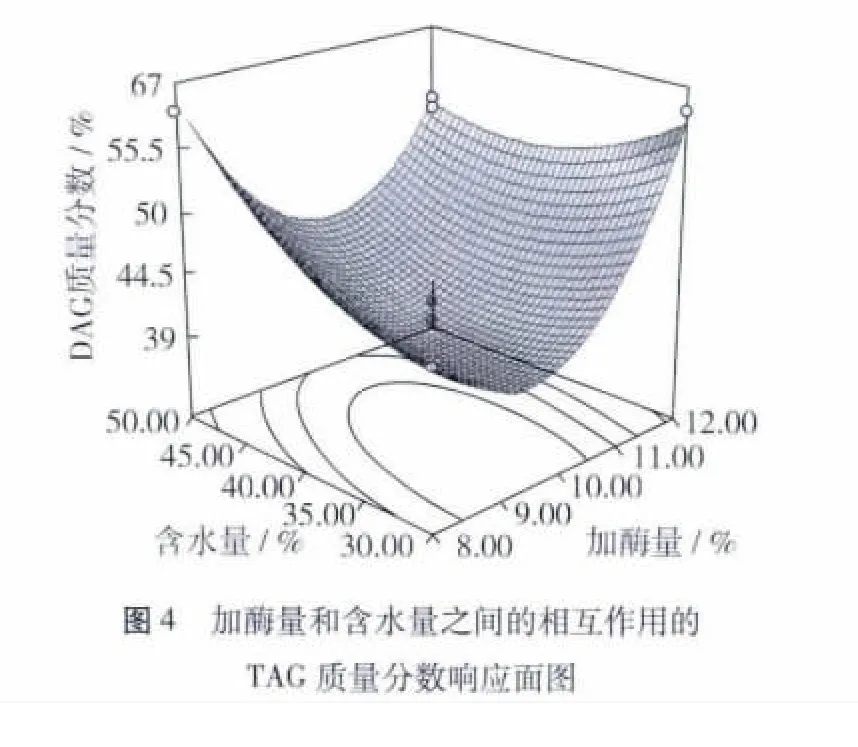
由表3可知,以DAG质量分数为响应值时,含水量和温度的交互作用显著。评估含水量和温度之间的相互作用,酶作为中介对DAG影响显著(P<0.05),基于响应面图(图3)可以观察到含水量和温度可以增加到较高值。在一定的范围内,增加含水量和温度可以增加DAG质量分数,反之含水量超过40%,则DAG质量分数相应减少。以TAG质量分数作为响应值时,加酶量、含水量和温度两两之间的交互作用均显著(P<0.05),其中温度和含水量的交互作用对TAG质量分数的影响最大,其次为加酶量和含水量。通过响应面图(图4)可以观察到,加酶量和含水量保持在较低水平。通过以上分析及模型预测可知,脂肪酶催化CSO生成DAG的最优化条件:加酶量为10%,含水量为40%,温度为65℃,在此条件下得到的DAG质量分数为50.38%,TAG质量分数为40.68%。
在优化条件下进行验证试验,得到的DAG质量分数和TAG质量分数分别为51.22%和35.61%,优于理论预测值,故此模型得到的水解条件准确可靠。
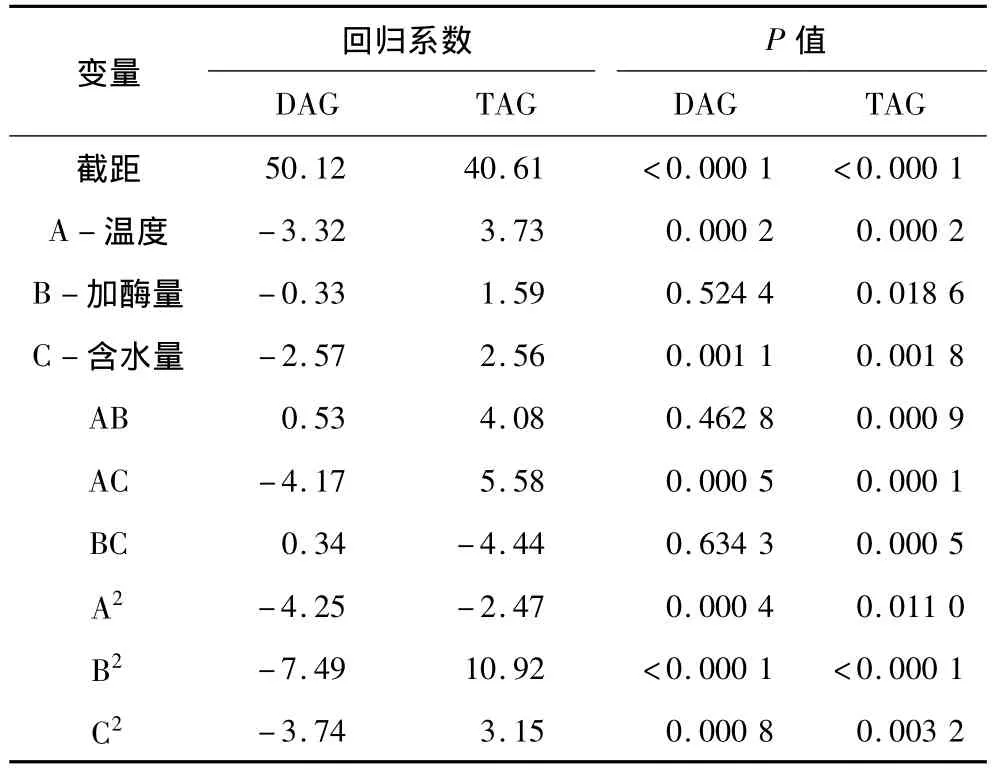
表3 DAG和TAG质量分数的后项消去回归的系数及P值
3 结论
本试验中,催化樟树籽油水解制备DAG的最佳固定化脂肪酶为Lipozyme RM IM,在对Lipozyme RM IM进行预处理试验中,以叔丁醇预处理效果较好,能够使其重复使用的次数达到11次。在Lipozyme RM IM催化水解生成CSO-DAG的反应过程中,采用响应面分析优化水解反应,得到的最佳反应条件是:加酶量为10%,含水量为40%,温度为65℃。反应产物中DAG质量分数可达50.38%。
[1]郑万钧.中国树木志[M].第一卷.北京:中国林业出版社,1983
[2]Lee H J,Hyun E A,Yoon W J,et al.In vitro anti- inflammatory and anti-oxidative effects of Cinnamomum camphora extracts[J].Journal of Ethnopharmacology.2006,(103):208 -216
[3]Wang S Y,Chen P F,Chang S T,et al.Antifungal activities of essential oils and their constituents from indigenous cinnamon(Cinnamomum osmophloeum)leaves against wood decay fungi.[J].Bioresource Technology,2005,96(7):813 -818
[4]Liu C H,Mishra A K,Tan R X,et al.Repellent and insecticidal activities of essential oils from Artemisia princeps and Cinnamomum camphora and their effect on seed germination of wheat and broad bean[J].Bioresource Technology,2006,97(15):1969-1973
[5]肖复明,江香梅,熊彩云,等.樟树种子油中脂肪酸成分分析[J].江西林业科技,2008(1):60-61
[6]周武,张彬,邓丹雯.樟树籽油提取的研究[J].中国油脂,2004,29(2):30 -31
[7]Nagao K,Yanagita T.Medium - chain fatty acids:Functional lipids for the prevention and treatment of the metabolic syndrome[J].Pharmacological Research,2010,(61):208 -212
[8]Soni M G,Kimura H,Burdock G A.Chronic study of diacylglycerol oil in rats[J].Food and Chemical Toxicology,2001,39(4):317-329
[9]Ogawa H,Okushima S,Kodama H.The cooking characteristics of diacylglycerol rich cooking oil when preparing dishes[J].Journal for the Integrated Study of Dietary Habits,2001,12(2):100-108
[10]Taguchi H,Watanabe H,Onizawa K,et al.Double - blind controlled study on the effects of dietary diacylglycerol on postprandial serum and chylomicron triacylglycerol responses in healthy humans[J].Journal of the American College of Nutrition,2000,19(6):789 -796
[11]Tada N,Yoshida H.Diacylglycerol on lipid metabolism[J].CurrentOpinion in Lipidology,2003,14(1):29 -33
[12]Tada N.Physiological actions of diacylglycerol outcome[J].Current Opinion in Clinical Nutrition and Metabolic Care,2004,7(2):145 -149
[13]Bishop W R,Bell R M.Attenuation of sn-1,2-diacylglycerol second messengers.Metabolism of exogenous diacylglycerols by human platelets[J].The Journal of biological chemistry,1986,261(27):12513 -12519
[14]Teramoto T,Watanabe H,Ito K,et al.Significant effects of diacylglycerol on body fat and lipid metabolism in patients on hemodialysis[J].The American Journal of Clinical Nutrition,2004,23(5):1122 -1126
[15]Fureby A M,Tian L,Adiercreutz P,et al.Preparation of diglycerides by lipase-catalyzed alcoholysis of triglycerides[J].Enzyme and Microbial Technology,1997,20(3):198-206
[16]Berger M,Laumen K,Schneider M P.Enzymatic esterification of glycerol I.Lipase - catalyzed synthesis of regioisomerically pure 1,3 - sn - diacylglycerols[J].Journal of the American Oil Chemists'Society,1992,69(10):955 -960
[17]Watanabe T,Shimizu M,Sugiura M,et al.Optimization of reaction condition for the production of DAG using immobilized 1,3 - regiospecific lipase lipozyme RM IM[J].Journal of the American Oil Chemists’Society,2003,80(12):1201-1207
[18]Yanai H,Tomono Y,Ito K,et al.Diacylglycerol oil for the metabolic syndrome[J].Nutrition Journal,2007,6(1):43-48
[19]Yamane T,Kang S T,Kawahara K,et al.High - yield diacylglycerol formation by solid-phase enzymatic glycerolysis of hydrogenated beef tallow[J].Journal of the American Oil Chemists'Society,1994,71(1):339 -342
[20]Ling - Zhi Cheong,Chin - Ping Tan,Kamariah Long.Production of a diacylglycerol-enriched palm olein using lipase-catalyzed partial hydrolysis:Optimization using response surface methodology[J].Food Chemistry,2007,105(4):1614-1622
[21]Rosu R,Yasui M,Iwasaki Y,et al.Enzymatic synthesis of symmetrical 1,3 - diacylglycerols by direct esterification of glycerol in solvent- free system[J].Journal of the American Oil Chemists'Society,1999,76(7):839 -843
[22]Mataumoto M,Kida K,Kondo K.Enhanced activities of lipase pretreated with organic solvents[J].Journal of Chemical Technology and Biotechnology,2001,76(10):1070 -1073
[23]曾益坤,胡文龙,夏红亮.注射用茶油精炼工艺的研究[J].中国油脂,2003,28(3):28 -31
[24]黄庆德,王江薇,黄沁洁,等.荠蓝籽冷榨制油和荠蓝籽油精炼工艺研究[J].中国油脂,2006,31(1):17 -20
[25]李培真,杨天奎,生产甘油二酯反应体系中脂肪酶活性提高及再生技术研究[J].中国油脂,2009,34(3):20-24
[26]Lee K T,Jones K C,Foglia T A.Separation of structured lipids by high performance liquid chromatography[J].Chromatographia,2002,55(3 -4):197 -201
[27]汪勇,宋坷珂,王丽丽,等.反相高效液相色谱法测定甘油二酯含量研究[J].中国粮油学报,2010(3):119-122
[28]Hu J L,Zhang B,Zhu X M,et al.Characterization of medium-chain triacylglycerol(MCT)-enriched seed oil from Cinnamomum camphora(Lauraceae)and its oxidative stability[J].Agricultural and Food Chemistry,2011,(59):4771 -4778
[29]Katsuragi Y,Yasukawa T,MatsuoN,et al.Diacyglycerol oil[M].Champaign New York:American Oil Chemists’Socie-ty Press,2004
[30]Babicz I,Leite S G F,Rodrigo O M A,et al.Lipase - catalyzed diacylglycerol production under sonochemical irradiation[J].Ultrasonics Sonochemistry,2010,17(1):4 -6
[31]黄凌云,赵希岳,蔡志强,等.预处理固定化脂肪酶催化合成生物柴油[J].中国油脂,2007,32(7):47 -50
[32]Chamorro S,Sanchez - Montero J M,Alcantara A R,et al.Treatment of Candida rugosa lipase with short-chain polar organic solven tsenhances its hydrolytic and synthetic activities[J].Biotechnology Letters,1998,20(5):499 -505.

