丹参中丹参酮提取物纯化工艺的研究
任 钰, 孟 美, 王化宇, 张炜煜
(长春中医药大学,吉林长春130117)
丹参为唇型科植物丹参Salvia mitiorrhiza Bge.的干燥根及根茎[1],具有祛瘀止痛、活血通经、清心除烦的功效[2-3]。其脂溶性成分为丹参酮类成分,主要有丹参酮Ⅰ、丹参酮ⅡA和隐丹参酮等,其中含丹参酮ⅡA量相对较多,约为0.1% ~0.9%[4]。现代药理研究表明[5-7],丹参酮具有预防心脑血管疾病、抗肝纤维化、改善肝脏微循环、抗真菌、抗血小板聚集及神经保护作用等多种药理作用。但丹参酮属于菲醌类衍生物,在溶液中光照易发生光化反应而被破坏[8],故本实验采用避光乙醇回流提取法进行提取,以大孔树脂对丹参脂溶性提取部位进行纯化,考察了大孔树脂纯化丹参酮提取物的工艺参数,以期获得符合新药申报规定要求的丹参酮纯化物,为丹参的相关制剂的生产提供可靠的依据。
1 仪器与试药
丹参 (河南聚仁中药饮片有限公司,经长春中医药大学鉴定教研室姜大成教授鉴定为唇形科植物丹参的根,批号:110310);丹参酮ⅡA对照品(中国食品药品检定研究院,批号:110766-200518);隐丹参酮对照品 (中国食品药品检定研究院,批号:110852-200305);甲醇 (Sigma公司,色谱纯);乙腈 (Sigma公司,色谱纯);乙醇(北京化工厂,分析纯);AB-8大孔吸附树脂、D101大孔吸附树脂、S-8大孔吸附树脂、HPD100大孔吸附树脂、X-5大孔吸附树脂 (沧州宝恩吸附材料科技有限公司)。
Agilent 1200Series高效液相色谱仪 (美国安捷伦公司);Agilent VWD型检测器 (美国安捷伦公司);KQ2200B型超声波清洗器 (昆山市超声仪器有限公司);JA5103N电子天平 (上海民桥精密科学仪器有限公司);UV—9200型紫外可见分光光度计 (北京瑞利分析仪器公司);DZF-6050型真空干燥箱 (上海一恒科技有限公司);RE—52AA型旋转蒸发器 (上海亚荣生化仪器厂)。
2 方法与结果
2.1 丹参粗提液的制备 采用本课题组实验优化的丹参最佳提取工艺(《正交试验优选丹参中丹参酮提取物的提取工艺》待发表)进行提取,取丹参药材1 kg,加6倍于药材量的80%的乙醇避光加热回流提取一次,提取时间0.5 h,过滤,滤液减压浓缩至无醇味。将提取液转移至1 000 mL的量瓶,加蒸馏水定容至刻度,得到粗提液的质量浓度为1 g生药/mL,备用。
2.2 隐丹参酮和丹参酮ⅡA的测定方法的建立
2.2.1 色谱条件 Agilent Zorbox SB-C18色谱柱(250 mm×4.6 mm,5μm);流动相为乙腈 (A)-0.05%磷酸溶液 (B),按下表1进行梯度洗脱;体积流量为1.2 mL/min;检测波长为270 nm;柱温为25℃。理论塔板数以隐丹参酮计不低于20 000。

表1 梯度洗脱流动相Tab.1 Gradient elution of mobile phase
2.2.2 对照品溶液的制备 称取隐丹参酮对照品约1 mg和丹参酮ⅡA对照品约2.5 mg,精密称定,置10 mL量瓶中,加甲醇适量,振摇使溶解,甲醇稀释至刻度,摇匀,制成每1 mL含隐丹参酮0.093 0 mg和丹参酮ⅡA0.266 4 mg的混合溶液,即得。
2.2.3 供试品溶液的制备 取本品约5 mg,精密称定,置10 mL量瓶中,加甲醇使溶解,并稀释至刻度,摇匀,滤过,取续滤液,即得。
2.2.4 线性关系考察 分别精密吸取2.2.1项下对照品溶液0.05、0.5、1、3、5 mL,置于5 mL量瓶中,加甲醇稀释至刻度,摇匀,作为不同质量浓度对照品溶液;分别将不同质量浓度对照品溶液进样10μL测定,记录峰面积,以对照品峰面积(Y)为纵坐标,对照品质量浓度 (X)为横坐标,绘制标准曲线。隐丹参酮的回归方程为Y=55 091X-24.68,r=0.999 8;丹参酮ⅡA的回归方程为Y=72 473X-109.5,r=0.999 8。表明隐丹参酮在0.000 93~0.093 00 mg/mL范围内呈良好线性关系;丹参酮ⅡA在0.002 664~0.266 400 mg/mL范围内呈良好线性关系。
2.2.5 精密度试验 分别取两批平行的样品3份,按2.2.3项下方法制备供试品溶液,依法进行测定。隐丹参酮和丹参酮ⅡA的RSD分别为0.37%、0.34%,结果表明测定方法精密度良好。
2.2.6 重复性试验 取同一批样品6份,按2.2.3项下方法制备供试品溶液,依法进行测定。隐丹参酮和丹参酮ⅡA的 RSD分别为0.35%、0.35%,结果表明测定方法重复性良好。
2.2.7 稳定性试验 在本试验条件下,取供试品溶液分别在室温放置0、2、4、6、8、12 h,依法进行测定。隐丹参酮和丹参酮ⅡA的RSD分别为0.67%、0.55%,结果表明供试品溶液至少在12 h内稳定性良好。
2.2.8 加样回收试验 精密吸取已知量的供试品溶液6份,分别精密加入0.029 40 mg隐丹参酮、0.087 02 mg丹参酮ⅡA的丹参酮对照品溶液,依法进行测定,按公式 [加入对照品后测得总量-样品中所含被测组分量)/加入对照品量×100%计算回收率。隐丹参酮和丹参酮ⅡA平均回收率分别为99.78%、97.89%,结果表明本方法测定隐丹参酮和丹参酮ⅡA的回收率良好。
2.2.9 样品测定 取待测样品,按2.2.3项下方法制备供试品溶液,用0.22μm的微孔滤膜滤过,取续滤液,进样量10μL,按上述色谱条件测定色谱峰面积,根据各回归方程计算隐丹参酮和丹参酮ⅡA的量。
2.3 树脂的选择
2.3.1 树脂的预处理 取适量S-8、AB-8、HPD-10、X-5、D-101树脂,乙醇浸泡24 h,装柱,乙醇洗至流出液加等量去离子水后几乎无白色浑浊为止,去离子水洗至无醇味,备用。
2.3.2 树脂类型的筛选
2.3.2.1 静态吸附试验 分别准确称取上述5种处理好的大孔吸附树脂2.0 g,置于100 mL的广口瓶中。再准确称取丹参粗提液5份,每份0.2 g,分别加入50 mL乙醇溶解,将溶液置于盛有大孔吸附树脂的广口瓶中,25℃恒温水浴振荡24 h,使大孔树脂充分吸附。准确量取吸附液25 mL,置于50 mL蒸发皿中,水浴蒸干,加甲醇溶解,稀释至25 mL,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算其吸附率。吸附量=[(初始质量浓度-吸附后质量浓度)×吸附液体积];吸附率(%)=[吸附量/初始样品量]×100%。
2.3.2.2 静态解吸附试验 充分吸附后的大孔树脂中加50 mL 70%乙醇,25℃恒温水浴振摇24 h,准确量取5 mL解吸液,置于50 mL蒸发皿中,水浴蒸干,加甲醇溶解,稀释至25 mL,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算其解吸率,确定最佳树脂。结果见表2。

表2 大孔吸附树脂筛选结果Tab.2 Screening results of macroporous adsorption resin
结果表明,综合隐丹参酮和丹参酮ⅡA的吸附率、洗脱率,X-5型大孔吸附树脂较好,因此,试验选择X-5型树脂。
2.4 动态吸附工艺研究
2.4.1 上样液质量浓度的考察 将预处理后的X-5树脂湿法装柱,分别考察0.1、0.2、0.4、0.8 g生药/mL的上样液质量浓度,2 mL/min体积流量上样3.5 mL(0.5 BV,试验选用层析柱柱体积为7 mL),吸附2 h后,以2 mL/min体积流量70%乙醇洗脱5 BV,收集流出液,水浴蒸干,按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算其洗脱率,确定最佳上样液质量浓度。结果见表3。

表3 上样液质量浓度考察结果Tab.3 Investigation results of sam p le concentration
结果表明,上样液质量浓度对丹参酮ⅡA和隐丹参酮洗脱率有一定影响,上样液质量浓度为0.2g生药/mL较好。因此,试验选择上样液质量浓度为0.2 g生药/mL。
2.4.2 泄露曲线的考察 将预处理后的X-5树脂湿法装柱,0.2 g生药/mL上样液以2 mL/min的体积流量上样5 BV,每0.5 BV接收流出液,收集流出液,水浴蒸干。按2.2.3项下方法制备供试品溶液,采用HPLC测定流出液中丹参酮ⅡA和隐丹参酮的量,计算其流出液中质量浓度,流出液质量浓度为上样液质量浓度的10%时,即为X-5型树脂对丹参粗提液的吸附泄露点,此时上样体积即为最佳上样量。结果见表4。
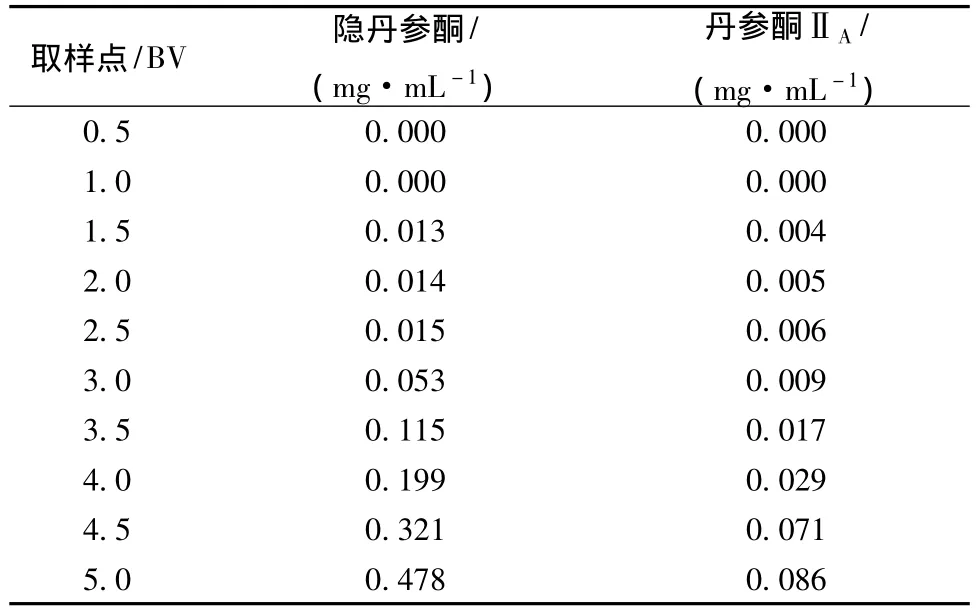
表4 吸附泄露点测定结果Tab.4 Adsorption of leak point determination results
结果表明,隐丹参酮、丹参酮ⅡA上样质量浓度分别为1.129、0.786 mg/mL。上样量为3.5 BV时,隐丹参酮泄露质量浓度为0.115 mg/mL,接近上样液质量浓度的10%,上样量为4.5 BV时,丹参酮ⅡA泄露质量浓度为0.071 mg/mL,接近上样液质量浓度的10%。因此,试验选择4.5 BV为丹参酮提取液最佳上样量。
2.4.3 上样速度的考察 将预处理后的X-5树脂湿法装柱,分别考察 0.5、1.0、2.0、3.0、4.0 mL/min的上样体积流量,以0.2 g生药/mL上样液上样4.5 BV,吸附2 h后,以2 mL/min体积流量水洗脱3 BV、70%乙醇洗脱5 BV,收集流出液,水浴蒸干。按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算洗脱率,确定最佳上样速度。结果见表5。

表5 上样速度考察结果Tab.5 Investigation results of samp le rate
结果表明,随着上样速度逐渐增大,隐丹参酮和丹参酮ⅡA洗脱率先增大后减小,上样体积流量为3 mL/min时较好,因此,试验选择3 mL/min为最佳上样体积流量。
2.4.4 洗脱剂体积分数的考察 将预处理后的X-5树脂湿法装柱,分别考察75%、80%、85%、90%、95%体积分数的乙醇。以0.2 g生药/mL上样液3 mL/min上样4.5 BV,吸附2 h后,以2 mL/min体积流量水洗脱3 BV、不同体积分数乙醇洗脱5 BV,接受流出液,水浴蒸干。按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算洗脱率,确定最佳洗脱剂体积分数。结果见表6。

表6 洗脱剂体积分数考察结果Tab.6 Investigation results of eluent concentration
结果表明,随着洗脱剂乙醇体积分数的增大,隐丹参酮和丹参酮ⅡA洗脱率逐渐增大,当洗脱剂乙醇体积分数大于90%时,隐丹参酮和丹参酮ⅡA洗脱率变化不大,因此,试验确定90%乙醇为洗脱剂。
2.4.5 洗脱速度的考察 将预处理后的X-5树脂湿法装柱,分别考察 0.5、1.0、2.0、3.0、4.0 mL/min的上样体积流量。以0.2 g生药/mL上样液3 mL/min上样 4.5 BV,吸附 2 h后,以 2 mL/min体积流量水洗脱3 BV,90%乙醇不同速度洗脱5 BV,接受流出液,水浴蒸干。按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算洗脱率,确定最佳洗脱体积流量。结果见表7。

表7 洗脱速度考察结果Tab.7 Investigation results of elution rate
结果表明,洗脱体积流量太慢,容易将杂质洗脱,洗脱体积流量太快,则洗脱剂不能完全接触吸附物,洗脱不完全。当洗脱体积流量为2 mL/min时较好,因此,试验选择2 mL/min为最佳洗脱体积流量。
2.4.6 洗脱剂用量的考察 将预处理后的X-5树脂湿法装柱,以0.2 g生药/mL上样液3 mL/min上样4.5 BV,吸附2 h后,以2 mL/min体积流量水洗脱3 BV、90%乙醇洗脱10 BV,每1 BV接收洗脱液,水浴蒸干。按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算洗脱量,确定洗脱剂用量。结果见图1。

图1 洗脱剂用量考察结果Fig.1 Investigation results of eluting agent
结果表明,洗脱剂用量增加至8 BV时,隐丹参酮和丹参酮ⅡA洗脱量接近于0,因此,试验选择最佳洗脱剂用量为8 BV。
2.5 丹参酮粗提液纯化工艺验证性试验 选择500 mL层析柱,将预处理后的X-5树脂湿法装柱,以0.2 g生药/mL上样液3 mL/min上样4.5 BV,吸附3 h后,以2 mL/min水洗3 BV、90%乙醇洗脱8 BV,接受流出液,浓缩、干燥至恒定质量,按2.2.3项下方法制备供试品溶液,采用HPLC测定丹参酮ⅡA和隐丹参酮的量,计算洗脱率、纯度,平行验证3次。结果见表8。

表8 最佳工艺验证结果Tab.8 Validation results of optimum technology
结果表明,丹参酮平均纯度为54.78%,RSD为0.17%,隐丹参酮平均洗脱率为90.18%,RSD为0.34%;丹参酮ⅡA平均洗脱率为87.64%,RSD为0.84%。工艺稳定可行。
3 讨论
试验曾对大孔吸附树脂残留物的含量进行检查,按《中华人民共和国药典》2010年版二部附录VIII P残留溶剂测定法要求对苯乙烯骨架型大孔吸附树脂通常做6种残留物的项目检查,包括甲苯、二甲苯、二乙烯基苯、烷烃类、苯乙烯和苯。本实验采用气相色谱法对洗脱液中的一种主要成分苯乙烯做了检测。结果在苯乙烯标准品的位置上。乙醇洗脱液没有出现相应的峰,且乙醇洗脱液与空白洗脱液的峰形一致。表明大孔吸附树脂的洗脱液中不含有苯乙烯类杂质成分,树脂洗脱完全,符合《中国药典》规定。
丹参酮ⅡA对光、热均较敏感,溶液中光照、高温条件下易分解,本实验考察了丹参酮提取物干燥温度,发现丹参酮提取物中丹参酮ⅡA在50℃下干燥较稳定,60℃下损失率为24.87%。因此,丹参酮提取、干燥过程中,选择避光、合适的温度非常必要,但由于大工业生产时采用多功能提取罐,提取罐本身是密闭的,因此在实验室采用避光回流提取。
大孔树脂具有吸附性强、吸附空间大、容易吸附洗脱、机械强度好、可回收再利用和流体阻力小等优点,可以替代传统的有机试剂纯化方法,在药物有效成分的纯化中应用广泛,适合于大工业生产。
本实验通过对几种常用的大孔吸附树脂吸附、洗脱能力的比较,筛选出X-5型大孔树脂用于丹参中丹参酮提取物纯化,表明该大孔树脂能够有效地对丹参酮提取物进行富集。优选工艺条件下丹参中丹参酮提取物质量分数达到54.78%,符合申报新药中要求有效成分质量分数达到50%以上。本工艺简便、稳定、可行性高,为含丹参酮ⅡA制剂的研究奠定了基础。
[1]国家药典委员会.中华人民共和国药典:2010年一部[S].北京:中国中医药出版社,2010:70.
[2]罗彩莲.丹参的药理作用与临床应用[J].中国当代医药,2012,19(12):11-12.
[3]毕跃峰,贾 陆,张小娟,等.同提取方法对丹参中丹参酮ⅡA和丹酚酸B含量测定的影响[J].药物分析杂志,2009,29(7):1209-1212.
[4]杨千才,柳仁民.丹参脂溶性成分提取方法研究[J].中成药,2010,32(4):585-588.
[5]浦锡娟,徐凯琳.丹参的药理作用研究进展[J].临床医学工程,2009,16(8):154-156.
[6]刘 星,鲍万国,牛俊奇,等.复方丹参对门脉高压症大鼠血流动力学的影响[J].吉林大学学报,2006,32(2):232-234.
[7]何跟云.丹参的药理作用与临床应用[J].浙江中西医结合杂志,2011,21(2):124-125.
[8]范广俊,范 青,赵 珊,等.丹参酮ⅡA理化性质的研究[J].药学服务与研究,2008,8(4):296-297.
[9]贾存勤,李阳春,屠腾飞,等.气相色谱法检测大孔吸附树脂中的有机残留物[J].色谱,2005,23(6):655-658.
[10]李朝霞,李云谷.大孔吸附树脂纯化丹参总酚酸的工艺研究[J].中国实验方剂学杂志,2008,14(3):30-31.
[11]孟召全,陈鸿楠,钱 捷.丹参酮ⅡA的分离纯化[J].中国实验方剂学杂志,2010,16(2):6-7.
[12]吴婉莹,杨 洲,侯晋军,等.总丹参酮不同纯化工艺的比较[J].中草药,2008,39(12):1815-1818.

