Urocortin I预处理对缺氧/复氧大鼠心肌线粒体膜电位的影响*
顾 燕,孙文婷,邓胜利,张 琳,田 伟
(遵义医学院麻醉学系,贵州遵义 563099)
线粒体膜电位(mitochondrial membrane potential,MMP)下降被认为是细胞凋亡的特异性标志,同时也是早期细胞凋亡不可逆的事件。以往研究证实,通过开放线粒体ATP敏感性钾通道(mitoKATP)可以抑制线粒体膜电位的下降[1]。UrocortinⅠ(UcnⅠ)是一种由40个氨基酸残基构成的新型神经肽。近期研究发现,UcnⅠ具有一定的心肌保护效应[2],但这一保护效应与MMP及MPP的变化与UcnⅠ和mitoKATP之间存在怎么样的关系尚未见报道。因此,本实验拟通过激光共聚焦显微镜观察UcnⅠ预处理对缺氧/复氧后大鼠心肌细胞线粒体膜电位的影响,来进一步阐明UcnⅠ抗心肌缺血再灌注损伤的作用机制。
1 材料与方法
1.1 实验动物 250 g左右SPF级健康雄性Sprague Dawley大鼠30只,由第三军医大学大坪医院动物实验中心提供,许可证号:SCXK(渝)2012-0005。
1.2 主要试剂及仪器 UrocortinⅠ、5-羟葵酸、M199、Ⅱ型胶原酶、层黏连蛋白、EGTA、BSA均购自(美国,Sigma公司);JC-1线粒体膜电位检测试剂盒(中国,江苏碧云天生物研究所),其他试剂为国产分析纯。SP2型激光共聚焦显微镜(德国,莱卡公司),全自动数码成像与分析系统(美国,GenGenius,Syngene),MPA 离体心脏灌注装置系列(中国,北京吉安得尔科技有限公司),二氧化碳培养箱(美国,Forma公司),倒置相差显微镜为OLYMPUS CK2公司、纯水处理器(美国,Millipore)。
1.3 实验分组与处理 成年大鼠心肌细胞的分离与培养参照文献[3],将培养24 h后的心肌细胞随机分成4组:正常组(Nor组):37℃95%O2+5%CO2培养箱中持续培养155 min;缺氧/复氧组(I/R组):37℃95%O2+5%CO2正常培养55 min后,在37℃95%N2+5%CO2培养箱中缺氧40 min,再复氧60 min;UrocortinⅠ组(UcnⅠ组):正常培养25 min后用终浓度10-8mol/L的UcnⅠ处理30 min,缺氧40 min,再复氧60 min;5-羟奎酸+UrocortinⅠ组(5-HD+UconⅠ组):正常培养20 min后先用终浓度100 umol/L的5-HD处理5 min后,余处理同UcnⅠ组。各组于复氧末行激光共聚焦显微镜检测线粒体膜电位。
1.4 激光共聚焦显微镜检测线粒体膜电位 室温避光条件下,按照JC-1膜电位检测试剂盒说明配置JC-1染色工作液。吸除细胞培养基,另加入1 mL细胞培养基及1 mLJC-1染色工作液,放置37℃细胞培养箱中孵育20 min。孵育期间,用去离子水将5倍浓度的JC-1染色缓冲液按照比4∶1比例稀释,并放置37℃水浴箱中预热。孵育结束后,吸除上清液,用1倍浓度的JC-1染色缓冲液洗涤4次,加入2 mL细胞培养基,激光共聚焦显微镜观察心肌细胞荧光强度。在线粒体膜电位较低时,JC-1在线粒体基质中为单体(monomer)形式,产生绿色荧光;在线粒体膜电位较高时,JC-1在线粒体基质中形成聚合物(J-aggregates),则产生红色荧光;常用红、绿荧光的相对比值来衡量线粒体膜电位的高低。(图像采集及观察采用单盲法随机选择8个不同视野内的30个心肌细胞观察红、绿荧光强度)
1.5 统计分析 采用SPSS17.0统计软件进行统计分析,实验数据用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 成年大鼠心肌细胞分离结果 显微镜下可见新分离的心肌细胞呈杆状或矩形,横纹肌清晰可见,细胞厚实,细胞一端可呈阶梯状(见图1)。10%~15%的心肌细胞发生自发性收缩活动,节律为5~20次/min不等,其余细胞呈静息状态。
2.2 激光共聚焦显微镜下各组心肌细胞膜电位荧光图见图2,其荧光值结果显示:Nor组心肌细胞线粒体膜电位较高(P<0.01),I/R组线粒体膜电位与Nor组相比显著下降(P<0.01);而UcnⅠ组线粒体膜电位明显高于I/R组和5-HD+UcnⅠ组(P <0.01,见表 1)。
图1 新分离成年大鼠心肌细胞
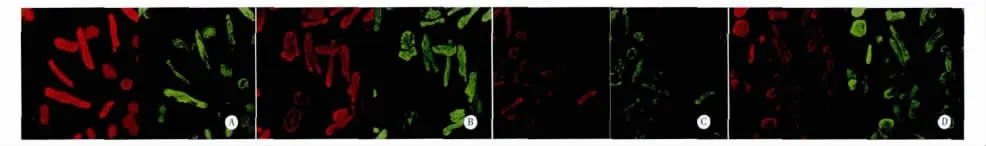
图2 激光共聚焦显微镜下心肌细胞线粒体膜电位荧光图(×400倍)
表1 缺氧/复氧后各组心肌细胞线粒体膜电位荧光值比较(n=30,±s)
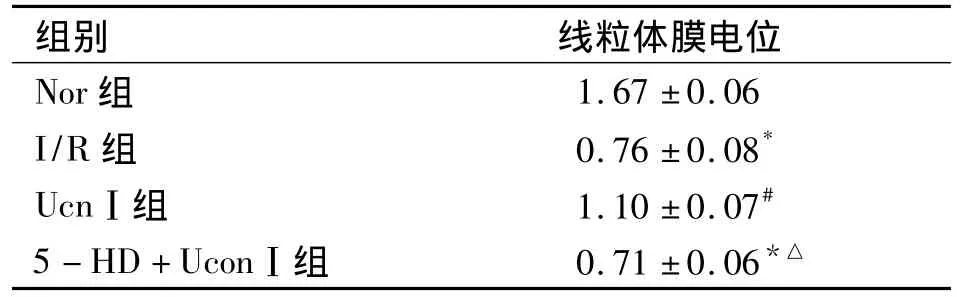
表1 缺氧/复氧后各组心肌细胞线粒体膜电位荧光值比较(n=30,±s)
注:与 Nor组比较,*P<0.01;与 I/R 组比较,#P<0.01;与 UcnⅠ组比较△P <0.01。
1.67 ±0.06 I/R 组 0.76 ±0.08*UcnⅠ组 1.10 ±0.07#5 -HD+UconⅠ组 0.71 ±0.06组别 线粒体膜电位Nor组*△
3 讨论
心肌缺血再灌注损伤(Ischemia Reperfusion Injury,IRI)是指心肌在遭受一段时间的缺血、缺氧后,恢复血液灌注时,受损的心肌不但不能恢复甚至发生更为严重不可逆的损害。早在1999年Kohli V等的研究已经证实,细胞凋亡是缺血再灌注损伤的重要原因之一[4]。细胞可以通过两条独立的途径发生凋亡。一条是通过死亡受体即外源性途径,而另一条则是由线粒体启动的內源凋亡程序。目前认为线粒体介导的细胞凋亡通路是导致IRI的主要途径[5],而线粒体膜电位的改变与其密切相关。线粒体膜电位主要是在氧化呼吸过程中由位于线粒体内膜上的质子泵将基质内的质子泵入膜间隙,形成质子梯度,使线粒体内膜两侧发生变化,即:线粒体基质中产生负电荷,而线粒体膜间隙中产生正电荷,使内外膜两侧形成电位差,呈现内负,外正状态。正常线粒体的膜电位是维持线粒体进行氧化磷酸化,产生ATP的先决条件,是保持线粒体功能所必需的[6]。
本研究通过激光共聚焦显微镜检测技术发现:UcnⅠ组线粒体膜电位明显高于I/R组,但低于Nor组,说明UcnⅠ预处理可以稳定心肌细胞缺氧/复氧后线粒体膜电位,这可能是UcnⅠ产生心肌保护作用的原因之一。既往有研究报道,UcnⅠ预处理可以上调线粒体敏感性钾通道亚单位Kir6.1的基因表达,而大量研究已经证实线粒体敏感性钾通道是抗心肌缺血再灌注损伤的终末效应器[7]。为了进一步研究UcnⅠ稳定线粒体的膜电位是否与开放线粒体敏感性钾通道有关,本研究选择了特异性线粒体敏感性钾通道阻断剂5-羟葵酸,结果显示,5-羟葵酸阻断了UcnⅠ对线粒体膜电位的稳定作用。因此,我们推测UcnⅠ预处理对线粒体膜电位的稳定作用是与线粒体敏感性钾通道的开放有关其可能的机制是:UcnⅠ通过激活线粒体敏感性钾通道,增加钾离子外流,抑制电压依赖性钙通道的钙离子内流,加速钠离子和钙离子交换促进线粒体内钙离子的释放,减轻线粒体钙超载,恢复线粒体内膜质子跨膜潜能,使膜电位去极化,逆转线粒体通透性转孔的开放,减少CytoC等膜间蛋白释放入胞质,抑制了caspase-3级联反应,阻止细胞凋亡,从而促进缺氧心肌细胞功能的恢复[8-9]。Rutka等[10]研究同样证明了,细胞在不同因子作用下发生凋亡时伴有线粒体膜电位的下降,如果能稳定线粒体膜电位,不但可以阻止凋亡的进展而且可以防止细胞凋亡。本实验支持这一理论,但具体机制还有待进一步的实验研究。
综上所述,UcnⅠ预处理可以稳定成年大鼠缺氧/复氧后心肌细胞线粒体膜电位,产生心肌保护作用,其机制可能与开放线粒体敏感性钾通道有关。
[1]Li J,Lang M J,Mao X B,et al.Antiapoptosis and mitochondrial effect of pioglitazone preconditioning in the ischemic/reperfused heart of rat[J].Cardiovasc Drugs T-her,2008,22(4):283 -291.
[2]Kuizon E,Pearce E G,Bailey S G,et al.Mechanisms of action and clinical implications of cardiac urocortin:a journey from the heart to the systemic circulation,with a stopover in the mitochondria[J].Int J Cardiol,2009,137(3):189-194.
[3]张琳,邓胜利,姚刚,等.UrocortinⅠ对缺氧/复氧心肌细胞钙离子的影响[J].遵义医学院学报,2012,35(3):193-195.
[4]Kohli V,Selzner M,Madden J F,et al.Endothelial cell and hepatocyte deaths occur by apoptosis after ischemiareperfusion injury in the rat liver[J].Transplantation,1999,67(8):1099 -1105.
[5]Wang X,He F,Liao Y,et al.Baicalin pretreatment protects against myocardial ischemia/reperfusion injury by inhibiting mitochondrial damage - mediated apoptosis[J].Int J Cardiol,2013,13(3):167 -178.
[6]Kroemer G,Zamzami N,Susin S A.Mitochondrial control of apoptosis[J].Immunol Today,1997,18(1):44 -51.
[7]Yang L,Yu T.Prolonged donor heart preservation with pinacidil:the role of mitochondria and the mitochondrial adenosine triphosphate - sensitive potassium channel[J].J Thorac Cardiovasc Surg,2010,139(4):1057 -1063.
[8]欧袁,杨双强,辛东.Urocortin对缺血大鼠心肌线粒体凋亡通路的影响[J].心脏杂志,2010,22(1):6-11
[9]Calderón-Sánchez E M,Ruiz- Hurtado G,Smani T,et al.Cardioprotective action of urocortin in postconditioning nvolves recovery of intracellular calcium handling[J].Cell Calcium,2011,50(1):84 -90.
[10]Rutka J T,De Armond S J,Giblin J,et al.Effect of retinoids on the proliferation,morphology and expression of glial fibrillary acidic protein of an anaplastic astrocytoma cell line[J].Int J Cancer,1988,42(3):419 -427.

