质子导体燃料电池阴极材料的研究及发展概述
赵 凌,夏长荣
(中国科学技术大学材料系,中国科学院能量转换材料重点实验室,合肥 230026)
质子导体燃料电池阴极材料的研究及发展概述
赵 凌,夏长荣
(中国科学技术大学材料系,中国科学院能量转换材料重点实验室,合肥 230026)
能源危机和环境污染是全世界在可持续发展道路中所面临的难题。固体氧化物燃料电池(SOFC)具有高能量转化效率和低污染排放,被认为是未来能源经济的基石。其中,以质子导体作为电解质的固体氧化物燃料电池(H-SOFC)由于具有高燃料利用率、高理论电动势、高离子迁移数以及低传导活化能,因而备受关注。然而,与氧离子导体固体氧化物燃料电池(O-SOFC)相比,H-SOFC的材料选择和理论体系还处于初级阶段,尤其是H-SOFC的阴极。在H-SOFC中,氢气在阳极被氧化,形成质子,通过电解质迁移到阴极,而后与氧进行电极反应生成水,其阴极的电极过程比O-SOFC更为复杂。寻找高性能的阴极材料和探索H-SOFC中的阴极反应机理,对于H-SOFC的发展具有重要的意义。围绕质子导体阴极材料的发展进行深入调研,着重阐述和总结了不同传导类型的阴极材料的电化学行为及其反应模型,为H-SOFC阴极材料的发展和应用提供了一种思路。
固体氧化物燃料电池;质子导体;阴极材料;反应模型
1 前言
能源是人类活动的物质基础。纵观历史,人类社会的进步离不开优质能源的出现和先进能源技术的使用。当今世界,能源的发展,能源和环境,是全世界共同关心的问题,决定着社会发展的进程和未来[1]。固体氧化物燃料电池(SOFC)具有高能量转化效率和低污染排放等特点,被认为是未来能源经济的基石[2]。其中,以质子导体作为电解质的固体氧化物燃料电池(H-SOFC)相比氧离子导体电池(O-SOFC)来说,具有高燃料利用率、高理论电动势、高离子迁移数以及低传导活化能等优势,因而备受关注[3]。另外,相比于其他类型的质子导体电池,如在常温使用的质子交换膜燃料电池(PEMFC),H-SOFC不需采用成本高的贵金属催化剂,可以避免CO对贵金属电极的毒化作用,也不需采用复杂的水/热管理系统[4]。
H-SOFC是由电解质和两个多孔电极(接触氧化剂的阴极以及接触燃料的阳极)共同组成的“三明治”结构。其中多孔的阴、阳极是气体催化反应及电流传输的主要场所;致密的电解质起着传导质子和隔离燃料气和氧化气的作用。
图1是H-SOFC的工作原理。H-SOFC的电解质材料由质子导体组成,如掺杂BaCeO3,掺杂BaZrO3等。H2进入H-SOFC的阳极侧,并发生吸附解离,而后失电子,形成质子H+,质子穿过质子导体电解质到达阴极。在阴极一侧,O2移动到阴极-电解质接触界面上,发生吸附解离并与从电解质传递过来的H+进行反应,生成H2O。在H-SOFC中,产物水蒸气是在阴极产生的。
2 质子导体固体氧化物燃料电池的阴极要求
阴极是H-SOFC的重要组成部分,主要作用是为氧化剂的电化学还原反应提供场所。H-SOFC对阴极材料有如下基本要求。
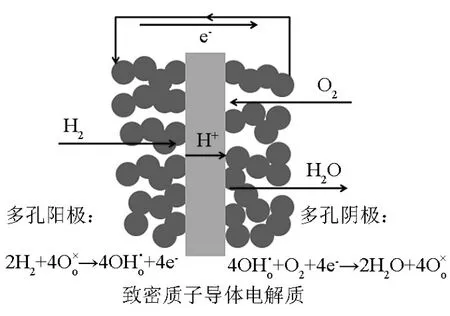
图1 H-SOFC的工作原理示意图Fig.1 Schematic diagram of operating principle for H-SOFCs
电导率:在氧化气氛中和工作温度下,阴极材料要有足够高的电子电导率,降低阴极的欧姆极化,同时还须具备一定的离子电导率,提供离子的输运,增大反应活性区。
催化活性:阴极材料必须对O2的电化学还原反应具有足够高的催化活性,即降低阴极的活化极化。
一定的孔隙率:为了减小浓差极化,方便燃料气的输运和产物的排出,阴极材料必须有足够的孔隙率。孔隙率太低,则浓差极化增大;孔隙率太高,三相反应活性区(TPB)也会相应的减小,同时材料的强度也随之降低。
稳定性:在氧化气氛和水蒸气气氛中,在工作温度范围内,阴极须在晶格结构和微观形貌上保持一定的稳定性。
相容性:在制备和操作温度下,阴极材料都应该与其他电池材料化学相容,热膨胀系数匹配,不与邻近组件发生反应等。
其他:足够的机械强度、低成本和易加工等特点。
3 不同传导机理的H-SOFC阴极材料
H-SOFC阴极的反应较O-SOFC的阴极反应复杂,参与反应的物种也比O-SOFC多。根据阴极材料中的不同传导机理,可以把H-SOFC阴极大体分为以下5类:电子导体单相阴极、氧离子电子混合导体单相阴极、氧离子导体电子导体复合阴极、质子电子混合导体单相阴极、质子导体电子导体复合阴极。
3.1 H-SOFC电子导体单相阴极
当电子传导作为阴极材料中唯一存在的传导方式的时候,其可能的电极反应步骤如图2所示。氧分子首先吸附到阴极表面,并解离成自由氧(O);自由氧经过电催化得到电子,部分还原,形成氧离子(O-),并扩散到阴极(氧离子相)-电解质(质子相)-空气(气相)三相界面上(TPB-OH),在这个过程中,经电催化进一步还原成活化氧离子(O2-);质子从电解质中传导到表面,并在TPB-OH上发生反应生成H2O,通过孔隙扩散到环境气氛中去。在整个过程中,氧离子不会在阴极体相传导,同样,质子只能传输到电解质表面。由于传导的限制,氧离子和质子接触的机会减少,反应效率低,即极化电阻高。
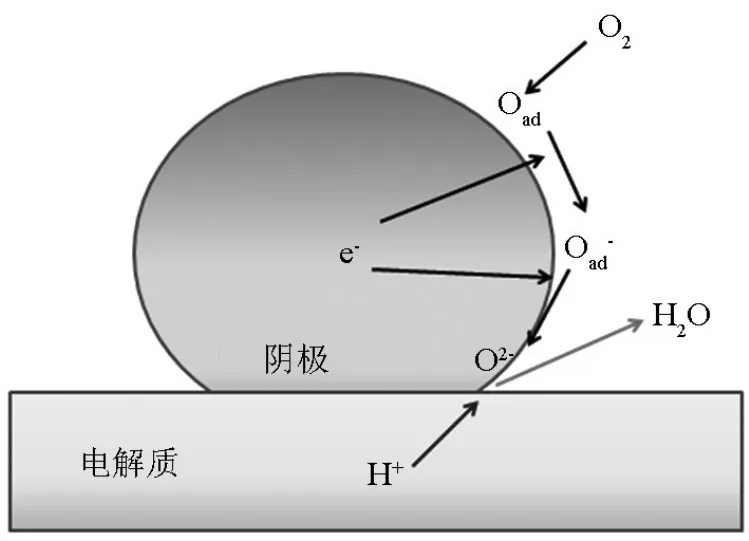
图2 H-SOFC中电子导体单相阴极反应示意图Fig.2 Possible reaction at the cathode electrode of HSOFCs using electronic conductor single phase cathode
早期的研究采用贵金属Pt作为H-SOFC的阴极。Pt是一种优秀的电子导体,但是其氧离子电导率和质子电导率均非常小,可忽略。虽然说Pt有很好的催化裂解氧的能力,但是依然在质子导体电解质BaCe0.8Gd0.2O2.9上显现出过高的界面阻抗(800℃为0.61 Ω·cm2);此外,采用贵金属作电极会加大成本,这在商业化的道路是不可取的[5]。
3.2 H-SOFC氧离子电子混合导体单相阴极
随着研究的进行,发现氧离子电子混合导体是适合的阴极材料。如图3所示,当氧离子电子混合导体作为单相阴极时,在表面形成的氧离子(O2-)可以经过阴极体相传导,到达电解质表面,与质子进行反应。这样,增大了氧离子和质子接触的机会。这种阴极材料需要有较高的电子电导率和氧离子电导率。氧离子电子混合导体的两个基本参数决定了此类阴极的性能,它们分别是氧表面交换系数(k)和氧扩散系数(D*),它们是选择H-SOFC阴极材料的重要依据[6]。目前,测量k和D*可用的方法是同位素示踪法O16/O18。实验时将样品置于富含O18的气氛中退火,一定时间后将样品淬火,并用二次离子质谱法(SIMS)检测样品中O18的分布,便可得到k和D*值[7]。图4列出了常见的混合导体的氧表面交换系数(k)和氧扩散系数(D*)。一般来说,D*越大,离子电导率越大。
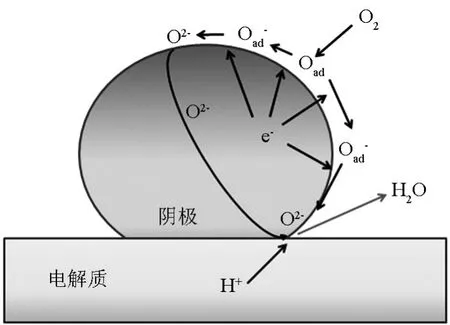
图3 H-SOFC中氧离子电子混合导体单相阴极反应示意图Fig.3 Possible reaction at the cathode electrode of H-SOFCs using mixed electronic/oxygen ion conductor single phase cathode
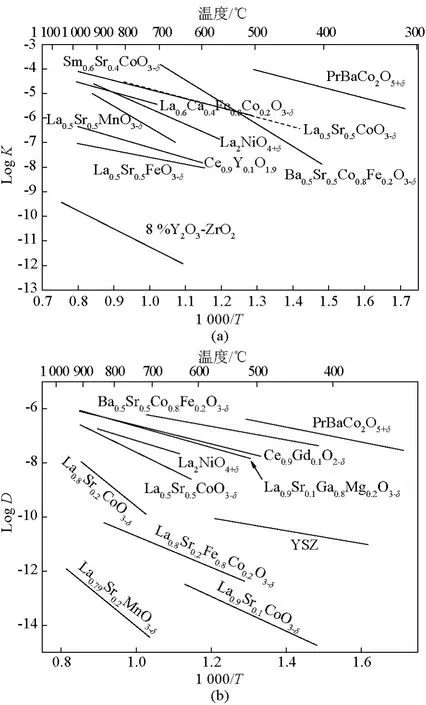
图4 (a)不同材料的氧表面交换系数(k)[6];(b)氧扩散系数(D*)[6]Fig.4 (a)oxygen surface exchange coefficient(k)[6];(b)oxygen diffusion coefficient(D*)[6]of cathode materials
Yamaura等的研究采用 La0.7Sr0.3MO3(M=Mn,Fe,Co)作为质子导体阴极材料,发现在SrCe0.95Yb0.05O3电解质上,La0.7Sr0.3FeO3的过电势最小[8]。单从氧离子电导率判断,La0.7Sr0.3MnO3、La0.7Sr0.3FeO3、La0.7Sr0.3CoO3的氧离子电导率依次增大,氧离子电导率的增加,能够增加质子与氧离子的接触概率,从而加快反应的进行,电极过电势也应逐渐减小。然而La0.7Sr0.3CoO3的热膨胀系数远高于电解质材料,约为23×10-6/K,易造成电极剥落的现象。其实在O-SOFC中,不少研究通过浸渍调控微结构来改善钴基阴极的热匹配问题[9],并取得不错的结果,这都是值得H-SOFC借鉴的地方。而且Yamaura等还发现La0.7Sr0.3CoO3、La0.6Sr0.4Co0.2Fe0.8O3等含Co氧化物易与电解质反应,形成第二相,而La0.7Sr0.3FeO3在1 000℃以下都不会和SrCe0.95Yb0.05O3电解质发生反应[8]。
在简单的钙钛矿氧化物中,Ba0.5Sr0.5Co0.8Fe0.2O3具有较高的k和D*,是一种快氧离子导体[10]。但是Lin等在研究中发现[11],在1 100℃以下的时候,Ba0.5Sr0.5Co0.8Fe0.2O3(BSCF)和 BaCe0.9Y0.1O2.95(BCY)不会发生相反应,它们之间会发生Ba元素的扩散,电解质BCY中的Ba易扩散到阴极材料BSCF中。虽然Ba的扩散不会对氧还原反应造成影响,但是会阻碍质子的传输,影响质子和氧离子接触的机会。尽管如此,整个单电池的极化阻抗依然很小,在500℃时为0.36 Ω·cm2。为了提高材料的稳定性,Lin等对材料进行了改变,并发现Ba0.6Sr0.4Co0.9Nb0.1O3(BSCN)[12]是一种较好的材料,其单电池(BZCY电解质)界面阻抗在700℃时仅达0.06 Ω·cm2。在寻找合适的阴极途中,Lin等接着研究了BaCo0.7Fe0.2Nb0.1O3(BCFN)[13]的电化学行为,其单电池(BZCY电解质)界面阻抗在700℃下测试为0.10 Ω·cm2,也体现了不错的电化学性能。另外,不含Co的氧化物Ba0.5Sr0.5Zn0.2Fe0.8O3(700 ℃,0.08 Ω·cm2)[14]也被尝试用来作为H-SOFC的阴极材料。这种掺杂取代的目的在于提高材料的化学稳定性和缓解热匹配的问题。
由于具有较高的k和D*,H-SOFC阴极研究越来越多地集中到层状钙钛矿材料LnBaCo2O5+δ(Ln=La,Pr,Nd,Sm,Eu,Gd,Y)上。这类结构可以看作是LnOδ∣CoO2∣BaO∣CoO2序列的循环,Ln3+和Ba2+有序交替地占据钙钛矿的A位,氧空位存在于LnOδ层中(δ<1),如图5所示。这种Ln3+和Ba2+的有序交替结构,从理论上可以提高氧扩散速率达几个数量级[15]。Zhang等[16]系统研究了不同稀土元素的 LnBaCo2O5+δ化合物,发现 PrBaCo2O5+δ具有最高的k和D*。从图4可以看出,相对于其他类混合导体,PrBaCo2O5+δ的k和D*是最大的。层状钙钛矿结构的氧化物作为H-SOFC的阴极材料的文献很多,可惜大多数未进行深入细致的工作。单独研究H-SOFC中阴极过电势,界面阻抗的实验较少,大多的工作集中在单电池最高输出功率和整个单电池的极化阻抗方面。
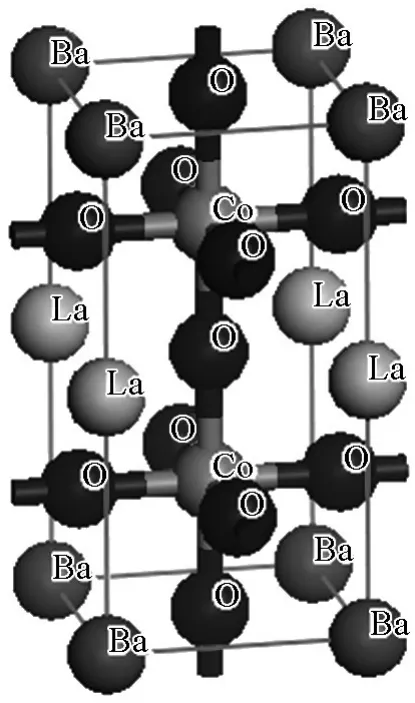
图5 层状钙钛矿氧化物的结构示意图Fig.5 Schematic diagram of layered perovskite oxides
Lin 等 的工 作 首 次 将 GdBaCo2O5+δ[17]和 SmBa-Co2O5+δ[18]应用到BaCe0.7Zr0.1Y0.2O3(BZCY)质子导体电解质,700℃时,电池的界面阻抗分别为0.16 Ω·cm2和0.15 Ω·cm2,随后Zhao等采用PrBaCo2O5+δ[19]作为BZCY的阴极,电池的界面阻抗为0.15 Ω·cm2(700℃),考虑到电池的阻抗包括阳极-电解质界面和阴极-电解质界面,同时由于电极微结构不一样,所以并不好得出PrBaCo2O5+δ,GdBaCo2O5+δ和SmBa-Co2O5+δ之间性能的差别。
与简单钙钛矿的钴酸盐类似,LnBaCo2O5+δ也存在以下两个问题,即化学稳定性和热膨胀匹配。Lin等[20]的研究发现,PrBaCo2O5+δ和BZCY共烧1 000℃,两者之间会发生阳离子相互扩散的现象。Co扩散到BZCY电解质中,会一定程度上降低电解质的电导率。Nian等[21]报道了SmBaCo2O5+δ的热膨胀系数为21.2×10-6/K,与BaCe0.8Sm0.2O3(BCS)电解质的热膨胀系数10.3×10-6/K相差较大。在B位进行Cu或Fe的掺杂,能降低材料的热膨胀系数。SmBaCuCoO5+δ和SmBaCuFeO5+δ的热膨胀系数分别为15.5×10-6/K和14.4×10-6/K,在BCS基电解质上,单电池的界面阻抗分别为0.14 Ω·cm2和0.20 Ω·cm2(700℃)。Ling等[22]也相继报道了 LaBaCuCoO5+δ和 LaBaCuFeO5+δ的单电池性能,BZCY电解质的单电池界面阻抗在700 ℃时分别为0.15 Ω·cm2和0.27 Ω·cm2。
考虑到BaO的蒸气压低,容易扩散,造成材料的化学稳定性不是很好,另一个对层状钙钛矿材料进行改进的方向就是用部分的Sr元素取代Ba元素LnBa0.5Sr0.5Co2O5+δ,同时又不会破坏其层状钙钛矿的结构。Ding 等研究的 PrBa0.5Sr0.5Co2O5+δ[23]作为H-SOFC的阴极,其单电池(BZCY电解质)界面阻抗在700 ℃时测试为0.12 Ω·cm2。此外,Ding等还 研 究 了 SmBa0.5Sr0.5Co2O5+δ[24],其 阴 极 性 能 和PrBa0.5Sr0.5Co2O5+δ在同一水平。
除了钙钛矿结构,一些其他结构氧化物都可用作H-SOFC的阴极材料。YBaCo4-xMxO7系列化合物属于六方晶系。具有和电解质较匹配的热膨胀系数[25],小于14×10-6/K,Wang等[26]将其用作BZCY的阴极,其单电池界面阻抗在700℃时测试为0.16 Ω·cm2。
3.3 H-SOFC质子电子混合导体单相阴极
在氧离子电子混合导体阴极中,氧离子从阴极表面传输到阴极-电解质界面,与质子反应。而在质子电子混合导体中,质子从阴极-电解质界面传输到阴极表面,再和氧离子进行反应,产生H2O。因此在这种电极中,质子和氧离子发生反应的区域可以扩展到整个气体/阴极界面,其传导方式如图6所示。这种H-SOFC阴极材料需要有高的电子电导率和质子电导率,同时具有质子和电子传导性能,并且具有氧催化活性的材料,目前报道的并不是很多。这类材料的选择通常是对BaCeO3或者BaZrO3进行B位的掺杂获得,同时兼顾质子电导率和电子电导率。
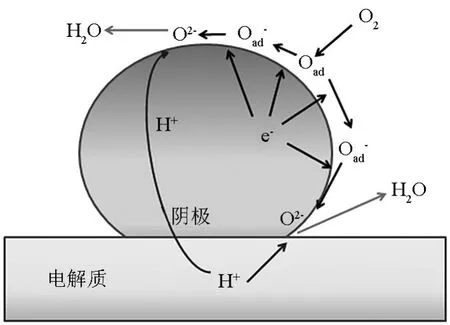
图6 H-SOFC中质子电子混合导体单相阴极反应示意图Fig.6 Possible reaction at the cathode electrode of H-SOFCs using mixed electronic/proton conductor single phase cathode
Fabbri等[27]研究了掺杂BaCeO3材料的电子电导,发现BaCe0.9Yb0.1O3(BCYb)在干燥的高氧分压的气氛下是质子和电子混合导体。但是在阴极的工作环境下,即有H2O存在时,电子电导会显著下降,导致整个阴极的界面阻抗非常大。Mukundan等[28]研究了BaCe0.8−yPryGd0.2O3体系,也发现相同的现象,材料在有H2O存在时,电子电导非常小。其中,Ba(Pr0.8Gd0.2)O3[29]材料的电子电导较高,并且具有较高的质子电导,在800℃约有3×10-2S/cm,但是在Ba(Ce0.8Gd0.2)O3电解质的单电池中,界面阻抗为0.34 Ω·cm2(800℃),相对较大,可能是其氧催化能力较低造成的。相比之下,BaCe0.5Bi0.5O3的质子电导率非常低,在800℃约为8×10-7S/cm[30],但在700℃时,其BZCY单电池界面阻抗降低到0.28 Ω·cm2[31]。因此在选择阴极材料的时候,要多方面考虑。Tao等[32]将BaCe0.5Fe0.5O3应用为BZCY的阴极,单电池界面阻抗在700℃时为0.17 Ω·cm2,相对较小,作为质子电子混合导体阴极,BaCe0.5Fe0.5O3是个不错的选择,但是它的质子电导率有待研究。对BaCeO3或者BaZrO3进行Co和Fe的掺杂,能提高材料的氧催化能力和电子电导的大小,但是掺杂浓度易受到限制,具体的工作有待进一步深入。
3.4 H-SOFC质子导体电子导体复合阴极
质子电子混合导体单相材料能够将质子和氧离子发生反应的区域从阴极-电解质界面扩展到阴极表面。但是这种材料的选择性比较窄,符合条件的阴极材料并不多。可以采用复合的方法解决此问题,即在具有催化性能的阴极材料(阴极催化剂)中加入质子导体相。通过两相混合的方法,使得整个阴极同时具有质子导电性、电子导电性和催化能力。图7表示了其可能进行的反应步骤,可见,采用复合阴极的方法可以将质子和氧离子的反应区域扩展到整个阴极中。另外,由于在催化剂中加入了质子电导相(一般为电解质材料),整个阴极和电解质的热匹配问题能够得到缓解,这是复合阴极的优势。
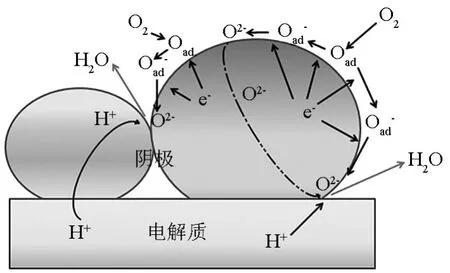
图7 H-SOFC中质子导体电子导体复合阴极反应示意图Fig.7 Possible reaction at the cathode electrode of H-SOFCs using mixed electronic/proton conductor composite cathode
质子导体电子导体复合阴极已经在H-SOFC中得到了广泛的应用。其中,Fabbri等[33]的工作发现,当La0.6Sr0.4Fe0.8Co0.2O3(LSCF)和BaCe0.9Yb0.1O3(BCYb)按质量比为1∶1混合的时候,其对称电池中的电极界面阻抗(ASR)在700℃时为0.14 Ω·cm2。Wu等[34]对此类复合材料进行了细致的研究工作。研究了不同比例混合,不同烧结温度的Sm0.5Sr0.5CoO3(SSC)-BaCe0.8Sm0.2O3(BCS)复合阴极,并且比较了浸渍法和混磨法的区别。发现浸渍SSC的含量为55%(质量分数),阴极制备温度为1 050℃,其ASR最小,在700 ℃时测试为0.17 Ω·cm2,远小于混合法制备的SSC-BCS阴极ASR(在700℃时测试为1.98 Ω·cm2)。Wu等认为当浸渍量太低时,氧吸附解离过程受阻;当浸渍量太高时,孔隙率较低,有碍于气体传输。并且认为阻抗谱的低频段对应氧的解离吸附过程,即氧的解离吸附过程是整个电极反应的速控步骤。
更多的研究把目光投向于单电池性能上。如质量比为3∶2的Ba0.5Sr0.5Co0.8Fe0.2O3-BaZr0.1Ce0.7Y0.2O3[35],质量比3∶2的Ba0.5Sr0.5Zn0.2Fe0.8O3和BaCe0.5Zr0.3Y0.16Zn0.04O3[36],质量比为3∶2 的Sm0.5Sr0.5CoO3和BaZr0.1Ce0.7Y0.2O3等[37]都是良好的阴极材料。其中SSC和BZCY混合的阴极的单电池输出功率最大。Yang等认为可能是形成BaCoO3的缘故,BaCoO3的存在有利于氧还原过程。Yang等[38]还尝试采用Co掺杂BZCY做阴极材料,当掺杂量超过10%的时候,就会形成第二相BaCoO3。其中20%Co掺杂BZCY,依靠BaCoO3的存在,在700℃测试单电池阻抗为0.16 Ω·cm2,电池最大输出功率为370 mW/cm2。在阴极的制备过程中,一些含Co的阴极容易和BaCeO3系列质子导体电解质发生反应,但是形成的杂相并不一定是有害的,甚至可以有利于整个阴极反应的过程。一些层状钙钛矿氧化物也有用于复合阴极的,如PrBa0.5Sr0.5Co2O5+δ和BZCY[39]组成的复合阴极。值得注意的是,一些O-SOFC阴极制备技术也逐渐的应用于H-SOFC中,如浸渍法制备阴极[40,41],有下面几个特点:a.可以降低阴极的制备温度,防止反应的发生;b.纳米结构的阴极往往具备高的催化活性;c.阴极的微结构能够保持长期的稳定性。Zhao等[42]成功将SSC浸渍的BZCY用作H-SOFC的阴极材料,在700℃测试时,将整个电池的阻抗降低到0.064Ω·cm2。
3.5 H-SOFC氧离子导体电子导体复合阴极
在质子导体电子导体复合阴极中,电解质表面
的质子通过质子导体传导到反应界面。如图8所示,在氧离子导体电子导体复合阴极中,催化剂表面形成的氧离子通过氧离子导体传导到电解质表面,与质子进行反应。一般采用的氧离子导体是掺杂的CeO2(DCO),从稳定性上考虑,采用DCO有一个很大的优势就是,DCO在水蒸气和酸性气氛下的稳定性要好于掺杂的BaCeO3体系。Sun等率先将SSC-Ce0.8Sm0.2O2(SDC)用于H-SOFC中[43],在BZCY电解质上,单电池的阻抗在700℃测试时仅有0.066 Ω·cm2。但是,在长期性能测试中,笔者只给出了25 h的稳定测试时间,这在H-SOFC的实际应用中是远远不够的。随后采用了不含Co的阴极材料 Ba0.5Sr0.5FeO3-SDC[44]和 La0.7Sr0.3FeO3-SDC[45],虽然在电化学性能上有所降低,但是阴极材料的稳定性得到了提高。相似的研究体现在Ling等报道的Sm0.5Sr0.5Fe0.8Cu0.2O3-SDC[46]中。值得注意的是,此类阴极拥有可比拟甚至超过质子导体电子导体复合阴极的电化学性能,但是一些深入的电化学过程和机理在文献中的报道还比较少,有待进一步的探索。
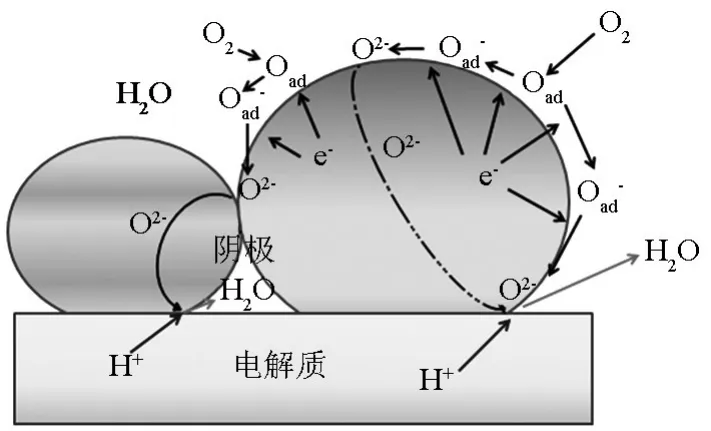
图8 H-SOFC中氧离子导体电子导体复合阴极反应示意图Fig.8 Possible reaction at the cathode electrode of H-SOFCs using mixed electronic/oxygen ion conductor composite cathode
4 H-SOFC阴极反应模型
4.1 H-SOFC阴极反应中的基元反应
根据H-SOFC的工作原理可知,阴极部分的反应较阳极部分要复杂得多,从而带来的极化损失占据主导的地位,然而,人们对于H-SOFC中的阴极及其反应机理还缺乏相应的研究,主要沿袭O-SOFC的相关理论。
对O-SOFC来说,阴极发生的氧还原反应的总反应式如下所示
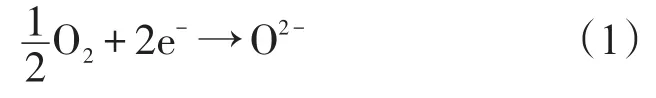
O-SOFC的阴极反应由多个连续的基元步骤组成,已有很多研究提出过步骤模型,一个被广泛采用的步骤模型如下[47]

Step 1:氧分子吸附到阴极表面,并解离成自由氧原子;Step 2:自由氧原子由于电催化还原作用而部分地还原成活化氧离子;Step 3:部分还原的氧离子从阴极表面扩散至三相界面上;Step 4:部分还原的氧离子得电子完全还原;Step 5:氧离子从三相界面扩散到电解质的过程。
对H-SOFC来说,阴极发生的氧还原反应的总反应式如下所示
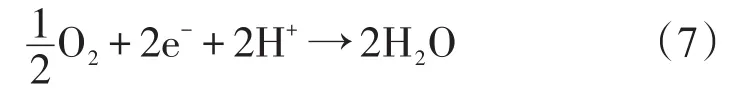
He等[48]和Uchida等[49]分别提出了H-SOFC阴极反应过程,与O-SOFC类似,氧气在阴极上吸附解离还原,并且通过表面或者体相运输到反应区;与O-SOFC不同的是,之前形成的氧离子是同从电解质传输过来的质子进行反应。对于不同类型的阴极,它们之间只是传导方式和反应区域不同,在之前的阴极反应基础上,总的H-SOFC阴极反应可以划分为可能进行的多个连续的基元步骤。
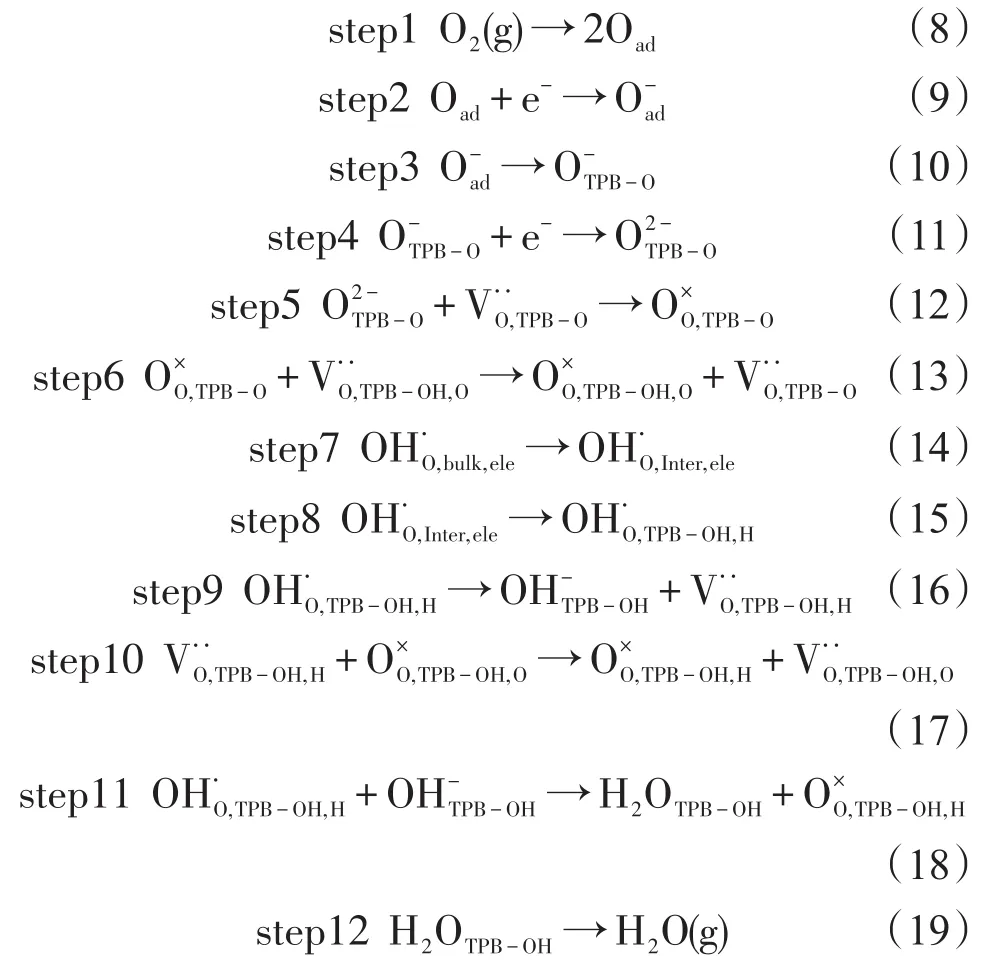
其中TPB-O代表的是氧离子导体、电子导体和气相的三相界面;TPB-OH代表的是氧离子导体、质子导体和气相的三相界面;TPB-OH,O代表的是三相中的氧离子导电相;TPB-OH,H代表的是三相中的质子导电相。整个反应历程可以简单地概括为:氧气在电子导体催化剂中解离吸附还原形成氧离子并且进入晶格表面(step1~5);晶格中的氧移动到反应位(step 6)(当氧离子导体存在阴极中);与此同时质子从电解质体内向电解质和阴极界面传输(step 7);质子传输到反应位(step 8)(当质子导体存在阴极中);晶格中的氧和晶格中的质子产生水的过程(step 9~12)。
在前面的介绍中,根据阴极材料中的不同传导机理,把H-SOFC阴极大体分为以下5种(见表1),它们之间的反应步骤也略有不同。如表1所示,对于纯电子导体的阴极来说,由于阴极不能传导氧离子和质子,所以反应历程中没有氧离子传导和质子传导的步骤(step 6,8);同样地,对于氧离子电子混合导体单相或者复合阴极来说,反应历程没有质子从界面传输到反应位的步骤(step 8);对于质子电子混合导体单相或者复合阴极来说,反应历程氧离子传输的步骤占据的比例非常小(step 6)。值得注意的是,作为传输步骤的基元反应的减少并不意味着反应会由此加快,往往缺少某一个或者某两个传输步骤意味着参与反应的质子或者氧离子接触的机会由此减少,从而影响了整个反应的进行。
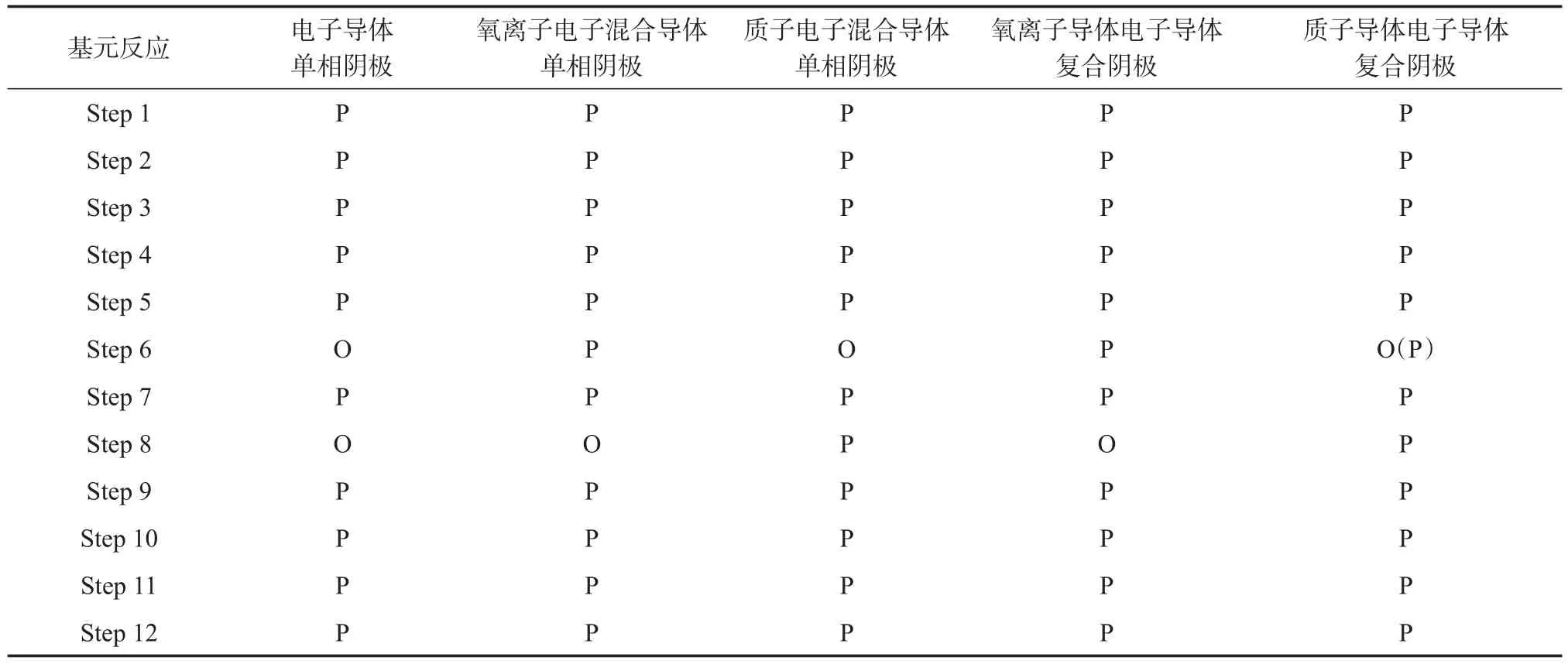
表1 H-SOFC不同阴极的基元反应Table 1 Possible elementary reaction steps in H-SOFC using different cathodes
4.2 H-SOFC阴极反应中的速控步骤
质子导体电子导体复合阴极和氧离子导体电子导体复合阴极具有良好的电化学性能,普遍应用于H-SOFC的材料体系中。从表1中可以看出,由于传导离子的不同,它们之间的基元反应也有所不同,如图9所示。在这些基元反应之中,有反应速率快的,有反应速率慢的。而整个反应的快慢一般由慢反应控制,称这些慢反应步骤为整个反应的速控步骤。深入地了解和认识H-SOFC阴极的电化学反应,有助于减少H-SOFC中阴极的界面极化损失,为选择高性能的阴极材料提供参考价值。He等[48]和Zhao等[50]分别采用电化学交流阻抗法来研究SSCBCS(一种典型的电子导体质子导体复合阴极)和SSC-SDC(一种典型的电子导体氧离子导体复合阴极)的反应步骤,通过改变氧分压、水分压和温度来反映出基元反应中存在的速控步骤。

图9 SSC-BCS和SSC-SDC在H-SOFC中阴极反应简略图Fig.9 The schematic diagrams showning the different athode reaction models of SSC-BCS and SSC-SDC
对于SSC-BCS,阴极的界面阻抗由一个高频弧和一个低频弧组成,与水分压氧分压可以表示为
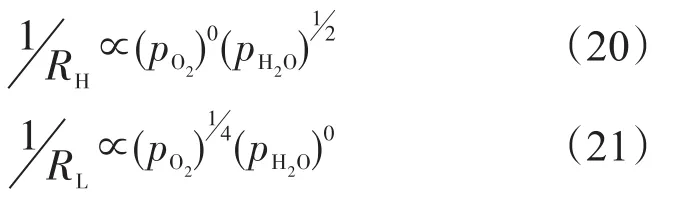
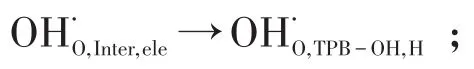
对于SSC-SDC,阴极的界面阻抗也由一个高频弧和一个低频弧组成,与水分压氧分压可以表示为

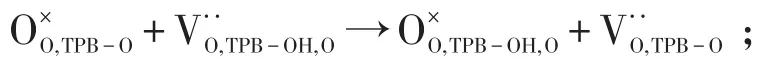
对比电子导体氧离子导体混合阴极SSC-SDC和电子导体质子导体混合阴极SSC-BCS的电极反应。如图9所示,SSC-BCS的氧离子和质子的反应不仅发生在表面还会发生在阴极内部;而SSC-SDC氧离子和质子的反应只能发生在电解质界面。但是,实验结果表明,无论对SSC-SDC还是SSC-BCS来说氧离子和质子的反应都是快反应,不是整个反应的速控步骤,也就是说界面的反应位对电极反应的影响并不大。为了进一步比较SSC-BCS和SSCSDC的电化学行为,不同电流密度下阴极的极化过电势可以推算出来。
对SSC-BCS来说,step 3和step 8是速控步骤,总电流可以表示为
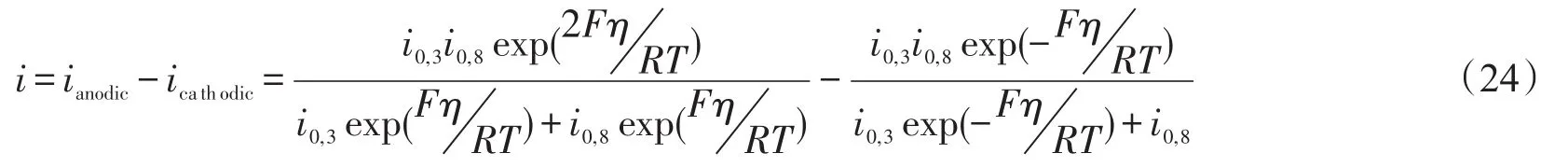
对SSC-SDC来说,step 3和step 6是速控步骤, 总电流可以表示为
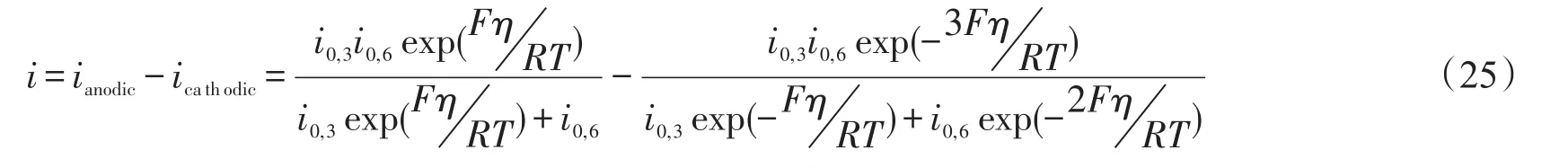
根据前面推导出的式(24)和式(25)来分别模拟SSC-BCS和SSC-SDC三电极的测试结果,如图10所示。对SSC-SDC阴极,拟合出来的交换电流密度:i0,3和 i0,6分别是0.011 A/cm2和 0.028 A/cm2;对SSC-BCS阴极,拟合的交换电流密度:i0,3和i0,8分别是0.011 A/cm2和0.054 A/cm2。当电池在开路状态下,如 η→0,Rtot=η i,SSC-SDC和SSC-BCS的阻抗大小差别不是很明显。然而较高的过电势下,如 η =0.2 V,iSSC+SDC和iSSC+BCS分别是0.155 A/cm2和0.039 A/cm2,由此可知SSC-BCS在大过电势或者大电流情况下具有更大的阻抗,从而推断出SSC-SDC在H-SOFCs实际应用中可能更具潜力。
5 结语
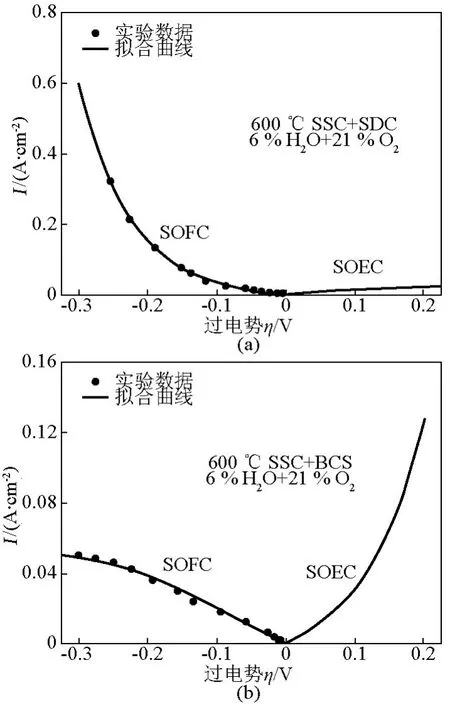
图10 SSC-SDC和SSC-BCS中的电流-过电势的测试及拟合图Fig.10 Experimental data and fitting polarization curves for SSC-SDC and SSC-BCS
[1]毛宗强.关注氢能源——21世纪最具发展潜力的能源[J].科技中国,2004(11):28-33.
[2]衣宝廉.电子书燃料电池——原理、技术与应用[M].北京:化学工业出版社,2003.
[3]Kreuer K D.Proton-conducting oxides[J].Annual review of materials research,2003,33:333-359.
[4]Patil A S,Dubois T G,Sifer N,et al.Portable fuel cell systems for America’s army:Technology transition to the field[J].Journal of Power Sources,2004,136:220-225.
[5]Mukundan R,Davies P K,Worrell W L.Electrochemical characterization of mixed conducting Ba(Ce0.8–yPryGd0.2)O2.9cathodes[J].Journal of the Electrochemical Society,2001,148:A82-A86.
[6]蒋治亿.中温固体氧化物燃料电池的阴极材料和阴极过程[D].合肥:中国科学技术大学,2011.
[7]Carter S,Selcuk A,Chater R J,et al.Oxygen-transport in selected nonstoichiometric perovskite-structure oxides[J].Solid State Ionics,1992,53(6):597-605.
[8]Yamaura H,Ikuta T,Yahiro H,et al.Cathodic polarization of strontium-doped lanthanum ferrite in proton-conducting solid oxide fuel cell[J].Solid State Ionics,2005,176:269-274.
[9]Zhao F,Peng R R,Xia C R.A La0.6Sr0.4CoO3-δ-based electrode wit high durability for intermediate temperature solid oxide fuel cells[J].Materials Research Bulletin,2008,43:370-376.
[10]Shao Z P,Haile S M.A high-performance cathode for the next generationofsolid-oxidefuelcells[J].Nature,2004,431:170-173.
[11]Lin Y,Ran R,Zheng Y,et al.Evaluation of Ba0.5Sr0.5Co0.8Fe0.2O3−δas a potential cathode for an anode-supported proton-conducting solid-oxide fuel cell Original Research Article[J].Journal of Power Sources,2008,180:15-22.
[12]Lin Y,Ran R,Chen D J,et al.A novel Ba0.6Sr0.4Co0.9Nb0.1O3−δcathode for protonic solid-oxide fuel cells[J].Journal of Power Sources,2010,195:4700-4703.
[13]Lin Y,Zhou W,Sunarso J,et al.Characterization and evaluation of BaCo0.7Fe0.2Nb0.1O3−δ,as a cathode for proton-conducting solid oxide fuel cells[J].International Journal of Hydrogen Energy,2012,37:484-497.
[14]Ding H P,Lin B,Liu X Q,et al.High performance protonic ceramicmembranefuelcells(PCMFCs)withBa0.5Sr0.5Zn0.2Fe0.8O3−δperovskite cathode[J].Electrochemistry Communications,2008,10:1388-1391.
[15]Taskin A A,Lavrov A N,Ando Y.Achieving fast oxygen diffusion in perovskites by cation ordering[J].Applied Physics Letters,2005,86:091910-3.
[16]Zhang K,Ge L,Ran R,et al.Synthesis,characterization and evaluation of cation-ordered LnBaCo2O5+das materials of oxygen permeation membranes and cathodes of SOFCs[J].Acta Materialia,2008,56:4876-4889.
[17]Lin B,Zhang S Q,Zhang L C,et al.Prontonic ceramic membrane fuel cells with layered GdBaCo2O5+xcathode prepared by gel-casting and suspension spray[J].Journal of Power Sources,2008,177:330-333.
[18]Lin B,Dong Y C,Yan R Q,et al.In situ screen-printed BaZr0.1Ce0.7Y0.2O3−δelectrolyte-based protonic ceramic membrane fuel cells with layered SmBaCo2O5+xcathode[J].Journal of Power Sources,2009,186:446-449.
[19]Zhao L,He B B,Lin B,et al.High performance of proton-conducting solid oxide fuel cell with a layered PrBaCo2O5+δcathode[J].Journal of Power Sources,2009,194:835-837.
[20]Lin Y,Ran R,Zhang C,et al.2010,Performance of PrBa-Co2O5+δas a proton-conducting solid-oxide fuel cell cathode[J].Journal of Physical Chemistry A,114,3764-3772.
[21]Nian Q,Zhao L,He B B,et al.Layered SmBaCuCoO5+δand SmBaCuFeO5+δperovskite oxides as cathode materials for proton-conductingSOFCs[J].JournalofAlloysandCompounds,2010,492:291-294.
[22]Ling Y H,Zhao L,Lin B,et al.Layered perovskite LaBaCu-MO5+x(M=Fe,Co)cathodes for intermediate-temperature protonic ceramic membrane fuel cells[J].Journal of Alloys and Compounds,2010,493,252-255.
[23]Ding H P,Xue X J.Proton conducting solid oxide fuel cells with layered PrBa0.5Sr0.5Co2O5+δperovskite cathode[J].International Journal of Hydrogen Energy,2010,35:2486-2490.
[24]Ding H P,Xue X J,Liu X Q,et al.A novel layered perovskite cathode for proton conducting solid oxide fuel cells[J].Journal of Power Sources,2010,195:3775-3778.
[25]Kim J H,Manthiram A.Low thermal expansion RBa(Co,M)4O7cathode materials based on tetrahedral-site cobalt ions for solid oxide fuel cells[J].Chem.Mater,2010,22:822-831.
[26]Wang H,Tao Z T,Liu W.Electrochemical characterization of YBaCo3ZnO7+δas a stable proton-conducting SOFCs cathode[J].Ceramics International,2012,38:1737-1740.
[27]Fabbri E,Oh T,Licoccia S,et al.Mixed protonic/electronic conductor cathodes for intermediate temperature SOFCs based on proton conducting electrolytes[J].Journal of the Electrochemical Society,2009,156:B38-B45.
[28]Mukundan R,Davies P K,Worrel W L.Electrochemical characterization of mixed conducting Ba(Ce0.8–yPryGd0.2)O2.9cathodes[J].JournaloftheElectrochemicalSociety,2001,148:A82-A86.
[29]Mukundan R,Davies P K,Worrell W L.Electrochemical characterization of mixed conducting Ba(Ce0.8-yPryGd0.2)O2.9cathodes[J].Journal of the electrochemical society,2001,148:A82-A86.
[30]Hui Z,Michele P.Preparation,chemical stability,and electrical properties of Ba(Ce1–xBix)O3(x=0.0~0.5)[J].Journal of Materials Chemistry,2002,12:3787-3791.
[31]Tao Z T,Bi L,Yan L T,et al.A novel single phase cathode material for a proton-conducting SOFC[J].Electrochemistry Communications,2009,11:688-690.
[32]Tao Z T,Bi L,Zhu Z W,et al.Novel cobalt-free cathode materials BaCexFe1−xO3−δfor proton-conducting solid oxide fuel cells[J].Journal of Power Sources,2009,194:801-804.
[33]Fabbri E,Licoccia S,Traversa E,et al.Composite cathodes forprotonconductingelectrolytes[J].FuelCells,2009,9:128-138.
[34]Wu T,Peng R,Xia C.Sm0.5Sr0.5CoO3−δ-BaCe0.8Sm0.2O3-δcomposite cathodes for proton-conducting solid oxide fuel cells[J].Solid State Ionics,2008,179:1505-1508.
[35]Lin B,Ding H,Dong Y,et al.Intermediate-to-low temperature protonic ceramic membrane fuel cells with Ba0.5Sr0.5Co0.8Fe0.2O3-δ-BaZr0.1Ce0.7Y0.2O3-δcomposite cathode[J].Journal of Power Sources,2009,186:58-61.
[36]LuX,DingY,ChenY.Ba0.5Sr0.5Zn0.2Fe0.8O3−δ-BaCe0.5Zr0.3Y0.16Zn0.04O3−δcomposite cathode for proton-conducting solid oxide fuel cells[J].JournalofAlloysandCompounds,2009,484,856-859.
[37]Yang L,Zuo C,Wang S,et al.A novel composite cathode for low-temperature SOFCs based on oxide proton conductors[J].Advanced Materials,2008,20:3280-3283.
[38]Yang L,Wang S Z,Lou X Y,et al.Electrical conductivity and electrochemical performance of cobalt-doped BaZr0.1Ce0.7Y0.2O3cathode[J].International Journal of Hydrogen Energy,2011,36:2266-2270.
[39]Zhao F,Wang S W,Brinkman K,et al.Layered perovskite PrBa0.5Sr0.5Co2O5as high performance cathode for solid oxide fuel cells using oxide proton-conducting electrolyte[J].Journal of Power Sources,2010,195:5468-5473.
[40]Jiang S P.A review of wet impregnation—An alternative method for the fabrication of high performance and nano-structured electrodes of solid oxide fuel cell[J].Materials Science and Engineering,2006,418:A199-A210.
[41]Sholklapper T Z,Kurokawa H,Jacobson C P,et al.Nanostructured solid oxide fuel cell electrodes[J].Nano letters,2007(7):2136-2141.
[42]Zhao F,Liu Q,Wang S W,et al.Infiltrated multiscale porous cathode for proton-conducting solid oxide fuel cells[J].Journal of Power Sources,2011,196:8544-8548.
[43]Sun W P,Yan L T,Lin B,et al.High performance protonconducting solid oxide fuel cells with a stable Sm0.5Sr0.5Co3-Ce0.8Sm0.2O2composite cathode[J].Journal of Power Sources,2010,195:3155-3158.
[44]Sun W P,Shi Z,Fang S M,et al.A high performance BaZr0.1Ce0.7Y0.2O3-based solid oxide fuel cell with a cobalt-free Ba0.5Sr0.5FeO3-Ce0.8Sm0.2O2composite cathode[J].International Journal of Hydrogen Energy,2010,35:7925-7929.
[45]Sun W P,Zhu Z W,Jiang Y Z,et al.Optimization of BaZr0.1Ce0.7Y0.2O3based proton-conducting solid oxide fuel cells with a cobalt-free proton-blocking La0.7Sr0.3FeO3-Ce0.8Sm0.2O2composite cathode[J].International Journal of Hydrogen Energy,2011,36:9956-9966.
[46]Ling Y H,Yu J,Lin B,et al.Acobalt-free Sm0.5Sr0.5Fe0.8Cu0.2O3−δ-Ce0.8Sm0.2O2−δcompositecathodeforproton-conductingsolidoxide fuel cells[J].Journal of Power Sources,2011,196:2631-2634.
[47]Kim J D,Kim G D,Moon J W,et al.Characterization of LSMYSZ composite electrode by ac impedance spectroscopy[J].Solid State Ionics,2001,143:379-389.
[48]He F,Wu T Z,Peng R R,et al.Cathode reaction models and performance analysis of Sm0.5Sr0.5CoO3-BaCe0.8Sm0.2O3composite cathode for solid oxide fuel cells with proton conducting electrolyte[J].Journal of Power Sources,2009,194:263-268.
[49]Uchida H,Tanaka S,Iwahara H.Polarization at Pt electrodes of a fuel cell with a high temperature-type proton conductive solid electrolyte[J].J.Appl.Electrochem,1995,15:93-97.
[50]Zhao L,He B B,Gu J Q,et al.Reaction model for cathodes cooperated with oxygen-ion conductors for solid oxide fuel cells using proton conducting electrolytes[J].International Journal of Hydrogen Energy,2012,37:548-554.
The development review of cathode materials for proton conducting solid oxide fuel cells
Zhao Ling,Xia Changrong
(CAS Key Laboratory of Materials for Energy Conversion,Department of Materials Science and Engineering,University of Science and Technology of China,Hefei 230026,China)
Energy crisis and environmental pollutions are the problems which the whole world is now facing for the sustainable development.Solid oxide fuel cells(SOFCs),which have been regarded as keystone for the future energy economy,have
considerable attention for their high energy conversion efficiency and low impact to environment as a mean of generating electricity.Proton conducting solid oxide fuel cells(H-SOFCs)have attracted much attention for their unique characters,such as great efficiency in fuel utilization,high electromotive force,high ionic transferring numbers and low activation energies for proton conduction.However,comparedwithoxygen-ionconductingSOFCs(O-SOFCs),thematerialsandtheoriesonH-SOFCarejustinchoate,especially for cathodes of H-SOFC.In H-SOFC,hydrogen is oxidized at the anode to form protons,which migrate through the electrolyte to the cathode,and undergo a half-cell reaction with oxygen to produce water,whichmakesthecathodereactionsmorecomplexcomparedwiththoseofO-SOFC.Suchdistinguishedcharacteristic of cathode reactions calls for intensive consideration on reaction mechanism and might lead to some special demands onthecathodematerials.ThisreviewisfocusedonthehisroryofcathodematerialsforH-SOFC.Theelectrochemicalperformancesandreactionmodelsofdifferentconductionmechanismcathodematerialsaresummarized,providing some useful means and ways for the development and application of cathode materials for H-SOFC.
solid oxide fuel cell;proton conductor;cathode material;reaction model
TM911
A
1009-1742(2013)02-0088-10
2012-11-07
国家重点基础研究发展计划“973计划”资助项目(2012CB215403)
夏长荣(1966—),男,安徽庐江县人,教授,主要研究方向为固体氧化物燃料电池;E-mail:xiacr@ustc.edu.cn

