细胞如何感受外界环境
——2012年度诺贝尔化学奖简述
张德文 周颖琳 张新祥
(北京大学化学与分子工程学院 北京 100871)
当一杯咖啡摆在我们面前,我们能看见它的色泽,嗅到它的香味,尝到它的味道。人体是如何感受到这些外环境的信息的?当我们遇到危险时,触发应急反应,肾上腺髓质释放肾上腺素,促使瞳孔放大,心率加快,心脏收缩力增强,呼吸加快,骨骼肌血流量增加,消化系统血流量减少,肝糖原分解加强,释放游离脂肪酸进入血液,保证了应对紧急情况所需的能量。人体又是如何感受到内环境中的激素的?
考虑生物体的基本组成单位是细胞,以上问题可以归结为,细胞是如何感受外界环境中的信号分子(如光子、气味和激素等)的?细胞被磷脂双分子层的质膜与外界环境隔开,需要通过细胞膜上的感受器(受体)将细胞外的信号分子的信息传递至细胞内。受体的存在、结构和功能困惑了科学家很长时间。细胞感受外界环境中的信号分子的这一过程是如何在分子水平上实现的?哪些分子参与了这一过程?信息是如何传递的?如何区别不同的信号分子?信号的调控过程是怎样的?这一过程的每一步就像是图1所示拼图中的一块,完成它花费了研究者近一个世纪的时间。
一个世纪以前,研究者发现功能性细胞膜表面可以感受外界的信号分子,在细胞内产生功能性反应,从而提出细胞膜表面存在能被配体激活的受体的概念[2-3]。早期的研究集中于组织对配体、竞争性或非竞争性抑制剂的响应以及剂量响应,并建立了经典的受体理论[4]。值得注意的是,此时受体仍然是一个功能性的概念,人们对其结构一无所知。20世纪40年代,美国科学家Raymond Ahlquist发现了两种不同的肾上腺素受体,分别位于平滑肌细胞和心肌细胞上,命名为α和β受体。很快科学家发现了β受体的阻断剂,这一类药物具有显著效果,但其作用机制依然是一团迷雾。20年后,甚至Ahlquist也开始对他的两种不同受体的理论失望,感叹道:“对我来说,它们(受体)只是一种抽象的概念,用来解释组织对不同化合物的功能响应。”
而此时,在受体被探明以前,第二信使学说建立了[5-6]。激素通过细胞内的环腺苷酸(cAMP)发挥作用,激活一些蛋白激酶,导致细胞内效应。若将细胞外的信号称为第一信使,cAMP则被称为第二信使。cAMP通过腺苷酸环化酶催化产生。从此,腺苷酸环化酶活性成为细胞内功能响应的重要指标之一。第二信使学说因为揭示了激素的细胞内作用机制获得1971年诺贝尔生理学或医学奖。
20世纪60年代末,2012年度诺贝尔化学奖获得者之一的Robert J.Lefkowitz进入了受体的研究历史中。他面临的巨大挑战是找到受体。受体发现的技术上的第一次突破出现了,这就是放射性同位素标记配体的化学合成。Lefkowitz第一个成功合成了125I标记的促肾上腺皮质激素,观察到其与肾上腺皮质的结合,并导致腺苷酸环化酶的激活,从而建立了受体的研究方法[7-8]。随后,Lefkowitz在杜克大学建立了自己的实验室和研究小组,致力于肾上腺素能受体的研究。通过放射性同位素标记的肾上腺素,β受体阻断剂及亲和色谱方法,Lefkowitz研究小组分离纯化得到了β-肾上腺素能受体,从而成功找到了受体的结构实体[9-10]。放射性同位素标记配体的方法极大地扩展了受体研究的领域,大量的受体被发现。
几乎同时,在细胞内信号传导途径中起着重要作用的G蛋白被发现了[11-13]。G蛋白即GTP结合蛋白,能够结合GTP或GDP,又叫鸟苷酸结合调节蛋白。由α、β、γ亚基组成,其中α亚基具有GTP酶活性。静息状态下,α、β、γ这3个亚基结合在一起,α亚基上结合GDP,此时G蛋白不具有活性。当G蛋白被激活时,α亚基上结合GTP,且与β、γ亚基分开,具有GTP酶活性的α亚基可激活腺苷酸环化酶,催化产生第二信使cAMP,导致细胞内效应。G蛋白在静息状态和活性状态下转换的过程为G蛋白循环。关于G蛋白的研究获得了1994年诺贝尔生理学或医学奖。
G蛋白将细胞外的第一信使(如肾上腺素及其受体)与细胞内的第二信使(如cAMP)联系在一起。1980年,Lefkowitz及其合作者提出了受体激活机制的三元复合物传感模型[14]。该三元复合物包含了细胞外的信号分子、跨膜的G蛋白偶联受体和细胞内的G蛋白。如图1所示,G蛋白偶联受体作为信号识别元件,识别并结合细胞外的信号分子,其构象发生变化,使受体的细胞内部分能够结合并激活G蛋白,G蛋白被激活后解离为α亚基和β、γ亚基,具有GTP酶活性的α亚基导致细胞内效应,而新的G蛋白与G蛋白偶联受体结合,发生新一轮的上述过程。这一模型将受体和G蛋白从功能上偶联起来,但其三元复合物的结构并没有被观察到,因为G蛋白结合被激活后解离为α亚基和β、γ亚基,从而解开三元复合物结构。三元复合物是一个瞬间的中间态,难以如配体-受体复合物那样被分离检测到,因此在当时仍然只是一幅想象中的图景,这一图像真正的实现是在30年后。

图1 细胞膜表面G蛋白偶联受体感受激素并引发细胞内反应的过程[1](1) 激素在细胞膜外与G蛋白偶联受体结合;(2) G蛋白偶联受体构象改变,在细胞膜内与G蛋白结合,形成三元复合物,并激活G蛋白;(3) G蛋白被激活后解离为α亚基和β、γ亚基,具有GTP酶活性的α亚基导致细胞内效应;(4) 新的G蛋白与G蛋白偶联受体结合。
20世纪80年代,Lefkowitz研究小组开始尝试破解β-肾上腺素能受体的基因编码,如果得到其基因序列,读出β受体的氨基酸序列,就可能得到G蛋白偶联受体的作用机制的线索。这一研究是G蛋白偶联受体获得2012年度诺贝尔化学奖的决定性原因之一。在当时,人类基因组计划尚未开始,想要在人类基因组中找到一个特定的基因序列犹如大海捞针。幸运的是,Lefkowitz招到了一位年轻有为的博士后Brian K.Kobilka,他是2012年的另一位诺贝尔化学奖获得者。Kobilka成功构建了β肾上腺素能受体的基因文库,并将其有效地用于该基因的克隆[15]。该基因没有内含子,因而能直接推得β肾上腺素能受体的氨基酸序列,然后出现了令人惊奇的结果:该受体含有7段疏水螺旋结构,因此可以来回跨膜7次。一种奇妙的巧合出现了。在此之前,视网膜中感受光的受体蛋白视紫红质结构已被研究清楚,视紫红质同样通过G蛋白发挥作用,且具有7次跨膜螺旋结构。虽然激素和光的性质完全不同,但这一巧合是否意味着两种受体的结构是有联系的?“找到了!”Lefkowitz这样描述这一时刻。7次跨膜螺旋和两种受体蛋白跨膜区氨基酸序列的同源性意味着G蛋白偶联受体有着共同的7次跨膜结构,再加上当时已知的30多种与G蛋白偶联的受体,这意味着一个全新的蛋白质家族——G蛋白偶联受体家族的诞生。这一结论进一步被第3种G蛋白偶联受体——乙酰胆碱受体的序列所证实。随着人类基因组计划的完成,G蛋白偶联受体家族基本确立,其中约1/2 属于嗅觉受体,1/3 属于激素受体,还有一些光受体和一些味觉受体,以及超过100种功能未知的受体。
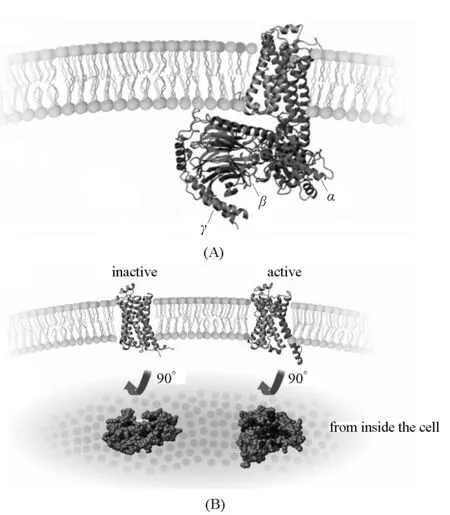
图2 G蛋白偶联受体将细胞外的激素信号转导至细胞内G蛋白的图像(A) Kobilka获得的β肾上腺素能受体图示,与细胞外的激素和细胞内的G蛋白形成复合物;(B) β肾上腺素能受体激活的模型,当激素在细胞膜外与受体结合,引起受体细胞膜内构象改变,疏水区暴露,可与G蛋白结合[17]。
Kobilka接着去到斯坦福大学,致力于得到G蛋白偶联受体及其三元复合物的图像。蛋白质的构象可由X射线晶体衍射方法得到。水溶性的蛋白质的晶体较容易获得,但G蛋白偶联受体位于细胞膜中,有7次跨膜的疏水螺旋,得到其与配体和G蛋白结合的活性构象的图像则很难。Kobilka研究小组用了20多年时间,终于在2011年实现了这一目标[16],获得了G蛋白偶联受体将细胞外的激素信号转导至细胞内G蛋白的图像(图2)。当肾上腺素在细胞膜外与G蛋白偶联受体结合时,会引起G蛋白偶联受体细胞膜内部分构象的较大改变,包括第6螺旋的位移和疏水区的暴露,从而能够与G蛋白的α亚基结合,并将其激活。图2展现了一幅美妙的图像,G蛋白偶联受体的7次跨膜螺旋结构被比喻为一束玫瑰花,当配体抓住其细胞外的一端,细胞内的玫瑰花将被打开。这种细胞外侧配体结合受体引起的较小的构象变化导致细胞内侧受体构象较大的变化,深刻地揭示了蛋白质结构和功能的关系。G蛋白偶联受体作用机制的拼图可以说基本完成了。
然而,科学探索是无止境的,我们在介绍G蛋白偶联受体时,仅仅介绍了最主要的一种机制。值得注意的是,细胞感受外界信号的受体并非只有G蛋白偶联受体这一个家族,还有离子通道偶联受体、酪氨酸激酶偶联受体等。进一步研究表明,G蛋白偶联受体在细胞内不仅仅是与G蛋白发生相互作用,还可以与一些抑制蛋白作用,这些认识使得科学家考虑使用更为严谨的命名——7次跨膜受体来取代G蛋白偶联受体。
下一次,当一杯咖啡摆在我们面前,我们看见它的色泽,嗅到它的香味,尝到它的味道的时候,不妨想一想G蛋白偶联受体,是它让我们感受到了这一切。
参 考 文 献
[1] http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/popular-chemistryprize2012.pdf
[2] Langley J N.JPhysiol(London),1901,17:231
[3] Dale H H.JPhysiol(London),1906,34:163
[4] Furchgott R F.AnnuRevPharmacol,1964,4:21
[5] Rall T W,Sutherland E W.JBiolChem,1958,232:1065
[6] Walsh D A,Perkins J P,Krebs E G.JBiolChem,1968,243:3763
[7] Lefkowitz R J,Roth J,Pricer W,etal.ProcNatlAcadSciUSA,1970,65:745
[8] Lefkowitz R J,Roth J,Pastan I.Science,1970,170:633
[9] Levitzki A,Atlas D,Steer M L.ProcNatlAcadSciUSA,1974,71:2773
[10] Lefkowitz R J,Mukherjee C,Coverstone M,etal.BiochemBiophysResCommun,1974,60:703
[11] Rodbell M,Birmbaumer L,Posh S L,etal.JBiolChem,1971,246:1877
[12] Ross E M,Gilman A G.JBiolChem,1977,252:6966
[13] Gilman A G.AnnuRevBiochem,1987,56:615
[14] De Lean A,Stadel J M,Lefkowitz R L.JBiolChem,1980,255:7108
[15] Dixon R A,Kobilka B K,Strader D J,etal.Nature,1986,321:75
[16] Rasmussen S G,De Vree B T,Zou Y,etal.Nature,2011,477:549
[17] http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/advanced-chemistryprize2012.pdf

