穿刺巴斯德芽菌荧光定量PCR检测方法的建立与应用
贺 乐, 黄惠琴, 朱 军, 刘 敏, 孙前光, 鲍时翔
(1.海南大学农学院,海口 570228;2.中国热带农业科学院热带生物技术研究所,海口 571101)
根结线虫(Meloidogynespp.)是经济作物的重要病原线虫之一[1]。全世界主要农作物因根结线虫造成的直接经济损失高达500多亿美元[2],其中北方根结线虫(M.haplaChitwood)、南方根结线虫[M.incognita(Kofoid et White)]、爪哇根结线虫[M.javanica(Treub)]和花生根结线虫[M.arenaria(Neal)]4种最常见的根结线虫病害占全部损失的90%以上[3]。在全球变暖的大趋势下,根结线虫病害将更为严重。
穿刺巴斯德芽菌[PasteuriapenetransThome(Sayre &Starr)]为革兰氏阳性菌[4],专性寄生于根结线虫[5],能够显著抑制线虫病害,提高作物产量[6]。相对于广泛使用的防治根结线虫的化学药品,它对环境无污染,是一种理想的生防菌剂材料[5]。然而,穿刺巴斯德芽菌尚未实现纯培养,且该菌在生长过程中形态多变,难以定性、定量观察。同时,该菌与根结线虫的寄生关系存在一定特异性,特定菌株只能高效寄生于某一种或几种线虫。寻找到广谱寄生的菌株资源,是穿刺巴斯德芽菌商业化应用的前提之一[7]。因此,建立一种特异性较高的穿刺巴斯德芽菌定性、定量检测方法,对该菌培养方法的优化和菌株资源的寻找都有着重要意义。
本文验证了穿刺巴斯德芽菌16S r DNA中一段序列的特异性,优化了荧光定量PCR反应体系,并以质粒为标准品构建了定量曲线,建立了能定性、定量检测该菌的荧光定量PCR方法。同时确定了该体系用于检测含穿刺巴斯德芽菌土壤样品时的可检测菌体浓度阈值。
1 材料与方法
1.1 菌株与土样
枯草芽胞杆菌由本实验室保存;穿刺巴斯德芽菌芽胞分离自感染根结线虫的胡椒根;根结线虫病土采自五指山潘阳镇和万宁万城镇的胡椒根结线虫病地;不含穿刺巴斯德芽菌的土壤样品为采自中国热带农业科学院海口实验地以及清澜港红树林土壤的等比例混合物。
试验中用到的主要试剂和仪器有:SYBR®Premix Ex TaqTM(Ta KaRa公司)、PCR Taq Mix(康为世纪公司)、质粒快速提取试剂盒(Omega公司)、载体p MD 19-T vector(Ta KaRa公司)、DH5α大肠杆菌感受态细胞(全式金公司)、DNA凝胶回收试剂盒(Biomega公司)、土壤DNA提取试剂盒(MP公司)、PCR仪(Biometra公司)、MX3005P荧光定量PCR仪(Stratagene公司)、Fastprep 24TM核酸提取仪(MP公司)。
1.2 穿刺巴斯德芽菌芽胞总DNA提取
收集含穿刺巴斯德芽菌芽胞的雌虫,压破,制成悬浮液,2 000×g低速离心1 min,取上清,去除线虫虫体等杂质。
取芽胞液500μL,加入盛有无菌玻璃珠的离心管中,添加等体积酚∶氯仿∶异戊醇(25∶24∶1)溶液;将离心管置于FastprepTM核酸提取仪中,6.5 m/s,破碎180 s;14 000×g离心10 min,取上清,加入等体积氯仿∶异戊醇(24∶1),摇匀再次离心;取上清,加入两倍体积的无水乙醇,轻摇混匀,-20℃沉淀过夜;4℃,14 000 g离心10 min,轻倒乙醇,加入500μL的70%乙醇清洗2~3次,自然风干,加入20μL无菌水溶解,-20℃保存待用。
1.3 枯草芽胞杆菌总DNA提取
挑取适量枯草芽胞杆菌菌体溶解于500μL水溶液,参照1.2方法提取总DNA。
1.4 土壤总DNA提取
按照MP公司土壤DNA提取试剂盒提取土壤样品总DNA[8],DNA溶液 -20℃保存。
1.5 荧光定量PCR特异性评价
以穿刺巴斯德芽菌16S r DNA目的片段为靶点,设穿刺巴斯德芽菌芽胞总DNA为阳性对照,以不含穿刺巴斯德芽菌的土壤总DNA以及枯草芽胞杆菌总DNA为阴性对照,进行荧光定量PCR检测,评价靶点特异性。
荧光定量PCR体系正向引物(617F):CGTGTAAGCGTTCGAAACGGT,反向引物 (1166R):CGCCGGCTGTCTCTCCAA[9]。 循 环 参 数:94 ℃预变性30 s,接着40个循环,每个循环的程序包括94℃变性7 s、55℃退火15 s、72℃延伸15 s,在55℃末采集荧光。循环结束后,从55℃逐步上升至95℃,全过程收集荧光数据,用于构建熔解曲线。试剂参考SYBR®Premix Ex TaqTM说明书添加。
1.6 PCR体系优化
用Oligo软件计算出引物的Tm值,在Tm值上、下波动5℃的范围内筛选反应最适退火温度。每个温度重复两次,取平均值,利用Mx3005P仪器附带软件比较各退火温度的差异。选取正、反向引物100、300、600、900 nmol/L 等4个不同浓度分别组合,进行qPCR反应引物浓度的优化。
1.7 重组质粒标准品的制备
以穿刺巴斯德芽菌芽胞总DNA为模板,扩增靶序列。使用DNA凝胶回收试剂盒纯化扩增产物。将目的片段连接至p MD 19-T vector,转入大肠杆菌培养,挑取阳性克隆,进行测序验证。
按照质粒提取试剂盒的操作说明提取质粒;使用纯水作参照,测定重组质粒标准品吸光度,计算重组标准品质粒的拷贝浓度。
1.8 标准曲线的建立
利用最佳反应条件对10倍梯度稀释的质粒标准品(2.48~2.48×106拷贝/PCR)进行荧光定量PCR扩增,确定靶点检测灵敏度。以起始模板浓度对数为x轴,Ct值为y轴,构建标准曲线;重复4次试验,求取Ct值平均数和变异系数,确定标准曲线的可靠性和可重复性。
1.9 土壤样品的荧光定量PCR测定
分别将含有1×107、1×106、1×105、1×104、1×103、1×102个穿刺巴斯德芽菌芽胞的300μL芽胞液加入0.5 g无穿刺巴斯德芽菌土壤样品中,提取该6份土壤样品以及采自潘阳镇、万城镇的根结线虫胡椒病地土样总DNA,进行荧光定量PCR反应,测定土壤中穿刺巴斯德芽菌芽胞最低的可检测浓度以及2份病土中该菌菌体浓度。
2 结果
2.1 靶点特异性评价
特异性试验结果显示,该靶点只对穿刺巴斯德芽菌总DNA能产生扩增信号,无穿刺巴斯德芽菌土壤总DNA、枯草芽胞杆菌总DNA均无扩增。PCR产物的琼脂糖凝胶电泳结果显示,扩增片段大小约为550 bp,与目的片段大小相符。因而,该靶点对穿刺巴斯德芽菌具有良好的特异性。
2.2 荧光定量PCR体系优化
退火温度优化试验的扩增曲线(图1)显示,在57~60℃之间时Ct值与平台期荧光值变化较小,61℃时荧光值显著减小,为保证反应效率以及特异性,选取最佳退火温度为60℃。
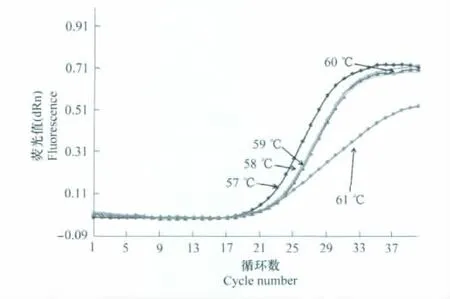
图1 引物退火温度优化Fig.1 Optimization of the annealing temperature for the primers
引物浓度优化结果(图2)显示,正、反向引物浓度分别为900、300 nmol/L时Ct值最小,故选定此浓度组合为最佳的引物浓度。
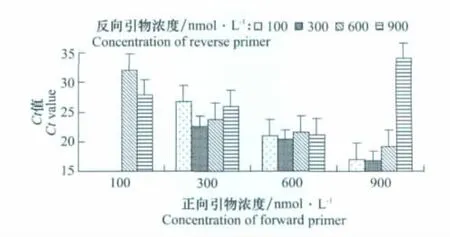
图2 引物浓度优化Fig.2 Optimization of the concentration for the primers
2.3 质粒标准品及标准曲线
提取经多次纯化的阳性克隆菌落的质粒,利用特异靶点的引物对质粒DNA进行PCR扩增,获得大小约550 bp的片段,与目的片段相符;BLAST分析质粒DNA序列显示,插入片段与目的片段的同源性为100%,表明质粒构建成功。质粒标准品DNA溶液A260/A280值为1.8,DNA纯度较高。经计算,溶液拷贝浓度为2.48×1013拷贝/PCR。
荧光定量PCR反应时,在设置的质粒样品浓度梯度样品中,当拷贝浓度为24.8拷贝/PCR时产生特异扩增,而在浓度为2.48拷贝/PCR时,则无扩增信号。表明该靶点对质粒样品拷贝数的可检测阈值为24.8拷贝/PCR。
以6个浓度梯度质粒样品(24.8~2.48×106拷贝/PCR)的Ct值和质粒拷贝浓度对数为坐标轴构建标准曲线,回归方程为y=-3.200×logx+34.43,相关系数R2为0.998,扩增效率为105.4%(图3)。重复测定4次,6个浓度梯度质粒样品的Ct值的平均值依次为30.64±0.12、28.18±0.08、24.42±0.12、21.29±0.15、17.66±0.07、15.25±0.09,对应变异系数分别为0.41%、0.30%、0.49%、0.72%、0.40%、0.58%,均小于5%;标准曲线可靠,重复性良好,可用于穿刺巴斯德芽菌的定量检测。
2.4 土壤样品的荧光定量PCR检测
针对人工添加穿刺巴斯德芽菌芽胞的土壤样品,检测结果(图4)显示Ct值随土壤中芽胞浓度的增加而减小;当芽胞浓度在2×103个/g土壤或者以上时,PCR反应产生特异性扩增;而芽胞浓度为2×102个/g土壤时,无扩增信号。因而,以所选靶点为基础的荧光定量PCR检测方法,对土壤中穿刺巴斯德芽菌芽胞的最低可检测芽胞浓度为2×103个/g土壤。

对胡椒根结线虫病地土壤样品进行荧光定量PCR检测,潘阳镇土样有特异性扩增信号,且Ct值与芽胞数量2×103个/g土壤样品接近;万城镇土样无扩增信号。这表明潘阳土样中含有穿刺巴斯德芽菌,芽胞含量约为2×103个/g土壤,而万城镇土样中没有穿刺巴斯德芽菌或者其浓度小于可检测阈值。
3 讨论
荧光定量PCR是一种快速、特异性高的检测方法,在微生物的定性、定量检测上运用广泛。目前,尚无该方法检测穿刺巴斯德芽菌培养样品及土壤样品的报道。本文以穿刺巴斯德芽菌16S r DNA中的片段为靶点,经过特异性验证和反应条件优化,构建了该菌的荧光定量PCR检测方法;此方法对含穿刺巴斯德芽菌芽胞土壤样品的可检测芽胞浓度阈值为2×103个/g土壤,灵敏度与PasteurianishizawaeSayre et al.土壤样品的可检测阈值处于同一水平[10]。挑取两处病地胡椒根结中成熟雌虫进行显微观察时,发现从潘阳镇采集的胡椒根中有大量穿刺巴斯德芽菌,在万城镇病地中则未发现。
在该菌的培养方面,经过长期探索,本课题组已脱离植物成功实现人工扩培,但尚未实现纯培养,且该菌在生长过程中形态多变,通过显微观察等方法难以对其进行定性、定量检测。以特异性、灵敏度见长的荧光定量PCR检测方法,是该菌定量检测的最佳选择之一。荧光定量PCR中,用于定量的标准品一般有菌体总DNA、质粒和PCR产物3种。由于穿刺巴斯德芽菌尚未被纯培养,且野外菌株资源难以获取,若以总DNA为标准品对该菌进行定量,有一定的局限性。PCR产物作为标准品则有保存周期短、拷贝数难以确定等缺点。本文以保存更长久且拷贝浓度确定的重组质粒为标准品,建立了标准曲线。本方法对质粒样品的检测限为24.8拷贝/PCR,该值与任月等[11]所构建的粪便中肠球菌荧光定量PCR检测方法的检测限在同一水平。此定量检测方法对穿刺巴斯德芽菌的特异性较高,检测浓度范围广、灵敏度高,可用于该菌的定量检测。
[1]谢辉.植物线虫分类学[M].合肥:安徽科学技术出版社,2000:20-80.
[2]Charles L,Carbone I,Davies K,et al.Phylogenetic analysis ofPasteuriapenetransby use of multiple genetic loci[J].Jour-nal of Bacteriology,2005,187(16):5700-5708.
[3]Johnson A W,Fassuliotis G.Nematode parasites of vegetable crops[M]∥Nickle W R.Plant and insect nematodes.New-York:Basel Marcel Decker Inc,1984:323-372.
[4]Sayre R,Starr M.Pasteuriapenetrans(ex Thorne 1940)nom.rev.,comb.n.sp.n.a mycelial endospore-forming bacterium parasitic in plant-parasitic nematodes[J].Proceedings of the Helminthological Society of Washington,1985,52:149-165.
[5]Sayre R M,Wergin W P,Schmidt J M,et al.Pasteurianishizawaesp.nov,a mycelial and endospore-forming bacterium parasitic on cyst nematodes of generaHeteroderaandGlobodera[J].Research in Microbiology,1991,142:551-564.
[6]Giannakou I O,Pembroke B,Gowen S R,et al.Effects of long term storage and above normal temperatures on spore adhesion ofPasteuriapenetransan infection of root-knot nematodeMeloidogynejavanica[J].Nematologica,1997,43:185-192.
[7]Davies K G.Understanding the interaction between an obligate hyperparasitic bacterium,Pasteuriapenetransand its obligate plant-parasitic nematode host,Meloidogynespp.[J].Advance in Parasitology,2009,68:211-45.
[8]Jacob Bælum,Trine H,Hans C,et al.Degradation of 4-chloro-2-methylphenoxyacetic acid in top-and subsoil is quantitatively linked to the classⅢtf dagene[J].Applied and Environmental Microbiology,2006,72:1476-1486.
[9]Duan Y P,Castro H F,Hewlett T E,et al.Detection and characterization ofPasteuria16S r RNA gene sequences from nematodes and soils[J].International Journal of Systematic and Evolutionary Microbiology,2003,53:105-112.
[10]Ndeme A,Mohammad B,Gregory N.A real-time PCR assay for the detection ofPasteurianishizawaein soil[C]∥American Phytopathological Society Annual Meeting,2008.
[11]任月,袁杰利,卢行安,等.粪便中肠球菌SYBR GreenI荧光定量PCR检测方法的建立[J].中国微生态学杂志,2007(6):499-501.

