云芝总发酵物及其多糖抗氧化活性比较研究
王菲菲,郝利民,,* ,王宗臻,任忠义,牛 爽,王启志,鲁吉珂,5,贾士儒
(1.天津科技大学,工业发酵微生物重点实验室,天津300457;2.总后勤部军需装备研究所,北京100010;3.宁波宜科科技实业股份有限公司,浙江宁波315153;4.北京九发药业有限公司,北京102308;5.郑州大学生物系,河南郑州450001)
自由基(free radical)是生物体在新陈代谢过程中产生的一类具有高度氧化活性的带有一个或几个不配对电子的分子或原子,主要包括超氧阴离子和羟自由基等。正常情况下,机体内自由基的产生与消亡处于动态平衡,当这一平衡被打破时即会发生氧化应激,自由基会攻击机体,造成脂质、蛋白质和DNA等生物大分子损伤,进而引发一系列疾病[1-2]。高强度军事作业和剧烈体育运动会使机体处于缺血和缺氧状态,机体氧化作用加强,自由基数量急剧上升,进而引发连锁反应,破坏细胞结构,引起脂质过氧化,导致机体氧化损伤。氧自由基还会引发疲劳、延迟性肌肉酸痛、运动性贫血和血红蛋白尿等,影响部队的战斗力和军事作业能力。抗氧化剂能清除自由基,其作用可通过优先被氧化,或对氧化损伤进行修复从而发挥保护作用。真菌多糖作为一种天然生物大分子,因其药食用功效广泛,安全无毒,受到越来越多的关注[3],有望替代化学合成类抗氧化剂。例如,灵芝子实体多糖、冬虫夏草菌丝体胞内多糖、红菇胞外多糖等均具有很强的体外抗氧化活性[4-6]。云芝隶属于担子菌亚门,层菌纲、非褶菌目、多孔菌科、云芝属[7]。云芝在我国被广泛用于癌症和免疫缺陷等疾病的治疗,被民间视为治病神药[8]。研究表明,云芝多糖还具有显著的抗氧化活性,对超氧阴离子自由基和DPPH自由基具有显著的清除作用[9-10]。目前,关于云芝总发酵物抗氧化活性方面的报道较少。本文通过考察云芝总发酵物及其多糖对氧化损伤酵母的保护作用,结合清除自由基能力,对云芝总发酵物抗氧化活性进行研究,可为云芝发酵物的开发利用提供参考,也可为云芝抗氧化保健食品的开发提供依据。
1 材料与方法
1.1 材料与仪器
云芝[Coriolus versicolor(L.:Fr.)]总后勤部军需装备研究所;酿酒酵母(Saccharomyces cervisiae)AS2399 天津科技大学菌种包藏室;浓硫酸 天津市元立化工有限公司,分析纯;苯酚 北京鼎国生物技术有限责任公司,分析纯;95%乙醇 天津市四通化工厂,分析纯;葡萄糖、蛋白胨、磷酸二氢钾、硫酸镁、水杨酸、邻苯三酚、硫酸亚铁、VC天津北方天医化学试剂厂,分析纯;盐酸 天津化学试剂三厂,分析纯;过氧化氢 天津市风船试剂科技有限公司,分析纯。
电子天平JH1102、分光光度计722s 上海精密科学仪器有限公司;托盘天平HCTP11B5北京医用天平厂;旋转蒸发仪RE-3000 上海亚荣生化仪器厂;台式高速离心机TGL16G 上海医用分析仪器厂;pH计PHSJ-4A 上海雷磁仪器厂;电热鼓风干燥箱DDG-101-3 天津天宇机电有限公司;恒温摇床培养箱HYG 上海欣蕊自动化设备有限公司;超净工作台VS-1300V 苏州安泰空气技术有限公司;压力蒸汽灭菌锅LS-B50L型 上海医用核子仪器厂;5升离位灭菌玻璃发酵罐 上海百仑生物技术有限公司。
1.2 实验方法
1.2.1 云芝总发酵物的制备 在林晓霞等[11]的方法基础上改进,即利用基础培养基(葡萄糖3.00%,蛋白胨 0.40%,KH2PO40.10%,MgSO40.05%),在150mL/500mL,28℃,160r/min条件下,云芝液体培养6d,将菌体过滤,收集发酵液,利用旋转蒸发仪将发酵液浓缩。
1.2.2 云芝多糖的制备 在王俊明等[12]的方法基础上改进,即将上述云芝发酵液浓缩物以三倍95%乙醇沉淀,4℃下醇析12h,收集沉淀物,即为云芝多糖。
1.2.3 酵母细胞悬浮液的制备 取培养至对数期的酵母细胞培养液于4000r/min离心5min,然后将菌体混悬于100mmol/L(pH7.4)的磷酸缓冲液中,细胞浓度为1 ×107~2 ×107个/mL[13]。
1.2.4 超氧阴离子(O2-·)清除能力测定 取浓度为50mmol/L pH8.2的Tris-HCl缓冲溶液4.5mL,蒸馏水4.5mL混匀,加25℃预热的25mmol/L邻苯三酚0.3mL(以10mmol/L HCl配制),迅速摇匀后倒入比色皿,325nm下每隔30s测定吸光度值,计算线性范围内每分钟吸光度的增加。空白用10mmol/L HCl代替邻苯三酚,样品管加邻苯三酚前加样液1mL,蒸馏水补充体积,同样方法设VC阳性对照。每个样3次平行取平均值[14]。清除率的公式如下:
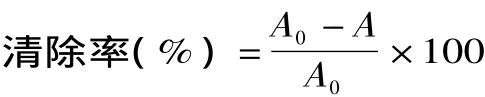
式中,A0为邻苯三酚自氧化速率,A为加入样品后邻苯三酚自氧化速率,单位为吸光度每分钟的增加值。
1.2.5 羟自由基的清除能力测定 各试管中加入不同浓度样液 2mL,9mmol/L水杨酸-乙醇 2mL,9mmol/L FeSO42mL,最后加入8.8mol/L的H2O22mL启动反应,37℃反应30min。蒸馏水作为空白对照,在510nm下测量各待测液的吸光度。考虑到样品本身的吸光值,同样条件用双蒸水代替H2O2为本底吸收[15]。清除率的公式如下:
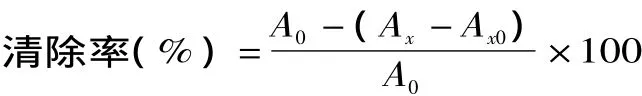
式中,A0为空白对照液吸光度,Ax为加入样品后吸光度,Ax0为不加H2O2的样品溶液本底吸光度。
1.2.6 氧化应激 酵母细胞悬液中添加云芝总发酵物,经过一段时间温浴,在前期实验确定致死剂量的基础上,以终浓度为2%的H2O2或20W紫外灯30cm处照射60s(酵母存活率<5%)两种条件处理5mL的细胞悬液,采用平板活菌计数法,稀释到适当浓度,涂布于YEPD培养基上,28℃培养2d。存活率通过与对照(相同条件下未处理样品的菌落数)相比而获得[13]。
2 结果与讨论
2.1 自由基清除能力测定
2.1.1 超氧阴离子自由基(O2-·)清除能力测定 清除超氧阴离子自由基的结果如图1所示。云芝总发酵物及其多糖均对超氧阴离子自由基具有明显的清除率,且在0.1~0.5mg/mL的多糖浓度范围内呈一定量效关系,云芝总发酵物清除效果最为显著,高于云芝多糖样品。经EC50计算得知,云芝总发酵物EC50值为0.34mg/mL,云芝多糖为0.35mg/mL,而 VC为0.28mg/mL。
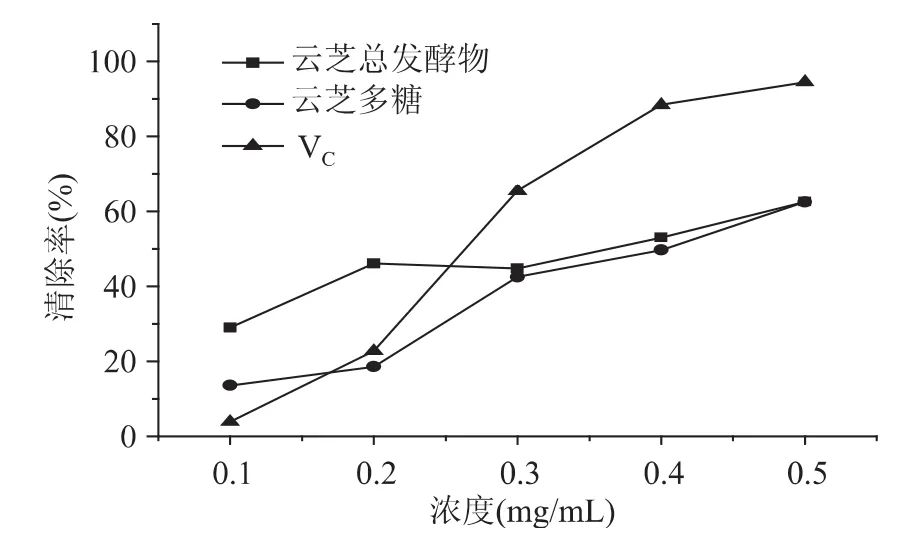
图1 云芝总发酵物及其多糖对超氧阴离子自由基的清除能力Fig.1 Scavenging effects of the fermentation products ofCoriolus versicolor and its polysaccharide on superoxide ion radicals
2.1.2 羟自由基清除能力测定 清除羟自由基实验结果如图2所示。云芝总发酵物及其多糖均对羟自由基具有明显的清除率,且在0.1~0.5mg/mL的多糖浓度范围内呈一定量效关系。其中,云芝总发酵物清除羟自由基的效果最为显著,在0.1~0.5mg/mL的浓度范围内均高于云芝多糖,且在0.1~0.4mg/mL浓度范围内的清除能力明显高于VC。经EC50计算得知,云芝总发酵物 EC50值为 0.13mg/mL,而 VC为0.25mg/mL,是前者的2倍(p<0.05有显著性差异),云芝多糖为0.16mg/mL,说明云芝总发酵物对羟自由基表现出较强的清除作用,优于云芝多糖和VC。
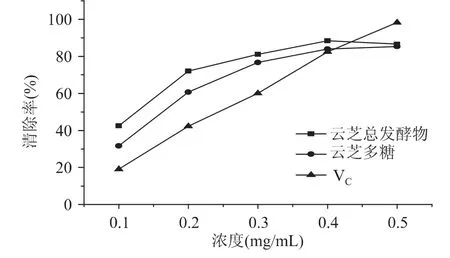
图2 云芝总发酵物及其多糖对羟自由基的清除能力Fig.2 Scavenging effects of the fermentation products ofCoriolus versicolor and its polysaccharide on hydroxyl free radicals
超氧阴离子自由基和羟自由基是活性氧自由基的典型代表,前者可通过转化为其他多种有破坏作用的自由基而使其功能放大。在所有活性氧自由基中,羟自由基毒性最强,几乎能与所有的功能性生物大分子起反应,造成生物体的巨大伤害[16]。从本实验结果看,云芝总发酵物及其多糖对超氧阴离子自由基和羟自由基均具有明显的清除能力。这为云芝总发酵物及其多糖在保健食品和药物领域的应用提供依据。
2.2 云芝总发酵物对酵母氧化损伤的保护效应
云芝总发酵物对氧化损伤酵母细胞的保护作用如图3、图4所示。酵母细胞的存活率随着云芝总发酵物和VC添加剂量的增加而升高,说明前者对细胞H2O2以及紫外线氧化损伤的保护作用有剂量依赖性(相关系数分别为R=0.99和R=0.95)。当云芝总发酵物多糖浓度为1.5mg/mL时H2O2氧化损伤酵母细胞存活率为46%,是VC(34%)的1.4倍,且明显高于空白对照组;当云芝总发酵物多糖浓度为20mg/mL时,紫外氧化损伤细胞存活率为35%,与VC持平,明显高于空白对照组。
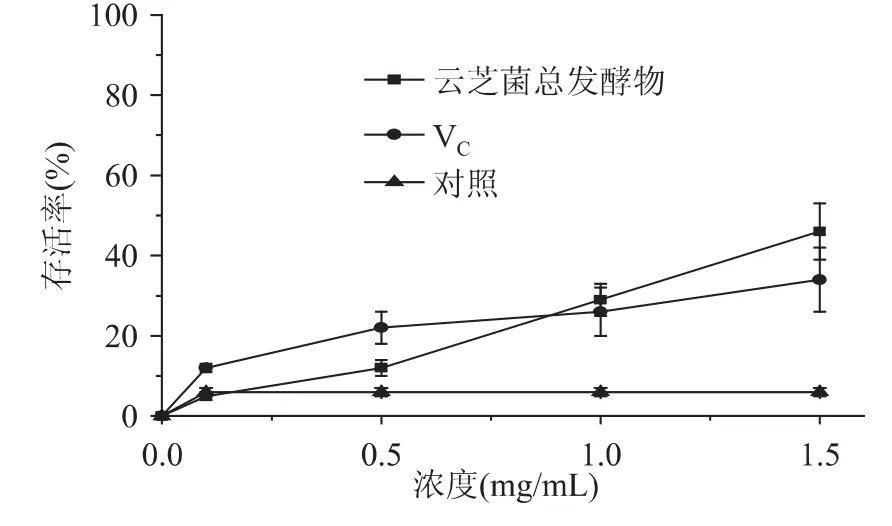
图3 云芝总发酵物对H2O2处理下酵母氧化损伤细胞的保护作用Fig.3 Protective effects of the fermentation products by Coriolus versicolor on oxidative damaged yeast cells under H2O2treatment
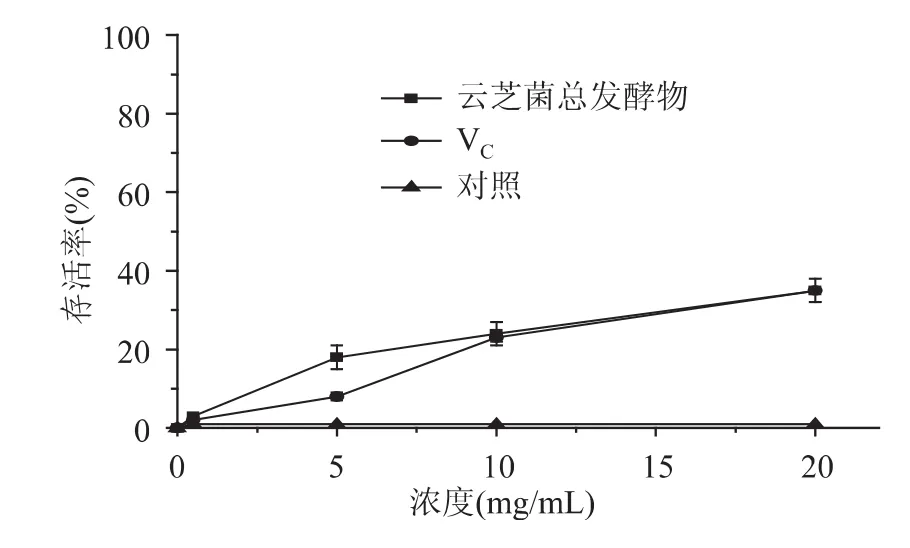
图4 云芝总发酵物对紫外线照射处理下酵母氧化损伤细胞的保护作用Fig.4 Protective effects of the fermentation products byCoriolus versicolor on oxidative damaged yeast cells under UV irradiation
酵母细胞内的水经紫外线照射后会产生多种活性氧,如 O3、·OH、O2-·等。和·OH、O2-·一样,O3也是进攻生物分子的强氧化剂,可以氧化蛋白质的胱氨酸和组氨酸,氧化不饱和脂肪酸导致脂质过氧化,致使酵母细胞大量死亡。云芝总发酵物可以显著提高其存活率,较云芝多糖表现出更强的抗氧化能力。
2.3 云芝总发酵物与其他天然抗氧化活性成分对酵母细胞氧化损伤保护作用的对比
分别将云芝总发酵物(Y)及其多糖溶液(Yp)、茯苓总发酵物(F)及其多糖溶液(Fp)、大球盖菇总发酵物(D)、槲皮素(H)、VC(C)配成20mg/mL的溶液,进行酵母细胞紫外线氧化损伤保护实验,结果如图5所示。
由图5可以看出,添加云芝总发酵物的氧化损伤酵母细胞存活率达到47.4%,其抗氧化效果优于云芝多糖溶液和其他两种真菌发酵物及槲皮素。
云芝总发酵物的抗氧化活性优于云芝多糖,原因之一可能是云芝总发酵物中除了多糖外,还有其他抗氧化活性组分,不同化合物具有协同增效作用;原因之二可能是在多糖制备中,乙醇醇析等操作引起多糖空间结构变化,从而导致云芝多糖的抗氧化活性降低。
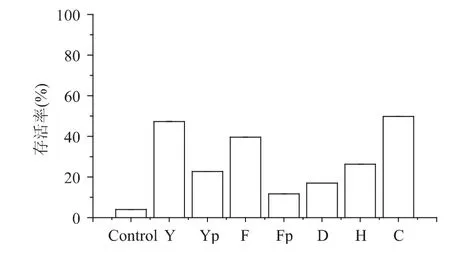
图5 云芝总发酵物与其他天然抗氧化活性成分对酵母细胞氧化损伤保护作用的对比Fig.5 Comparison of the protective effect of the fermentation products by Coriolus versicolor and other natural antioxidant components on oxidative damaged yeast cells
3 结论
云芝总发酵物及其多糖对超氧阴离子自由基和羟自由基均具有明显的清除能力。云芝总发酵物对经过H2O2和紫外照射两种氧化应激处理下的酵母细胞具有显著的保护作用,且呈剂量依赖性。云芝总发酵物的抗氧化活性优于云芝多糖以及其他两种真菌发酵物。下一步应对云芝总发酵物化学组成进行研究,进而阐明云芝总发酵物的抗氧化作用机理。
[1]Finkel T,Nikki J,Holbrook.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408:239-247.
[2]Marx JL.Oxygen free radicals linked to many diseases[J].Science,1987,235:529.
[3]Wasser SP.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Applied Microbiology Biotechnology,2002,60:258-274.
[4]Fan LP,Li JW,Deng K Q,et al.Effects of drying methods on the antioxidantactivities ofpolysaccharides extracted from Ganoderma lucidum[J].Carbohydrate Polymers,2012,87(2):1849-1854.
[5]Wang L,Wang GY,Zhang JJ,et al.Extraction optimization and antioxidant activity of intracellular selenium polysaccharide by Cordyceps sinensis SU-02[J].Carbohydrate Polymers,2011,86(4):1745-1750.
[6] Gao CJ,Wang ZY,Su TT,etal.Optimisation of exopolysaccharide production by Gomphidius rutilus and its antioxidant activities in vitro[J].Carbohydrate Polymers,2012,87(3):2299-2305.
[7]许锦堂.中国药用真菌学[M].北京:北京医科大学·中国协和医科大学联合出版社,1997:127-128.
[8]Yang QY.History,present status and perspectives of the study of Yun Zhi polysaccharopeptide[J].Advance research in PSP,1999:5-15.
[9]周海华,马海乐.云芝多糖的体外抗氧化活性研究[J].食品研究与开发,2008,29(3):44-48.
[10]Santos Arteiro J,Rosa'rio Martins M,Salvador C,et al.Protein-polysaccharides of Trametes versicolor:production and biological activities[J].Medicinal Chemistry Research,2012,21(6):937-943.
[11]林晓霞,熊强,陆利霞,等.云芝糖肽的液体发酵培养基的研究[J].生物加工过程,2006,4(2):64-68.
[12]王俊明,周自云,胡景江,等.云芝液体培养过程中胞外酶与胞外多糖的变化[J].西北林学院学报,2004,19(2):22-24.
[13]王玉.高渗、低温和氧化条件下酵母细胞应激产生活性物质的研究[D].天津:天津科技大学,2005.
[14]程超,李伟.几种植物水溶性多糖的体外抗氧化作用[J].食品工业科技,2006,27(9):63-65.
[15]周向军,高义霞,袁毅君,等.乌龙茶茶褐素提取工艺的优化及抗氧化研究[J].中国实验方剂学杂志,2011,17(4):38.
[16]汤俊,胡征宇.3种念珠藻多糖对自由基的清除作用[J].武汉植物学研究,2006,24(1):63-66.

