葛根素对大鼠脑缺血后海马中EPO和STAT-5表达的影响
潘平康 张 超 吴海琴 王虎清 张 欣
葛根为豆科植物野葛或甘葛藤的干燥根,应用历史悠久,现代药理学研究发现其主要活性成分为异黄酮类化合物[1],葛根素注射液系从豆科植物野葛或甘葛藤根中提取的一种黄酮苷,具有明显的扩张脑血管,加快血流速度,改善脑微循环,增脑血流量,改善氧供的作用。葛根总黄酮对脑血管的扩张作用要比冠状血管更明显,能改善脑循环和外周循环,因此临床上已广泛应用于脑缺血的治疗,具有明显疗效[2]。
促红细胞生成素(erythropoietin,EPO)是由胚胎肝脏与成人肾脏分泌的一种含唾液酸的酸性糖蛋白[3],正常情况下在人类大脑组织内存在内源性EPO及EPO-R,并广泛参与了神经系统的功能。脑缺血后脑组织中EPO和EPO-R的表达水平明显增高。EPO的表达受低氧诱导因子(hypoxia-inducible factor-1,HIF-1)的调节,但低氧并非是诱导EPO和EPO-R表达增加的唯一因素。信号传导和转录活化因子5(signal transducer and activator of transcription 5,STAT-5)是一种能与靶基因调控区DNA结合的胞浆蛋白,在细胞生存和增殖方面起着重要的媒介作用。JAK2/STAT-5通路可能是EPO抗神经元凋亡的主要信号传导途径之一。本研究应用TTC染色及免疫组化测定各组大鼠局限性脑缺血后脑梗死体积及海马CA3区EPO和STAT-5的动态表达情况,目的在于探讨葛根素对大鼠海马中EPO和STAT-5表达水平的影响及其可能机制,为葛根素治疗脑缺血的临床应用提供理论依据。
1 材料与方法
1.1 动物分组
雄性SD大鼠105只,体重250~800 g,月龄2~3个月(由西安交通大学医学院动物中心提供),并随机分为3组:模型干预组(n=45)、模型对照组(n=45)和假手术组(n=15)。模型干预组及模型对照组根据干预时间不同又随机分为2 h组、12 h组、24 h组,每组各15只。各模型干预组分别于分组对应的时间点给予葛根素注射液(100 mg/kg)腹腔注射,各模型对照组及假手术组给予等量生理盐水腹腔注射。每组取5只用于TTC染色,剩余10只则行免疫组化染色观察海马CA3区EPO及STAT-5阳性细胞的表达情况。
1.2 主要试剂
羊抗大鼠EPO多克隆抗体购自Santa Cruz Biotechnology,Inc;兔抗大鼠STAT-5多克隆抗体购自武汉博士德生物工程有限公司;SABC免疫组化试剂盒来自武汉博士德生物工程有限公司;DAB显色试剂盒购于北京中杉生物技术有限公司;葛根素注射液为陕西安康正大制药厂提供。
1.3 模型的建立
参考 Zea-Longar[4]和 Koizumi[5]的插线方法,采用线栓法制备大鼠大脑中动脉闭塞局灶性脑缺血模型(MCAO);10%水合氯醛3 ml/kg腹腔注射麻醉后,作颈部正中切口,钝性分离左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)和翼腭动脉(PPA),在颈总动脉分叉处下方剪一0.2 mm的楔形切口,从切口向远端插入备好的栓线,感到有轻微阻力时即停止,结扎固定好栓线,缝合皮肤;2 h后大鼠清醒进行神经行为学评估。模型干预组及模型对照组均建成MCAO模型,假手术组仅钝性分离左侧CCA、ICA、ECA、PPA后即缝合皮肤。完成模型制备后各模型干预组分别于分组对应时间点给予葛根素(100 mg/kg)腹腔注射,模型对照组及假手术组均于相应时间点给予等量生理盐水腹腔注射。
1.4 标本的采集
各组于给药5 h后以10%水合氯醛3 ml/kg腹腔注射麻醉大鼠,开胸灌注,断头取脑,用直镊从大脑基底部剥取大脑,从视交叉处冠状位切为两半,除去嗅脑、小脑和脑干,剩余脑组织置于4%多聚甲醛固定12 h,再用蒸馏水冲洗浸泡24 h,石蜡包埋。
1.5 TTC染色
给药后5 h将大鼠麻醉迅速断头,剥离大脑;生理盐水冲洗片刻,-20℃速冻5 min,然后弃去小脑和延髓,将脑从额极向后连续冠状位切片,每2 mm一张,共5~6片;放入1%2,3,5-三苯基-2H-四唑盐酸盐(TTC)中,37℃摇晃恒温孵育30 min,0.1 MPBS溶液冲洗2~3次;然后用4%多聚甲醛溶液固定24 h;正常脑组织为鲜红色,梗死脑组织为白色;将固定的脑片按切片顺序排列,拍照后扫描输入计算机。用图像处理软件计算每一脑片白色区域的面积及红色区域的面积,乘以厚度(2 mm)并将所得数值相加得相应的体积。
1.6 免疫组化染色(SP法)
将所取之脑块自前向后行冠状位切片,片厚约6μm,每张切片包含海马的冠状位切面,梯度乙醇脱蜡至水,3%(体积分数)H2O2室温孵育40 min,微波抗原修复10 min,室温冷却2 h,正常血清封闭40 min,分别滴加第一抗体(羊抗大鼠EPO多克隆抗体亲合纯化抗体,工作浓度为1∶500;兔抗大鼠Stat-5多克隆抗体,工作浓度为1∶200),4℃过夜,生物素化二抗室温孵育40 min,加辣根过氧化物酶标记的链酶卵白素工作液室温孵育30 min,DAB显色5 min,苏木素复染核,脱水、透明、封片。TBS缓冲液分别代替一抗经上述步骤染色作空白对照。每只大鼠取切片1张,光镜下观察HE染色大鼠海马CA3区神经元形态结构以及免疫组化染色阳性细胞数,以细胞内出现鲜艳的棕黄色颗粒为阳性细胞。用图像信号采集分析系统测量计数每个视野(10×40倍)下阳性细胞数,每个部位随机测5个视野,取其平均值。
1.7 统计学处理
2 结 果
2.1 模型制备
实验共用大鼠123只,无症状5只,未到时相死亡5只,蛛网膜下腔出血8只,纳入实验105只,成功率为85.3%。
2.1.1 TTC染色测量脑梗死体积
用TTC染色测量脑梗死体积,模型对照组的梗死体积:2 h组为(158±12)mm3,12 h组为(178±15)mm3,24 h组为(200±26)mm3,模型干预组梗死体积:2 h组为(120±17)mm3,12 h组为(155±14)mm3,24 h组为(196±21)mm3。模型干预2 h组及12 h组的梗死体积明显小于模型对照组各对应时间点(P<0.05),而模型干预24 h组与模型对照24 h组比较,梗死体积虽有所缩小但不具有统计学意义。
2.1.2 EPO和STAT-5的表达水平
光镜下观察假手术组海马的维体细胞层有散在分布的EPO和STAT-5阳性细胞,EPO以胞浆染色为主,STAT-5以胞核染色为主,模型对照组两种蛋白阳性细胞数更多,染色更加明显,模型干预组的形态介于两者之间。
与模型对照组各对应时间点比较,模型干预组海马 CA3区 EPO 及STAT-5表达 减 少 (P<0.05),但均高于假手术组(表1)。
与假手术组比较,模型对照组及模型干预组海马CA3区EPO阳性细胞数均明显增加(P<0.05),2 h组EPO表达开始明显增多,染色明显:12 h组进一步增高,染色更加明显;24 h组较前下降,染色变淡;STAT-5亦于相应时间点明显表达于模型对照组及模型干预组大鼠的海马CA3区,其蛋白表达随时间变化的规律与EPO大致相同,而且模型对照组及模型干预组各时间点EPO和STAT-5表达水平呈同步增减变化。
表1 各组大鼠海马CA3区EPO及STAT-5阳性细胞数比较(±s,n=10,个/每个400倍视野)
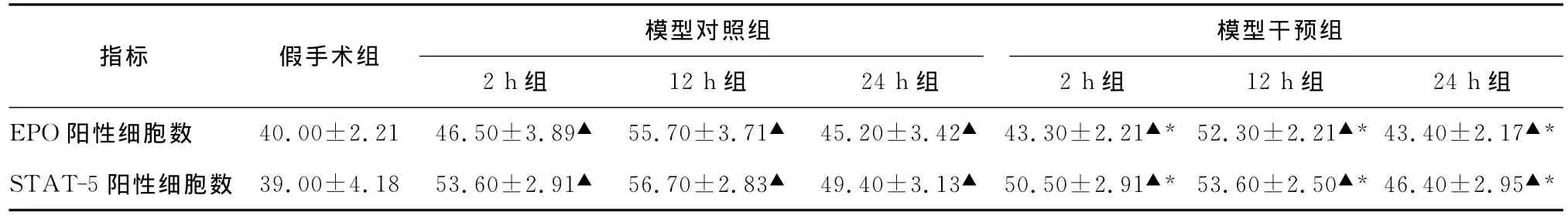
表1 各组大鼠海马CA3区EPO及STAT-5阳性细胞数比较(±s,n=10,个/每个400倍视野)
注:与假手术组比较,▲P<0.05;与模型对照组各对应时间点比较,*P<0.05
指标 假手术组模型干预组2 h组 12 h组 24 h组 2 h组 12 h组 24 h组模型对照组EPO阳性细胞数 40.00±2.21 46.50±3.89▲ 55.70±3.71▲ 45.20±3.42▲ 43.30±2.21▲* 52.30±2.21▲*43.40±2.17▲*STAT-5阳性细胞数 39.00±4.18 53.60±2.91▲ 56.70±2.83▲ 49.40±3.13▲ 50.50±2.91▲* 53.60±2.50▲*46.40±2.95▲*
3 讨 论
促红细胞生成素(erythropoietin,EPO)是一种近年来发现的具有多种功能的神经递质,它可以通过与相应受体结合引起一系列的信号转导,参与缺血后的脑保护。由于在脑缺血、缺氧损伤发生后,EPO的生成量成倍增加,并促进神经元的存活,对神经元起保护作用,所以有人认为EPO也可能是脑缺血时进行预处理的一种介质[6],是机体生理性自我保护机制的一个重要组成部分。EPO对脑缺血损伤的保护作用可分为直接作用和间接作用两种类型,直接作用包括对缺氧缺血诱导细胞凋亡的抑制,拮抗兴奋性氨基酸毒性、抑制NO过度合成、抗脑缺血后炎症反应等;间接作用是指在局灶性脑梗死的过程中EPO通过诱导产生各种细胞因子,刺激新生血管形成,发挥神经营养、神经保护作用[7]。但其具体抗神经元凋亡的信号转导机制尚不完全清楚,有研究显示EPO可能主要是通过与相应靶细胞膜表面受体(EPO-R)结合,形成二聚体,并磷酸化激活Janus激酶2(Janus kinase 2,JAK2)(一种EPO受体细胞内部分相关的酪氨酸激酶),使之发生自体磷酸化,继而引发下游信号转导,调节细胞凋亡[8]。其中STAT-5作为潜在的细胞质转录因子,是JAK2的直接作用底物,可能是该转导过程中的关键因子[9]。
本实验结果显示,(1)脑缺血12 h内给予葛根素干预能够明显减少脑梗死体积,葛根素于缺血24 h后干预脑梗死体积虽可减少,但与模型对照组比较无统计学意义;(2)模型干预组海马CA3区EPO表达较模型对照组各对应时间点减少(P<0.05),但均高于假手术组,具有统计学差异(P<0.05);(3)各组STAT-5蛋白的表达水平及随时间变化的规律与EPO大致相同。
上述结果表明,脑缺血早期给予葛根素干预能够明显减少脑梗死体积。推测葛根素可能通过改善脑血流、拮抗兴奋性氨基酸毒性作用、抗血小板聚集、改善血液高凝状态、抑制细胞凋亡等作用[10],促进缺血半暗带的血流灌注,抑制细胞凋亡的发生,促使“半暗带”向正常组织转化,从而明显减少梗死体积,促进神经功能恢复。发病12h以内可能为葛根素治疗缺血性脑损伤的最佳时间窗。
模型干预组海马CA3区的EPO及STAT-5阳性细胞数均较模型对照组明显下降,以上研究结果进一步印证了EPO的产生与脑组织的供血供氧情况密切相关,并提示葛根素能够促进缺血脑组织的血流灌注、提高缺血区氧浓度,进而使模型干预组大鼠海马CA3区EPO及STAT-5阳性细胞数显著低于模型对照组,从而起到神经保护作用。本实验同时观察到模型干预组与模型对照组各时间点EPO和STAT-5表达同步增减变化。据此本研究推测,EPO和STAT-5在缺血性脑损伤中可能作为保护性的因子起到抗神经细胞凋亡的作用,这与前人的研究结论相一致[11],进而推测 EPOR-JAK2-STAT-5途径可能也存在神经细胞中,且葛根素有可能是通过EPOR-JAK2-STAT-5信号转导通路途径发挥脑缺血后抗神经元凋亡的保护性作用。
1 郑俊华,主编.生药学.第3版.北京:人民卫生出版社,1999.159.
2 杨存聪.西药联合葛根素注射液治疗急性脑梗死观察.实用中医药杂志,2007,23(2):99.
3 Yang T,Emilie P,Thomas F,et al.Effect of hypoxic preconditioning on brain genomic response before And following ischemia in the adult mouse:Idetification of potential neuroprotective candidates for stroke.Neurobiology of Disease,2006,21(1):18-28.
4 Zea LE,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(11):84-91.
5 Koizumi J,Yoshida Y,Nakazawa T,et al.Experimental studies of ischemic brain edema:A new experimental model of cerebral embolish in rats in which recirculation can be introduced in the ischemic area.Jpn J Stroke,1986,8:1-8.
6 Dawson TM.Preconditioning-mediated neuro Protection through erythroPoietin?The Lancet,2002,359(9301):96-97.
7 Hugo HM,Myriam B,Edwige P,et al.Neuroprotection and angiogenesis:Dual role of erythropoietin in brain ischemia.News Physiol Sci,2000,15(5):225-229.
8 Ghezzi P.Brines M.Erythropoietin as an antiapoptotic.tissueprotective cytokine.Cell Death and Diffentiation,2004,11:S37-44.
9 Socolovsky M.Nam H,Fleming MD,et al.Ineffective erythropoiesis in Stat5a-/-5b-/-mice due to decreased survival of early erythroblasts.Blood,2001,98(12):3261-3273.
10 Socolovsky M,Nam H,Fleming MD,et al.Ineffective erythropoiesis in Stat5a-/-5b-/-mice due to decreased survival of early erythroblasts.Blood,2001,98(12):3261-3273.
11 Zhang F,Wang S,Cao G,et al.Signal transducers and activators of transcription 5 contributes to erythropoietin-mediated neuroprotection against hippocampalneuronal death after transient global cerebral ischemia.Neurobiology of Disease,2007,25(1):45-53.

