角叉菜胶诱导的血栓形成模型的动物差异性比较
王寅
角叉菜胶诱导的血栓形成模型的动物差异性比较
王寅
目的比较不同品系小鼠采用角叉菜胶制备血栓形成模型的差异。方法分别选用昆明(KM) 和ICR两种小鼠进行比较。其中模型组小鼠皮下注射0.2%角叉菜胶40 mg/kg,记录小鼠注射角叉菜胶24 h、48 h和72 h后小鼠黑尾发生率。对照组给予同体积生理盐水。结果造模在2种小鼠均可诱导血栓形成模型,在部分动物的尾部均可见清晰的血栓,但ICR小鼠成模率显著高于KM种小鼠。结论皮下注射角叉菜胶在 2 种动物上均可成功地制备出血栓形成模型,但不同种属的动物成模率可能有所不同,其及机制有待进一步研究。
血栓形成; 动物模型; 动物差异
目前不同品系的大鼠如Wistar和SD 及不同品系的小鼠如KM和ICR用于制备角叉菜胶诱导的尾部血栓模型均有报道,其中用小鼠制备血栓模型,方法更为简便、成本更低廉。搞清不同种属小鼠对角叉菜胶制备血栓模型不同反应性的差异,对于血栓模型研究中实验动物的选择具有重要意义。本研究选取了国内实验采用的昆明种KM小鼠和ICR小鼠进行比较研究。由于血栓的主要客观指标如血液流变学和凝血功能的检测需要大量的血液,而小鼠的血液量较少,难以检测这些指标,故本研究将不比较反映血栓指标的血液流变学和凝血指标,重点研究血栓形成率是否有一定的差异。
1 资料与方法
1.1实验动物 昆明小鼠和ICR小鼠各40只,雄性,体重18-22 g。动物和动物实验设施均由军事医学科学院实验动物中心提供,动物合格证号:SCXK-(军)-2007-004。
1.2药品与试剂 κ-型角叉菜胶(上海北连食品科技有限公司惠赠,批号201045:纯度95.00%)
1.3仪器与器材1 ml注射器
2 方法
2.1造模方法 动物购回给以基础饲料适应7 d,根据体重随机分组,每组20只,分为对照组和模型组。造模前一天晚上适当禁食。各组小鼠皮下注射0.2%角叉菜胶40 mg/kg,对照组小鼠灌皮下予等体积的注射用生理盐水。记录小鼠注射角叉菜胶24 h、48 h和72 h后小鼠黑尾发生率[1~6]。
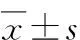
3 结果
3.1一般情况观察 KM和ICR小鼠造模后状态良好,无行为异常。
3.2不同动物的血栓形成情况 于试验的24 h、48 h、72 h时间点测量造模动物尾部的血栓长度。2 种动物均可形成明显的尾部血栓。ICR小鼠形成的血栓均较长,KM小鼠形成的血栓相对较短,ICR小鼠成膜数量均多于KM小鼠。各种动物模型组与正常组比较差异有统计学意义。结果表明2 种动物均能成功地形成血栓模型。结果见表1。
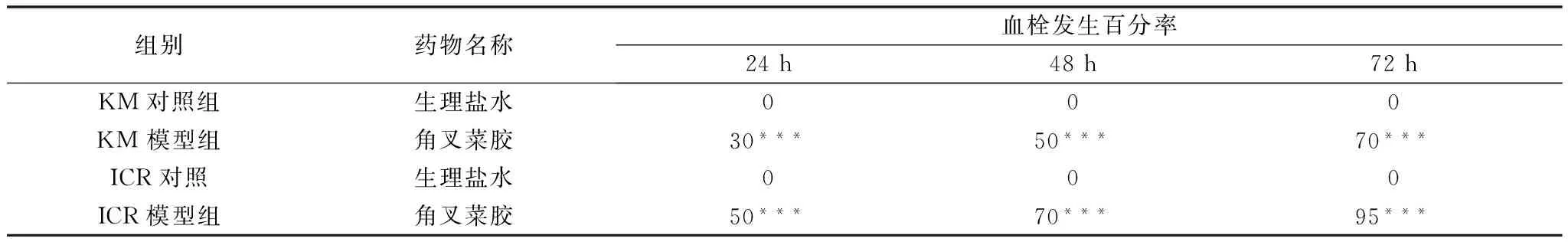
表1 不同动物血栓形成情况(%)
注:***P<0.001 VS control group,**P<0.01 VS control group,*P<0.05 VS control group
4 讨论
角叉菜胶是从海藻中提取的硫酸多糖,可用于制备多种组织炎症模型,是一种简便易行的血栓造模试剂。其机制为炎症损伤血管内皮细胞,在IL-1β作用下,导致炎细胞趋化、浸润,激活外源性凝血系统,造成血栓形成,并在血栓形成后抑制纤溶系统[7]。
角叉菜胶制备尾部血栓形成模型作为一种非手术方法制备的体内血栓模型,可排除手术暴漏血管形成血栓可能造成的人为干扰[8],其方法简便易学、操作简单、重复性好,无需大型仪器和复杂检测手段,目前已经成为抗血栓药物筛选的常用方法。此外,角叉菜胶诱导尾部血栓模型的优点是其形成的血栓不需剖杀动物通过肉眼观察和定量测定,故该模型适用于各类实验室开展抗血栓药物研究。
本研究中所选用KM小鼠、ICR 小鼠小鼠品种。结果显示KM 小鼠和ICR小鼠均能成功地造成血栓形成模型,比较而言ICR小鼠成模率显著高于KM小鼠。梁爱华等[9]的研究也显示在角叉菜胶诱导的尾部血栓模型中,ICR小鼠的成模率高于KM小鼠。限于试验条件,本研究没有对实验动物造模后的血液流变学和凝血指标等进行考察, 推测2种动物造模成功率的差异可能是动物品种差异引起的。其具体机制有待后续进一步研究和观察。
[1] 徐叔云, 卞如濂, 陈修. 药理实验方法学. 北京:人民卫生出版社,2001:1261.
[2] 车薇, 李霞, 梁艳. 大鼠实验性血栓模型的建立及其应用. 中国医院药学杂志,2008, 28(12):1045.
[3] 苏丙凡,张智慧,商亚珍.灯盏花素抑制角叉菜胶诱导小鼠血栓形成. 承德医学院学报,2009, 26(1):8-9.
[4] Hansra P, Moran E L, Fornasier V L. Carrageenan-induced arthritis in the rat. Inflammation,2000, 24(2):141-152.
[5] Bekemeier H. Hirschelmann R. Giessler A J. Carrageenin-induced thrombosis in rats and mice: A model for testing antithrombotic substances. AgentsandActions, 1985, 16(5):446-4511.
[6] Hagimori M, Kamiya S, Ymaguchi Y, et al. Improving frequency of thrombosis by altering blood flow in the carrageenan rat tail thrombosis model. Pharm Res, 2009, 60:320-323.
[7] 魏陵博, 戎冬梅, 吉中强. 角叉菜胶致大鼠尾部血栓形成的机制. 中西医结合心脑血管病杂志, 2008, 6(5):542-543.
[8] 缪红, 程建军, 苏丙凡, 等. 黄芩茎叶总黄酮对角叉菜胶诱发小鼠尾部血栓形成的抑制作用. 承德医学院学报, 2006,17(12):2420.
[9] 梁爱华, 于长安, 李春英, 等. 内毒素与角叉菜胶联合诱导的血栓形成模型的动物差异性比较. 中国中药杂志,2006,31(1):57-61.
ComparativestudyofCarrageenaninducedthrombosisanimalmodelinmice
WANGYin.
DepartmentofPharmacy,TheFifthAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
ObjectiveTo compare the difference between KunMing mice and ICR miced on carrageenan induced tail thrombosis model.MethodsKunMing mice and ICR mice were choosed to compare.Subcutaneous injection of 0.2% carrageenan 40 mg/kg, record black tail incidence of the mouse after injection24 h,48 h and 72 h. The control group was given the same volume of normal saline.ResultsThrombosis model could be induced in the 2 kinds mice, in part, in ICR mice clearly visible thrombus were seen. In addition, in ICR mice model incidence of tail thrombosis was significantly higher than that in KM mice.ConclusionThrombosis model can be successfully induced, by subcutaneous injection of carrageenan in 2 kinds of animal. To discover the mechanism of differ, further research are needed.
Thrombosis; Animal model; Animal differences
450052 郑州大学第五附属医院药剂科

