雷帕霉素对匹罗卡品诱导的癫痫小鼠学习记忆的改善作用
张华丹,谢雅聪,翁 灵,张宇辰,史琼瑶,陈 涛,曾玲晖
(浙江大学城市学院医学院,浙江 杭州 310015)
癫痫是一种常见的神经系统疾病,我国的癫痫患病率为7 ‰,在最近短短20年时间,我国癫痫患者人数已升至1 000 万之多,且每年有将近40 万的新发患者。在这些癫痫患者中,儿童和青少年仍是癫痫高发人群,0~9岁患者占38.5%,10~29岁患者占近40%,且仍有逐年上升趋势。癫痫患者常伴有注意力分散、学习记忆能力减退等认知功能受损的表现,其中学习记忆能力减退是癫痫患者认知障碍中最常见的症状,严重者可影响工作、学习和生活质量,给家庭和社会带来沉重负担。认知功能障碍已成为癫痫防治的重点之一[1-3]。
癫痫致学习记忆减退的机制已有广泛研究,目前认为主要是与兴奋性递质释放后导致神经元死亡有关[4-5]。癫痫发作时可使大脑耗氧量急剧增加,而脑组织几乎无氧和葡萄糖储备,并且脑组织对葡萄糖和氧的利用减少,低血糖、缺氧使神经元内ATP 减少,导致谷氨酸释放增多和γ-氨基丁酸减少,神经元突触后膜抑制作用减弱,神经元过度兴奋,突触后N-甲基-D-天(门)冬氨酸受体激活,引起大量Ca2+流入神经元,激活细胞内一系列病理过程,最终导致神经元死亡[6]。
mTOR(mammalian target of rapamycin)是调控细胞生长增殖和蛋白质合成的重要激酶,通过上游和下游信号转导通路,调控细胞生长增殖、基因的翻译和转录。在神经系统,mTOR信号通路影响神经突触的生长和突触可塑性的形成,在大脑形成和发育、神经突触发生、学习和记忆形成中起重要作用,与记忆形成和巩固有着密切关系[7-8]。近年来雷帕霉素对于学习记忆的作用已有诸多报道,许多研究表明雷帕霉素对一些年龄相关的神经退行性疾病模型有治疗作用,包括阿尔茨海默病、帕金森病以及亨廷顿病[9]。但是对于癫痫所致的学习记忆受损有无作用仅国外有零星报道,且均使用SD大鼠或者C57BL6 小鼠[10-12]。
本研究采用匹罗卡品致痫ICR 小鼠,雷帕霉素分别于致痫前后给药,观察匹罗卡品致痫小鼠学习记忆的改变以及雷帕霉素的作用,并检测神经元死亡和苔藓纤维发芽,初步探讨mTOR 抑制剂雷帕霉素在匹罗卡品致痫ICR 小鼠学习记忆中的作用及可能机制。
1 材料和方法
1.1 仪器与试剂 冰冻切片机(购自Thermo公司,型号:Microm HM525)、Morris 水迷宫恒温水池(淮北正华生物仪器设备有限公司)、MG-3Y 迷宫刺激器(淮北正华生物仪器设备有限公司)、大小鼠旷场(淮北正华生物仪器设备有限公司)。匹罗卡品、氢溴酸东莨菪碱和阿拉伯胶(Sigma 公司,USA);雷帕霉素(LC Laborotary 公司)。其他试剂均为市售分析纯。
1.2 实验动物 周龄为4~5 周的雄性ICR 小鼠160 只,购自上海斯莱克实验动物有限公司(动物许可证号:SYXK(沪)2012-0002)。动物使用严格参照浙江大学动物管理委员会的规定执行。随机将小鼠分为5组,分组如下:①溶剂对照组(n=20);②雷帕霉素对照组(n=20);③溶剂模型组(n=40);④雷帕霉素前给药模型组(n=40);⑤雷帕霉素后给药模型组(n=40)。其中②与④组在PILO 致痫前腹腔注射3mg/kg 雷帕霉素3 d,1次/d,①、③、⑤组同时注射等体积溶剂;第4天腹腔注射PILO 诱发急性癫痫发作,发作4 级及以上者用于实验;癫痫持续发作2 h 后,用安定终止。急性癫痫发作后24 h ⑤组注射雷帕霉素3 d,1次/d,同时其它组注射等体积溶剂。其中每组10 只用于Fluo-Jade B 染色,其余用于行为学和Timm染色。
1.3 急性癫痫的诱发 小鼠先腹腔注射氢溴酸东莨菪碱0.5mg/kg,用以拮抗匹罗卡品的外周胆碱能反应,30min 后腹腔注射匹罗卡品100mg/kg,然后密切观察小鼠的行为学变化,发作4 级及以上者用于实验。癫痫发作若未达到4 级,则30min 后补加25%原始剂量的匹罗卡品,使其发作达到4 级或以上,若补加3次以后,癫痫发作仍未达到4 级者,则剔除实验。
癫痫的分级参照1972年Racine[13]制定的标准:1 级:静止不动伴随有嘴部/面部运动;2级:点头及落水狗样抖动;3 级:前肢阵挛;4 级:站立及双侧前肢阵挛;5 级:持续站立及跌倒;6 级:狂奔及尖叫。
1.4 Morris 水迷宫 PILO 致痫7~10 d 后进行水迷宫测试[14]。将小鼠置于站台上,随后将小鼠随机从不同象限面壁置入池内,小鼠登上站台10 s 后终止记录。如此依次将小鼠置入游泳池,每天4次,每次问隔1 h,定位航行训练4 d,第5天测量平台逃避潜伏期。
1.5 Y 迷宫试验 参照Feng 等的方法,采用随机不休息法[15]。对小鼠所在支臂与另一支臂通电,动物在电击下逃窜至灯光区后再保持10 s 为一次测试。记忆保持测试:学习测试24 h、48 h、1 周、30 d 后,以同样的方法测试。正确反应次数定为A,以A/10 表示记忆保持能力。
1.6 旷场实验 抓住小鼠尾根部三分之一处提起,放入旷场实验箱正中格(50× 50× 50 cm3),记录3 min 内小鼠穿格次数。
1.7 Fluro-Jade B(FJB)染色 PILO 致痫后第7天,将小鼠麻醉后,灌流取脑,做冰冻切片。切片用PBS 冲洗,然后依次在1%NaOH/80%酒精溶液浸泡5 min,70%酒精和蒸馏水里各浸泡2 min,0.06%高锰酸钾溶液浸染10 min,水洗后,置于0.001%FJB 溶液中浸染20 min。封片后在显微镜下观察。
1.8 Timm 染色 PILO 致痫后第30天,小鼠经麻醉后,用NaS2灌流取脑。脑组织连续切片后,在含银的缓冲液中避光孵育60~80 min,切片水洗10 min 后,封片,在显微镜下观测齿状回分子细胞层苔藓纤维发芽状况。苔藓纤维出芽评分标准[16]:0 分:未见Timm 颗粒;1 分:偶见散在的片状分布的Timm 颗粒;2 分:较多片状分布的Timm 颗粒;3 分:Timm 颗粒接近连续分布;4 分:浓密的Timm 颗粒带,连续或接近连续分布;5 分:浓密、层带状Timm 颗粒连续分布。
2 结果
2.1 匹罗卡品致痫ICR 小鼠的表现 在匹罗卡品注射后5~15 min,小鼠开始出现流诞、立毛、颤抖,同时或先后出现刻板行为如凝视不动、吸鼻、阻嚼或竖尾、湿狗样震颤、反复头颈上仰,随后出现面肌痉挛、节律性点头,40~50 min 时出现反复单侧或双侧前肢阵挛、伴直立、跌倒或翻转,部分动物出现惊跳、乱窜、四肢强直-阵挛发作,开始发作尚不频繁,随着时间的推移,发作频率增高。雷帕霉素前给药组与溶剂组相比,致痫成功率和死亡率无明显差别(分别为75% vs 68% 和25% vs 32%),并且在潜伏期、发作级别、持续时间上并无明显差异。
2.2 雷帕霉素可缩短PILO 致痫小鼠Morris 水迷宫的平台逃避潜伏期 Morris 水迷宫中小鼠平台逃避潜伏期的结果见图1。溶剂对照组及雷帕霉素对照组间无明显区别(以下所有实验中溶剂对照组与雷帕霉素对照组间均无显著性差异,因此将其合并为对照组),但模型组小鼠的平台逃避潜伏期比对照组显著延长(38.06±19.58 vs 21.27±19.47 s,P<0.05),而雷帕霉素致痫前给药组(16.20±13.15 s,P<0.001)或后给药组(21.00±17.25 s,P<0.05)均较模型组明显缩短。
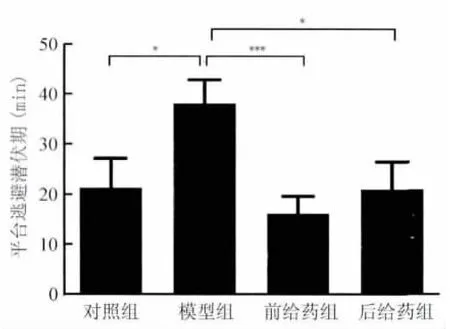
图1 雷帕霉素显著逆转匹罗卡品所致平台逃避潜伏期延长Fig.1 Treatment of rapamycin reverses PILOinduced prolongation of avoiding latency
2.3 雷帕霉素增加PILO 致痫小鼠Y 迷宫的正确反应次数 Y 迷宫实验结果如图2。与对照组相比,癫痫模型小鼠在Y 迷宫中的正确反应次数显著减少(4.71±2.42 vs 8.00±2.83,P<0.01)。前给药组小鼠比模型组在Y 迷宫中的正确反应次数显著增加(7.13±2.23 vs 4.71±2.42,P<0.01),但后给药组与模型组的正确反应次数相比并无显著性差异(5.58±2.27 vs 4.71±2.42,P >0.05)。

图2 雷帕霉素前给药显著逆转匹罗卡品所致正确反映次数减少Fig.2 Pre-treatment of rapamycin reverses PILO-induced decrease in number of correct reaction
2.4 雷帕霉素增加PILO 致痫小鼠旷场实验中的正确穿格次数 旷场实验实验结果见图3。与对照组相比,模型组癫痫小鼠正确穿格次数明显减少(121.58±37.32 vs 96.05±37.32,P<0.05),前给药组及后给药组的正确穿格次数与模型组相比明显增加(127.31±27.51 vs 96.05±37.32,P<0.01;128.33±23.49 vs 96.05±37.32,P<0.001)。

图3 雷帕霉素显著逆转匹罗卡品所致穿格次数下降Fig.3 Treatment of rapamycin reverses PILOinduced decrease in number of crossing
2.5 PILO 致痫ICR 小鼠未见明显神经元死亡为检测PILO 致痫后ICR 小鼠海马神经元有无死亡,在致痫后7 d 对小鼠灌流取脑行FJB染色显示,结果显示各组小鼠脑组织切片海马区均未见明显的神经元死亡(图4,显示海马CA1 区)。

图4 各组小鼠均未见明显神经元死亡Fig.4 No apparent neuronal death is detected in all groups
2.6 PILO 致痫ICR 小鼠出现明显苔藓纤维发芽 小鼠经行为学检测后在,在致痫后30 d 进行Timm 染色,结果见图5。模型组与对照组相比,苔藓纤维发芽明显(3.42±0.51 vs 0.25±0.45,P<0.001),前后给药组的苔藓纤维发芽情况与模型组相比均明显减弱(1.33±0.65 vs 3.42±0.51,P<0.001;2.50±0.52 vs 3.42±0.51,P<0.001)。
3 讨论
本研究采用匹罗卡品致痫ICR 小鼠模型,观察到:①PILO 致痫后ICR 小鼠虽然并未出现明显神经元细胞死亡,但出现明显的学习记忆损伤;②致痫前后给予雷帕霉素治疗均能显著改善PILO 所致的学习记忆障碍,且预防性给药效果较治疗性效果好;③雷帕霉素能明显抑制PILO 致痫后苔藓纤维发芽。这提示雷帕霉素对匹罗卡品致痫导致的ICR 小鼠学习记忆功能受损有保护作用。

图5 雷帕霉素显著逆转匹罗卡品所致苔藓纤维发芽Fig.5 Treatment of rapamycin reverses PILOinduced mossy fiber sprouting
我们以往的研究以及其他的相关报道已经证实,雷帕霉素可以减少初次脑损伤后自发性癫痫的发作,因此,雷帕霉素对致痫小鼠学习记忆的保护作用可能与减少自发性癫痫的发作相关[20-23]。在本研究中为降低该可能性,学习记忆的相关实验均选择在致痫后7~10 d 内完成,此时自发性癫痫的发作频率低,且持续时间短,从而自发性癫痫的发作对学习记忆的影响较少。因此,我们推断雷帕霉素对致痫小鼠学习记忆的改善作用与其减少自发性癫痫无关。雷帕霉素对PILO 癫痫模型中学习记忆的改善作用有待进一步探讨。最近有报道表明,癫痫导致的mTOR 信号通路激活可能是造成认知障碍的潜在机制,而雷帕霉素可通过抑制神经元及小胶质细胞中mTOR 的活性,从而改善癫痫小鼠的记忆学习能力[17-19]。
本研究观察到ICR 小鼠经匹罗卡品致痫2 h 后,FJB 染色未观测到明显的神经元死亡,但可见苔藓纤维发芽,雷帕霉素致痫前后给药均能显著抑制匹罗卡品致痫小鼠的苔藓纤维发芽,与我们以往的研究结果相吻合[20-21]。有报道表明,PILO 致痫后可见海马神经元死亡[22],主要机理为颞叶癫痫导致神经元和星形胶质细胞中谷氨酸浓度的病理性升高,这种兴奋性氨基酸的水平升高会介导和增强氧化应激反应,而长时间接触谷氨酸能使神经元死亡[23-25]。本实验中并未见神经元死亡,可能与小鼠品系及癫痫发作时间长短有关。苔藓纤维发芽是自发性癫痫发生的病例改变之一,本研究中观察到雷帕霉素在致痫前后均能减少苔藓纤维的发芽,目前正在该模型上对其防治自发性癫痫的作用进行检测。
总之,本研究发现雷帕霉素对于匹罗卡品诱导的癫痫小鼠的学习记忆受损有明显改善,从而为其临床应用提供理论依据。雷帕霉素改善癫痫小鼠的学习记忆的机制与mTOR 通路抑制有关,但确切机制还需进一步探讨。
[1]MEADOR K J.Cognitive outcomes and predictive factors in epilepsy [J].Neurology,2002,58(8 Suppl 5):S21-26.
[2]HOLMES G L.Effects of early seizures on later behavior and epileptogenicity [J].Ment Retard Dev Disabil Res Rev,2004,10(2):101-105.
[3]BYARD R W,BLUMBERGS P,RUTTY G,et al.Lack of evidence for a causal relationship between hypoxic-ischemic encephalopathy and subdural hemorrhage in fetal life,infancy,and early childhood[J].Pediatr Dev Pathol,2007,10(5):348-358.
[4]MENG F J,GUO J,SONG B,et al.Competitive binding of post synaptic density 95 and Ca2 +/ca lmodulin dependent protein kinase II to N-m ethy-l D-aspartate recepto r subun it 2B in rat brain[J].Acta Pharm aco l Sin,2004,25(2):176-180.
[5]HOLMES G L,YANG Y,LIU Z,et al.Seizureinduced memory impairment is reduced by choline supplementation before or after status epilepticus[J].Epilepsy Res,2002,48(1-2):3-13.
[6]WASTERLAIN C G,FUJIKAWA D G,PENIX L R,et al.Pathophysiological mechanisms of brain damage from status epilepticus [J].Epilepsia,1993,34(S1):S37-S53.
[7]ZENG L H,RENSING N R,WONG M.The mammalian target of rapamycin signaling pathway mediates epileptogenesis in a model of temporal lobe epilepsy[J].J Neurosci,2009,229(21):6964-6972.
[8]WONG M.Mammalian target of rapamycin(mTOR)inhibition as a potential antiepileptogenic therapy:From tuberous sclerosis to common acquired epilepsies[J].Epilepsia,2010,51(1):27-36.
[9]LU Zhijie,WANG Wenmin(卢志杰,王文敏).Research advances in Rapamycin against neurodegenerative disease[J].Drug Eval Res(药物 评 价 研 究),2012,35 (2):281-284.(in Chinese)
[10]ERDO ˇGAN F,GÖLGELI A,ARMAN F,et al.The effects of pentylenetetrazole-induced status epilepticus on behavior,emotional memory,and learning in rats[J].Epilepsy Beh,2004,5(3):388-393.
[11]HUANG W,ZHU P J,ZHANG S,et al.mTORC2 controls actin polymerization required for consolidation of long-term memory [J].Nat Neurosci,2013,16(4):441-448.
[12]FELICIANO D M,HARTMAN N W,LIN T V,et al.A circuitry and biochemical basis for Tuberous Sclerosis symptoms:From Epilepsy to Neurocognitive deficits[J].Int J Dev Neurosci,2013,pii:S0736-5748(13)00035-X.
[13]RACINE R J.Modification of seizure activity by electrical stimulation:II.Motor Seizure [J].Electroencephalogr Clin Neurophysiol,1972,32(30):255-310.
[14]SHARMA S,RAKOCZY S,BROWN-BORG H.Assessment of spatial memory in mice [J].Life Sci,2010,87(17):521-536.
[15]FENG Ting,LI Feng,SONG Yuehan,et al(冯婷,李 峰,宋月晗,等).Y-maze Improving in the Power of Learning and Memory Research[J].Prog Mod Biomed(现代生物医学进展),2005,14(1):12-14.(in Chinese)
[16]MELLO L E,CAVALHEIRO E A,TAN A M,et al.Circuit mechanisms of seizures in the pilocarpine model of chronic epilepsy:cell loss and mossy fiber sprouting [J].Epilepsia,1993,34(6):985-995.
[17]BREWSTER A L,LUGO J N,PATIL V V,et al.Rapamycin Reverses Status Epilepticus-induced Memory Deficits and Dendritic Damage[J].PloS one,2013,8(3):e57808.
[18]TISCHMEYER W,SCHICKNICK H,KRAUS M,et al.Rapamycin-sensitive signalling in long ‐ term consolidation of auditory cortex ‐ dependent memory[J].Eur J Neurosci,2003,18(4):942-950.
[19]MAJUMDER S,CACCAMO A,MEDINA D X,et al.Lifelong rapamycin administration ameliorates age‐dependent cognitive deficits by reducing IL‐1β and enhancing NMDA signaling[J].Aging Cell,2012,11(2):326-335.
[20]CHEN L L,FENG H F,MAO X X,et al.One hour of pilocarpine-induced status epilepticus is sufficient to develop chronic epilepsy in mice,and is associated with mossy fiber sprouting but not neuronal death[J].Neurosci Bull,2013,29(3):295-302.
[21]GUO D,ZENG L,BRODY DL,et al.Rapamycin Attenuates the Development of Posttraumatic Epilepsy in a Mouse Model of Traumatic Brain Injury[J].PloS one,2013,8(5):e64078.
[22]FUJIKAWA D G.The temporal evolution of neuronal damage from pilocarpine-induced status epilepticus[J].Brain Res,1996,725(1):11-22.
[23]BENGZON J,MOHAPEL P,EKDAHL CT,et al.Neuronal apoptosis after brief and prolonged seizures[J].Prog Brain Res,2002,135:111-119.
[24]ZHANG L X,SMITH M A,LI X L,et al.Apoptosis of hippocampal neurons after amygdala kindled seizures[J].Brain Res Mol Brain Res,1998,55(2):198-208.
[25]MANDIC A,VIKTORSSON K,STRANDBERG L,et al.Calpaln-mediated Bid eleavage and calpainindependent Bak modulation:T wo separate pathways in cisplatin-nduced apoptosis [J].Mol Cell Biol,2002,22(9):3003-3013.
——雷帕霉素

