Toll样受体3信号通路在人类病毒性心肌炎心肌细胞凋亡及炎症反应中的作用*
刘 婧, 刘水平, 古力娜尔·库尔班, 成建定
(1新疆医科大学病理学教研室,新疆 乌鲁木齐 830054; 2中山大学中山医学院法医病理学教研室,广东 广州510080)
Toll样受体3信号通路在人类病毒性心肌炎心肌细胞凋亡及炎症反应中的作用*
刘 婧1▲, 刘水平2▲, 古力娜尔·库尔班1△, 成建定2△
(1新疆医科大学病理学教研室,新疆 乌鲁木齐 830054;2中山大学中山医学院法医病理学教研室,广东 广州510080)
目的研究Toll样受体3(TLR3)信号转导通路与人类病毒性心肌炎(VMC)炎症反应及细胞凋亡的关系。方法采用免疫组化 SP 法分别检测TLR3、干扰素β TIR结构域衔接蛋白(TRIF)、核因子 κB(NF-κB)及半胱氨酸天冬氨酸蛋白酶 3(caspase-3)在心肌组织中的变化, 原位末端标记法(TUNEL)检测心肌细胞凋亡情况,比较VMC组及正常对照组组间的差异。结果与对照组比较,VMC组心肌组织中TLR3、TRIF、NF-κB及caspase-3蛋白表达及细胞凋亡水平明显增高,差异有统计学意义(P<0.05), 并且TLR3和TRIF、TLR3和NF-κB、TRIF和NF-κB、NF-κB和caspase-3之间的表达均呈正相关,细胞凋亡指数的变化趋势与caspase-3一致。结论通过TLR3信号通路介导的炎症反应和细胞凋亡在VMC发生、发展过程中起着重要作用,抑制其活化有可能成为治疗VMC的一个潜在的、有价值的靶位。
病毒性心肌炎; Toll样受体3; 炎症; 细胞凋亡
病毒性心肌炎(viral myocarditis, VMC)为病毒感染引起的心肌局灶性或弥散性炎症病变,近年来由病毒性心肌炎所致的心源性猝死有上升的趋势,已广泛地引起人们的高度重视。VMC的发病机制尚未完全清楚,通常认为其发生与病毒直接损伤心肌和免疫介导的病理损伤有关[1],最近研究发现,细胞凋亡在VMC发生、发展过程中也起着重要作用[2-3]。Toll样受体3(Toll-like receptor 3,TLR3)在抗病毒免疫中的作用日益受到关注。TLR3能识别病毒双链RNA(double-stranded RNA, dsRNA),通过刺激信号的级联反应激活核因子 κB (nuclear factor kappa B, NF-κB),引起一系列免疫应答,另外它还可以启动细胞凋亡的信号转导,这可能是VMC发病的重要机制之一。
材 料 和 方 法
1材料
1.1组织标本 选择中山大学法医鉴定中心2011年1月~2012年4月尸检案例的人体心脏标本共40例,所有案例均签订知情同意书,全部标本均经4%多聚甲醛固定,石蜡包埋。本实验所有案例都是中山大学法医鉴定中心多位资深法医病理专家结合死者生前发病症状和心肌组织病理学特征并排除其它疾病做出的诊断,根据Dallas标准,20例为明确诊断心肌炎组(VMC组),显微镜下可见心室肌明显心肌细胞坏死和(或)变性,间质见大量以淋巴细胞、单核细胞为主的炎症细胞浸润,伴或不伴间质纤维化;20例非心肌炎病例为正常对照组,均为颅脑损伤死者,无心脏病史,死前无VMC相关临床表现。
1.2主要试剂 兔抗人TLR3多克隆抗体(Abgent),兔抗人caspase-3多克隆抗体(北京中杉金桥生物技术有限公司),兔抗人干扰素β的含TIR结构域的衔接蛋白(TIR domain-containing adaptor inducing interferon β,TRIF)多克隆抗体(Abcam),鼠抗人NF-κB p65单克隆抗体(Santa Cruz),增强型(Polink-1)检测试剂盒、EDTA修复液、DAB显色剂和磷酸盐缓冲液(PBS)等(北京中杉金桥生物技术有限公司),TUNEL检测试剂盒(Roche)。
2方法
2.1HE染色 参照Rezkalla等[4]方法,计算心肌病变(炎症细胞浸润及坏死)积分,即每张切片随机取5个高倍视野(400倍),计算每个视野中炎症细胞浸润及坏死区域面积与整个视野的面积之比:无病变计0分,病变面积<25%计1分,25%~50%计2分,50%~75%计3分,>75%计4分。
2.2免疫组织化学染色 应用SP法,切片常规脱蜡水化,EDTA修复液(pH 8.0)高压抗原修复,3%H2O2孵育组织切片10 min,阻断内源性过氧化物酶活性。滴加Ⅰ抗(以PBS作为阴性对照),4 ℃冰箱过夜。次日滴加相应Ⅱ抗(各步间隔PBS洗涤10 min),DAB显色,苏木素复染,脱水、透明、封片。结果判定:用光学显微镜检查显色反应。每张切片随机取5个高倍视野(400倍),计数TLR3、TRIF、NF-κB和caspase-3阳性细胞,取其平均值作为阳性细胞数,并分析四者之间的相关性。
2.3TUNEL法检测心肌细胞凋亡 严格按试剂说明书进行操作,同时设立阳性对照与阴性对照。切片常规脱蜡水化,置于盛有枸橼酸缓冲液(pH 6.0)的抗原修复盒内,750 W(高)微波辐射1 min,玻片浸于0.1 mol/L TBS室温孵育30 min。滴加TUNEL反应混合溶液,在湿盒中37 ℃孵育1 h,3% H2O2室温孵育组织切片10 min,以阻断内源性过氧化物酶活性。擦干组织周围的水分,加入50 μL转化剂-POD,37 ℃孵育30 min,各步间隔PBS洗涤10 min×3次,DAB显色,苏木素复染,镜下观察。正常细胞核呈蓝色,而凋亡细胞核呈棕黄色。每张切片随机选取5个高倍视野(400倍),分别计算每个视野细胞核数及凋亡阳性细胞核数,取均值,根据Narula方法计算出凋亡指数(apoptotic index, AI): AI(%)=凋亡阳性的细胞核数/总计数的细胞核×100%。
3统计学处理
采用SPSS 17.0对数据进行统计处理,数据以均数±标准差 (mean±SD)表示,资料分析采用两独立样本t检验,相关性分析采用Pearson法。以P<0.05为差异有统计学意义。
结 果
1光镜下心肌病理改变
VMC组心肌组织中可见大量以淋巴细胞、单核细胞为主的炎症细胞浸润,心肌细胞肿胀,部分心肌纤维可见波浪状改变甚至断裂,并有散在灶性变性、坏死;对照组心肌细胞形态正常,胞核完整,未见炎症细胞浸润,心肌纤维排列整齐,见图1。VMC组心肌病变积分为(2.5900±0.4564),明显高于对照组(0),差异有统计学意义(P<0.05)。
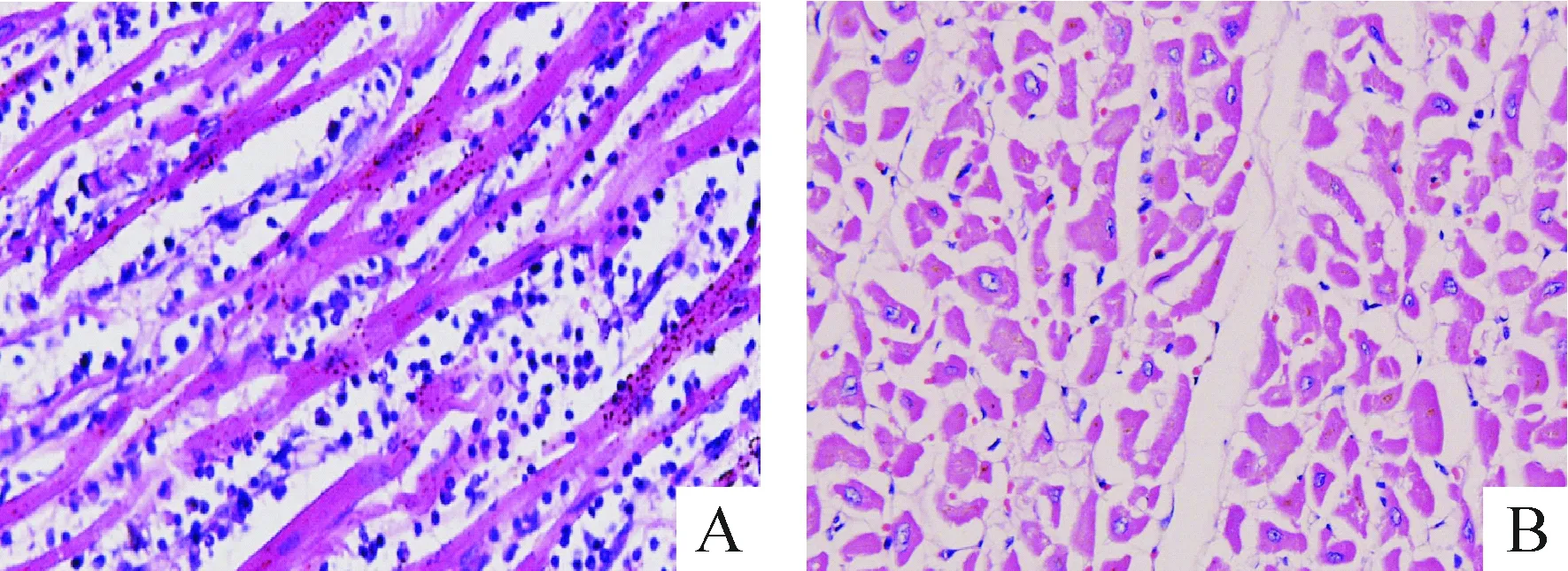
Figure 1. HE staining of myocardium (×200). A:VMC group; B:control group.
图1心肌HE染色
2免疫组化检测结果
免疫染色阳性产物为黄色或棕黄色颗粒状,大多数分布在炎症病灶内浸润淋巴细胞、单核细胞及周围的心肌细胞内;对照组为散在分布的弱阳性或阴性表达,见图2。与对照组相比,VMC组心肌组织中TLR3、TRIF、NF-κB及caspase-3蛋白的表达明显升高并具有一定的相关性,差异有统计学意义,见图3、表1。

Figure 2. The expression of TLR3 (A,B),TRIF(C,D),NF-κB(E,F)and caspase-3 (G,H) in myocardial tissues (immunohistochemical staining,×400).A,C,E,G:VMC group;B,D,F,H:control group.
图2TLR3、TRIF、NF-κB及caspase-3在心肌组织中的表达

Figure 3. TLR3, TRIF, NF-κB and caspase-3 protein expression in myocardium detected by immunohistochemical staining. Mean±SD.n=20.*P<0.05vscontrol.
图3TLR3、TRIF、NF-κB及caspase-3在心肌组织中的表达
表1VMC组心肌组织TLR3、TRIF、NF-κB、caspase-3和细胞凋亡指数的相关性分析
Table 1. Correlation of TLR3, TRIF, NF-κB, caspase-3 and apoptotic index (AI) in myocardium of VMC group

IndexCorrelationcoefficient(r)TLR3TRIFNF⁃κBCaspase⁃3AITLR310.551∗0.490∗0.0980.178TRIF0.551∗10.674∗0.1630.223NF⁃κB0.490∗0.674∗10.517∗0.504∗Caspase⁃30.0980.1630.517∗10.700∗AI0.1780.2230.504∗0.700∗1
*P<0.05.
3VMC组心肌细胞凋亡TUNEL法检测结果
VMC组TUNEL阳性标记位于细胞核,表现为核固缩呈圆形或椭圆形棕黄色团块,多分布在心内膜、心外膜下及炎症灶周围,还可见呈阳性染色的血管内皮细胞及浸润淋巴细胞,见图4。凋亡指数分析为(12.6475±3.5975)%,与NF-κB、caspase-3的表达呈正相关,见表1。

Figure 4. Apoptosis in myocardium (TUNEL,×400).A:VMC group; B:control group.
图4心肌组织中凋亡细胞检测
讨 论
Toll样受体(Toll-like receptors,TLRs)是近年来病毒感染疾病研究中最具有意义的发现,作为连接天然免疫和获得性免疫的桥梁,它是机体维持自身稳定的一条重要调控途径。dsRNA是病毒复制过程中普遍存在的中间产物,TLR3与dsRNA结合后通过上调干扰素抑制病毒复制,在宿主抗病毒免疫反应中发挥重要作用[5]。一项临床研究中,VMC患者活检证实TLR3基因呈多态性,TLR3基因部分位点的突变可能会减弱宿主天然免疫反应,增加人群对病毒的易感性和心肌病变的风险[6]。TLR3与其它TLRs信号转导的不同之处在于不依赖转接蛋白髓样分化因子88(myeloid differentiation factor 88,MyD88),而是依赖能诱导产生TRIF,即所谓的TRIF途径。有研究发现,对TRIF基因进行化学诱导突变,会引起TLR3信号转导通路的缺陷[7]。体外实验结果提示TRIF在抑制病毒复制过程中发挥着极其重要的作用[8]。与野生型小鼠相比,敲除TRIF基因的小鼠心肌柯萨奇病毒B3(coxsackie virus B3,CVB3)的复制量和心肌损伤程度较高[9]。
TLR3识别病原体后诱导细胞因子释放介导炎症反应、诱导I型干扰素释放介导抗病毒天然免疫,另外它还以一种极端的方式保护宿主,即诱导细胞凋亡。TLR3与TRIF结合后,通过肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6, TRAF6) N端的结合域,直接导致NF-κB的激活,通过Fas相关死亡结构域(Fas-associated death domain, FADD),活化caspase信号转导途径,最终导致细胞凋亡的发生[10]。但最近有研究显示TLR3活化caspase信号转导途径似乎不是严格依赖于FADD[11]。在已知的 5 个含有TIR结构域的接头蛋白(TIR domain-containing adaptor protein, TIRAP)中,TRIF 是惟一一个可以介导细胞凋亡信号途径的接头蛋白。虽然 TRIF 两个结构域均可以介导NF-κB活化,但只有RIP同型相互作用结构域(RIP homotypic interaction motif, RHIM)能诱导细胞凋亡。在RHIM敲除或基因突变的小鼠中,TRIF 介导的NF-κB活化程度低于野生型的 50%,而细胞凋亡现象完全消失[12]。应用NF-κB阻断剂可阻断心肌炎进展,保护心肌细胞[13]。Caspase-3是哺乳动物细胞凋亡中的关键酶,是细胞凋亡蛋白酶级联反应的必经之路。有实验证明敲除caspase-3基因小鼠的生存率可显著提高[14]。
上述研究多数停留在动物实验阶段,本实验应用免疫组化SP法及TUNEL法以4%多聚甲醛固定后的心肌为标本,对VMC所致猝死者心肌组织中的TLR3信号转导通路与VMC做进一步的研究和探讨。本研究发现,与对照组相比,VMC组心肌组织中TLR3、TRIF及NF-κB蛋白的表达明显升高,差异有统计学意义,并且3种蛋白的表达水平呈正相关。VMC组心肌组织中caspase-3蛋白表达显著升高,并与凋亡指数呈显著正相关,这提示病毒性心肌炎中caspase-3的激活促进心肌细胞的凋亡,而且,作为NF-κB的下游信号分子,caspase-3的活化可能进一步说明了TLR3和NF-κB信号转导通路存在于病毒性心肌炎中。Toll样受体家族成员之一的TLR3可能做为识别病毒的配体,通过TLR3、NF-κB信号转导通路在病毒性心肌炎心肌细胞的凋亡和炎症反应中起着重要的作用。
[1] 陈志坚, 廖玉华, 唐省三, 等. BALB/c小鼠巨细胞病毒性心肌炎模型的特征[J]. 中国病理生理杂志, 2008, 24(3): 466-469.
[2] Clarke P, Tyler KL. Apoptosis in animal models of virus-induced disease[J]. Nat Rev Microbiol, 2009, 7(2): 144-155.
[3] 刘红云, 唐省三, 黄天芳, 等. 单纯疱疹病毒Ⅳ型心肌炎心肌细胞凋亡的研究[J]. 中国病理生理杂志, 2006, 22(3): 600-601,604.
[4] Rezkalla S, Kloner RA, Khatib G, et al. Beneficial effects of captopril in acute coxsackievirus B3 murine myocarditis [J]. Circulation, 1990, 81(3): 1039-1046.
[5] Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat fImmunol, 2010, 11(5): 373-384.
[6] Gorbea C, Makar KA, Pauschinger M, et al. A role for Toll-like receptor 3 variants in host susceptibility to enteroviral myocarditis and dilated cardiomyopathy[J]. J Biol Chem, 2010, 285(30): 23208-23223.
[7] Hoebe K, Du X, Georgel P, et al. Identification ofLps2 as a key transducer of MyD88-independent TIR signaling[J].Nature, 2003, 424(6950): 743-748.
[8] Riad A, Westermann D, Zietsch C, et al. TRIF is a critical survival factor in viral cardiomyopathy[J]. J Immunol, 2011, 186(4): 2561-2570.
[9] Abston ED, Coronado MJ, Bucek A, et al. Th2 regulation of viral myocarditis in mice: different roles for TLR3 versus TRIF in progression to chronic disease[J]. Clin Dev Immunol, 2012, 2012: 129486.
[10] DeBiasi RL, Robinson BA, Leser JS, et al. Critical role for death-receptor mediated apoptotic signaling in viral myocarditis[J]. J Card Fail, 2010, 16(11): 901-910.
[11] Estornes Y, Toscano F, Virard F,et al. dsRNA induces apoptosis through an atypical death complex associating TLR3 to caspase-8[J]. Cell Death Differ, 2012, 19(9): 1482-1494.
[12] Kaiser WJ, Offermann MK.Apoptosis induced by the Toll-like receptor adaptor TRIF is dependent on its receptor interacting protein homotypic interaction motif[J]. J Immunol, 2005, 174(8): 4942-4952.
[13] Ding Y,Qiu L,Zhao G,et al. Influence of cinnamaldehyde on viral myocarditis in mice[J]. Am J Med Sci,2010,340(2):114-120.
[14] DeBiasi RL, Robinson BA, Sherry B, et al. Caspase inhibition protects against reovirus-induced myocardial injuryinvitroandinvivo[J]. J Virol, 2004, 78(20): 11040-11050.
Toll-likereceptor3signalingpathwayplaysanimportantroleincardiomyocyteapoptosisandinflammatoryresponseinhumanviralmyocarditis
LIU Jing1, LIU Shui-ping2, Gulinar KUERBAN1, CHENG Jian-ding2
(1DepartmentofPathology,XinjiangMedicalUniversity,Wulumuqi830054,China;2DepartmentofForensicPathology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:gulnark@126.com;jdcheng2001@yahoo.com.cn)
AIM: To investigate the role of the signaling pathway mediated by Toll-like receptor 3 (TLR3) in cardiomyocyte apoptosis and inflammatory response in human viral myocarditis (VMC).METHODSThe expression of TLR3, TIR domain-containing adaptor inducing IFN-β(TRIF), NF-κB and casepase-3 in myocardial tissues was examined by the method of immunohistochemistry with SP staining, and the apoptosis of cardiomyocytes was detected by terminal deoxynucleotidyl transferase (TdT)-mediated dUTP nick end labeling (TUNEL). The differences between VMC and control groups were analyzed.RESULTSCompared with control group, the expression of TLR3, TRIF, NF-κB and casepase-3, and the apoptotic index in VMC group increased remarkably (P<0.05). The positive correlations between TLR3 and TRIF, between TLR3 and NF-κB, between TRIF and NF-κB, and between NF-κB and caspase-3 were observed. The change of the apoptotic index was in accordance with that of caspase-3.CONCLUSIONInflammatory response and apoptosis mediated by TLR3 play an important role in the genesis and development of viral myocarditis.
Viral myocarditis; Toll-like receptor 3; Inflammation; Apoptosis
R542.21
A
1000- 4718(2013)03- 0404- 04
2012- 10- 23
2013- 01- 04
新疆维吾尔自治区自然科学基金资助项目(No. 2011211A047)
△通讯作者 古力娜尔·库尔班 Tel: 0991-4361085; E-mail: gulnark@126.com; 成建定 Tel: 020-87330704; E-mail: jdcheng2001@yahoo.com.cn
▲并列第1作者
10.3969/j.issn.1000- 4718.2013.03.004

