植物类胡萝卜素生物合成和积累的光调控
彭建宗, 韦程勇, 陈碧韶, 王小菁
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631)
植物类胡萝卜素生物合成和积累的光调控
彭建宗*, 韦程勇, 陈碧韶, 王小菁
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631)
在介绍类胡萝卜的生物合成途径及调控的基础上,结合作者的工作,研究不同LED光质对采后辣椒果实中类胡萝卜素总量以及色角均有不同的影响,为建立辣椒提前采收、LED光源人工增色的技术提供理论依据.
类胡萝卜素; 辣椒; 光; 发光二极管
类胡萝卜素是自然界中存在最广泛的色素类群,在成熟的叶绿体中,类胡萝卜素是光系统的组分,担负光捕获和高光下光氧化的保护功能[1-2].在有色体中,类胡萝卜素所表现出来的色彩能吸引动物传粉和种子的传播[3].类胡萝卜素还是人类食物中重要的营养物质,具有增强人体免疫力、预防心脑血管疾病以及防癌和抗癌等功能[3-4].揭示植物类胡萝卜素生物合成的调控规律,有利于建立提高果蔬类胡萝卜素含量和品质的栽培和加工技术.
1 类胡萝卜素的生物合成途径
类胡萝卜素生物合成的基本途径已被阐明,但是在不同物种中类胡萝卜素的生物合成存在多样性,主要表现在对碳骨架不同的修饰,如末端基团、多烯链、甲基基团或分子重排等,从而导致不同物种产生的类胡萝卜素在结构上可能具有很大的差异.
在植物中,类胡萝卜素从头合成是从C5前体异戊烯二磷酸(IPP,isopentenyl diphosphate)以及甲烯丙基焦磷酸(DMAPP,dimethylallyl diphosphate) 开始的,这2个前体物质主要来自于MEP途径(plastidial meth-ylerythritol 4-phosphate pathway)[5].3分子的IPP和1分子的DMAPP缩合生成1分子的C20化合物牻牛儿牻牛儿焦磷酸(GGPP,geranylgeranyl diphosphate),这一步反应由GGPP合酶催化.2分子的GGPP尾对尾缩合成1分子的八氢番茄红素 (15-cis-phytoene),这是生成的第一个类胡萝卜素,该反应由八氢番茄红素合酶(PSY,phytoene synthase)所催化(Misawa, 1994).接下来无色的八氢番茄红素转化为亮红色的番茄红素 (lycopene),这是所产生的第一个有色类胡萝卜素.番茄红素的产生分别由PDS(Phytoene Desaturase), Z-ISO(ζ-carotene isomerase),ZDS(ζ-carotene desaturase) 和 CRTISO(carotenoid isomerase)4个酶来催化4步去饱和反应.
番茄红素在合成途径中处于一个分枝点的位置,接下来将朝2个不同的方向发展.番茄红素作为LYCB(lycopene-cyclase)和 LYCE(lycopene-cyclase) 2个不同酶的底物.这2个酶均能使线型的骨架末端环化,从而产生末端的紫罗酮环,但这2种酶催化产生的环在结构上是不同的.在LYCB催化下,番茄红素上生成1个β-环从而产生了γ-胡萝卜素(γ-carotene),还可以继续在另一端生成第二个β-环,从而产生橙色的β胡萝卜素(β-carotene).β-胡萝卜素又可转化为黄色的玉米黄质(zeaxanthin).番茄红素朝另一个方向的转化是在LYCE的催化下,在番茄红素上产生1个ε-环,生成δ-胡萝卜素 (δ-carotene),在另一端再形成1个β-环,则产生橙色的α-胡萝卜素(α-carotene).接下来,在HYDB(β-carotene hydroxylase)和CYP97C(caroteneε-ring hydroxylase)催化下,α-胡萝卜素可转化为黄色的叶黄素(Lutein),叶黄素被认为是α-胡萝卜素分支的终点[6].
在一些植物中,生物合成途径进一步延伸合成特异的酮类胡萝卜素.例如红色辣椒果实通过CCS(capsanthin-capsorubin synthase)的催化作用,把花药黄质(antheraxanthin)和堇菜黄质(violaxanthin)转化为红色的酮类胡萝卜素:辣椒黄素(capsanthin)和辣椒红素(capsorubin)(图1)[7].
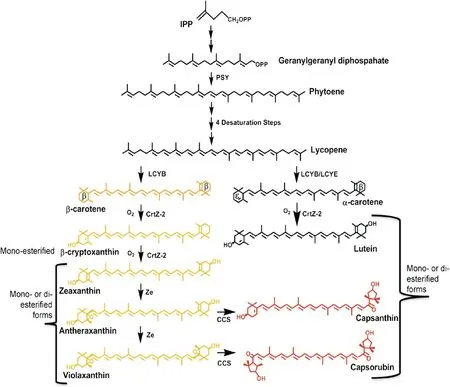
图1 类胡萝卜素生物合成途径[7]
2 植物中类胡萝卜素生物合成的调节
目前,对植物类胡萝卜素生物合成调控的认识停留在酶蛋白及其基因的水平,在调控的信号途径方面缺乏系统的研究.
2.1 转录水平的调节
对于类胡萝卜素合成途径,研究较多的酶基因主要有PSY(phytoene synthase),PDS(phytoene desaturase),CRTZ-2 (β-carotene hydroxylase)和CCSs(capsanthin-capsorubin synthase)[8-9].
番茄成为研究类胡萝卜素合成和积累的一个重要模式植物.番茄红色果实中富含番茄红素,而黄色的花中则富含叶黄素(xanthophylls)、堇菜黄质(violaxanthin)和新黄素(neoxanthin)[10].在类胡萝卜素合成途径中起催化作用的酶往往具有多个不同的成员,它们分别由不同的基因编码,并且这些基因的表达具有组织器官的特异性,如GGPPS1、PSY2 和CRTR-b1主要在番茄的光合器官中表达,而GGPPS2、PSY1 和CRTR-b2 则主要在番茄的花和果实中表达[10-11].属于LYCB的CRTL-b1在叶中表达,在花和果中却只有极低的表达,而CRTL-b2在花中有强的表达,在果中却表达水平极低[12].
在4个不同花色的万寿菊中,PSY转录水平与花中的类胡萝卜素水平保持一致性,在着色深的花中LYCE的表达要更为强烈,不过LYCB却并不如此,这表明万寿菊花中的叶黄素含量主要是由LYCE的活性来决定的[13].然而,也有PSY的转录水平与类胡萝卜素含量无关的结果,例如,在一个白色品种中的PSYmRNA表达高于黄色或橙色品种[14].表明在具有相似表型的不同品种中可能具有完全不一样的调控机制.
牵牛花属植物具有丰富的花色,许多种类具有富含类胡萝卜素的黄色和橙色花瓣.但是日本牵牛(Ipomoeanil)却缺乏黄色的品种.经研究发现白花和黄花牵牛的叶中均含有相同的类胡萝卜素,只是白色品种中不能积累任何的有色体类型的类胡萝卜素[15].与黄色品种的花瓣相比,白色品种花瓣中编码类异戊二烯类以及类胡萝卜素生物合成途径的酶基因只有极低的表达水平,因此,牵牛白色花瓣中缺乏合成有色体类型类胡萝卜素的能力[15].
百合类(Liliumspp.)的花从红色、橙色、黄色、粉红色到白色都有.对不同花色百合花的类胡萝卜素组分分析结果表明,黄色花中主要是花药黄素、堇菜黄质和叶黄素, 而红色花中则有辣椒黄素(capsanthin)的积累[16-17].黄色百合花中,类胡萝卜素合成途径中的各种基因的转录水平变化与类胡萝卜素积累水平有不同的对应关系,如PSY、PDS、ZDS、CRTISO和BCH的mRNA水平与类胡萝卜素水平呈正相关,LYCB则没有变化,LYCE在类胡萝卜素含量升高时其转录水平反而是下降的.与黄色百合花不同,在红色和白色百合花中PSY、PDS、ZDS、CRTISO和BCH的表达水平却是保持恒定的,这表明白色百合花中缺乏类胡萝卜素是受到其它基因调控[16].
有关类胡萝卜素合成的酶基因相关的转录因子极少有报道.目前,唯一的报道来自拟南芥,AtRAP2.2是拟南芥APETALA2家族中的一个成员,它能结合到PSY基因启动子的ATCTA元件.但是通过转基因手段改变RAP2.2的转录水平,却只对色素积累的改变起到很轻微的效果.因此,有人认为类胡萝卜素合成可能存在一个非常复杂的调控网络,而RAP2.2只是这个网络中的一个组分而已[18].
2.2 蛋白水平的调节
从蛋白水平来研究类胡萝卜素合成调控的文献还很少.水仙花在发育过程中类胡萝卜素积累明显增加,但是在这一过程中PSY转录本不但没有升高,甚至还会下降,不过PSY蛋白和PDS蛋白的水平却在明显增加,这可能是导致花中类胡萝卜素积累增加的原因[19].有证据表明,PSY和PDS蛋白均以2种不同形式存在,一种为非活性的可溶游离形式,另一种具有催化活性,与膜结合.通2种形式的相互转化实现对类胡萝卜素合成的调节[19-20].
2.3 光对植物类胡萝卜素合成和积累的影响
光是影响植物生长发育的重要环境因子,也会影响到植物体内类胡萝卜素的积累.在这个问题上,人们的认识还只是停留在类胡萝卜素合成途径相关酶基因转录的水平,至于光介导的类胡萝卜素生物合成信号途径尚有待进一步研究.
在光形态建成过程中,白芥(Sinapisalba)通过光敏色素介导途径上调PSY的转录水平,红光和远红光处理导致的PSYmRNA水平升高并不发生于phyA突变体中[21-22].ZHANG等[23]用不同光质的LED来处理离体培养的柑桔果囊,发现蓝光可以诱导果囊中类胡萝卜素的积累,但红光却是无效的.柑桔CitPSY基因的表达因蓝光处理而上调,红光则对该基因的表达没有影响.但是,当他们改用柑桔的果皮做实验时,却发现LED红光能提高桔皮中β-隐黄质(β-Cryptoxanthin)含量,而且同时也提高了CitPSY、CitPDS、CitZDS、CitLCYb1、CitLCYb2、CitHYb和CitZEP等基因的转录水平,而蓝光则是无效的[24].以上结果表明,光能够精细地调控植物类胡萝卜素的合成和积累,表现在不同的光质、不同的类胡萝卜素种类、甚至是不同的组织器官.
3 辣椒类胡萝卜素合成和积累的研究
辣椒是我国重要的蔬菜作物,我国的辣椒产量占世界的一半[25].辣椒果实中富含多种类胡萝卜素,且具有许多黄、橙、棕和红色等不同果色的品种,是研究类胡萝卜素生物合成调控机制的理想材料.
国内关于辣椒类胡萝卜素代谢方面的研究报道还很少.2001年,徐昌杰等[26]从辣椒中克隆了CCS类基因,戴雄泽等[27]则研究了7个不同品种辣椒果实发育过程中果色与类胡萝卜素的变化规律.
辣椒的原始祖先是红色的,通过选育人们获得了各种果色的品种,如白色、黄色和橙色等[28].在不同果色的辣椒中,其类胡萝卜素合成途径具有各自特征,因此辣椒是研究调控类胡萝卜素生物合成的理想材料.1985年有人预测辣椒的红、黄和橙色是受3个位点控制[29].1998年在黄色辣椒中发现缺失了CCS基因,因此被认为这就是导致黄色表型的原因[30].辣椒4号染色体上的PSY基因位点突变也与辣椒果实的橙色有关,随后在橙色辣椒品种中发现CCS编码产物在N-端有部分氨基酸的缺失[31].还有人在另一橙色辣椒品种中发现了CCS的另一种突变形式,即比野生型提前出现了一个终止密码子[7].综合对辣椒已有的研究成果,现在可以确定Hurtado-Hernandez当年所提出的Y位点即是CCS,C2位点为PSY[32-33].
在水稻、番茄和玉米中,已经发现有2个或更多的PSY基因,但是目前在辣椒中还只是发现了1个PSY基因,其它的PSY成员还有待进一步的发掘.因为有些黄色辣椒品种中富含β-胡萝卜素,因此黄色辣椒也就成了探寻提高作物β-胡萝卜素积累途径的研究对象.但是也有人发现,在某些橙色辣椒品种中积累的是叶黄素(xanthophylls),而非β-胡萝卜素[34].
4 LED在辣椒类胡萝卜素合成调控研究中的应用
在辣椒的种植过程和采后加工中,作者观察到,光照条件对辣椒果实着色有重要的影响(结果未发表).但是目前对于光是如何调节辣椒类胡萝卜素积累的问题尚不清楚.在生产中也未见利用光来促进辣椒类胡萝卜素积累的相关技术.辣椒果实中富含类胡萝卜素,是人体获得类胡萝卜素的重要食物来源.红色辣椒含有特异的辣椒红素和辣椒黄素是目前世界各国卫生组织均批准使用的天然色素,因此辣椒具有很高的营养价值和应用前景.辣椒作为一种蔬菜作物,其果实中的类胡萝卜素种类和含量是衡量其营养价值的一项重要指标.辣椒果实自然发育需要较长的时间,而且辣椒类胡萝卜素的合成主要在果实发育后期完成,因此,在实际生产中,红辣椒均是要等到自然成熟着色完全后才采摘的.但是,在温度较低的秋冬季节,辣椒着色非常缓慢,而春夏天遇到阴雨天气时则可能会造成辣椒大量烂果,导致失收.
发光二极管(LED,Light Emitting Diode)是新型的节能光源,具有波长固定、光量和光质易于调整和控制的特性.本课题组利用各种波长的LED作为光源,研究不同光质对辣椒类胡萝卜素的生物合成和积累的精细调控,发现不同光质对辣椒类胡萝卜素总量以及色角均有不同的影响(结果未发表).由于植物类胡萝卜素种类繁多,颜色各异,总类胡萝卜素色角的变化意味着其类胡萝卜素种类或者是不同种类的类胡萝卜素之间的比例发生了变化,也就是说,光质对植物类胡萝卜素合成和积累具有一个精细的调控机制.目前作者正在对不同光质下辣椒类胡萝卜素组分进行定性和定量分析,以期能揭示光对辣椒类胡萝卜素合成信号途径的精细调控规律,其成果将为建立辣椒提前采收、LED增色技术奠定理论基础,该技术将有利于缩短辣椒生产周期、提高辣椒产量、定向改善辣椒类胡萝卜素品质和含量.
在不同果色的辣椒品种之间,类胡萝卜素的种类及其含量存在很大的差别,这是它们的类胡萝卜素生物合成和积累相关基因发生了变异所致.但是,即使同为黄色或橙色的辣椒品种,其发生突变的基因也很可能是不一样的.因此,不同果色的辣椒品种也就相当于是类胡萝卜素相关的突变体.在精确的LED光波处理控制系统中,通过对各种果色辣椒品种类胡萝卜素种类的定量测定、基因表达谱分析,将有助于揭示光对辣椒类胡萝卜素生物合成和积累的精细调控机制.
[1] FRANK H, COGDELL R. Carotenoids in photosynthesis[J]. Photochemistry and photobiology, 1996, 63(3): 257-264.
[2] DEMMIG-ADAMS B, ADAMS W. Food and photosynthesis: Antioxidants in photosynthesis and human nutrition[J]. Science, 2002, 298(5601): 2149-2153.
[3] BARTLEY G, SCOLNIK P. Plant carotenoids: Pigments for photoprotection, visual attraction, and human health[J]. Plant Cell, 1995, 7(7): 1027-1038.
[5] EISENREICH W, ROHDICH F, BACHER A. Deoxyxylulose phosphate pathway to terpenoids[J]. Trends Plant Sci, 2001, 6(2): 78-84.
[6] ZHU C, BAI C, SANAHUJA G, et al. The regulation of carotenoid pigmentation in flowers[J]. Arch Biochem Biophys, 2010,504(1): 132-141.
[7] RODRIGUEZ-URIBE L, GUZMAN I, RAJAPAKSE W, et al. Carotenoid accumulation in orange-pigmented Capsicum annuum fruit, regulated at multiple levels[J]. J Exp Bot, 2012, 63(1), 517-526.
[8] ROMER S, HUGUENEY P, BOUVIER F, et al. Expression of the genes encoding the early carotenoid biosynthetic enzymes inCapsicumannuum[J]. Biochem Bioph Res Co, 1993,196(3): 1414-1421.
[9] HA S, KIM J, PARK J, et al. A comparison of the carotenoid accumulation in Capsicum varieties that show different ripening colours: Deletion of the capsanthin-capsorubin synthase gene is not a prerequisite for the formation of a yellow pepper[J]. J Exp Bot, 2007, 58(12): 3135-3144.
[10] GALPAZ N, RONEN G, KHALFA Z, et al. A chromoplast-specific carotenoid biosynthesis pathway is revealed by cloning of the tomato white-flower locus[J]. Plant Cell, 2006, 18(8): 1947-1960.
[11] FRASER P, TRUESDALE M, BIRD C, et al. Carotenoid biosynthesis during tomato fruit development: Evidence for tissue-specific gene expression[J]. Plant Physiol, 1994, 105(1): 405-413.
[12] PECKER I, GABBAY R, CUNNINGHAM J, et al. Cloning and characterization of the cDNA for lycopene beta-cyclase from tomato reveals decrease in its expression during fruit ripening[J]. Plant Mol Biol, 1996, 30(4): 807-819.
[13] MOEHS C P, TIAN L, OSTERYOUNG K, et al. Analysis of carotenoid biosynthetic gene expression during marigold petal development[J]. Plant Mol Biol, 2001, 45(3): 281-293.
[14] VILLAR-MARTINEZ A, GARCIA-SAUCEDO P, CARABEZ-TREJO A, et al. Carotenogenic gene expression and ultrastructural changes during development in marigold[J]. J Plant Physiol, 2005, 162(9): 1046-1056.
[15] YAMAMIZO C, KISHIMOTO S, OHMIYA A. Carotenoid composition and carotenogenic gene expression during Ipomoea petal development[J]. J Exp Bot, 2010, 61(3): 709-719.
[16] GALPAZ N, WANG Q, MENDA N, et al. Abscisic acid deficiency in the tomato mutant high-pigment 3 leading to increased plastid number and higher fruit lycopene content[J]. Plant J, 2008, 53: 717-730.
[17] YAMAGISHI M, KISHIMOTO S, NAKAYAMA M. Carotenoid composition and changes in expression of carotenoid biosynthetic genes in tepals of Asiatic hybrid lily[J]. Plant Breeding, 2009, 129(1): 172-177.
[18] WELSCH R, MAASS D, VOEGEL T, et al. Transcription factor RAP2.2 and its interacting partner SINAT2: Stable elements in the carotenogenesis of Arabidopsis leaves[J]. Plant Physiol, 2007, 145(3): 1073-1085.
[19] SCHLEDZ M, AL-BABILI S, VON LINTIG J, et al. Phytoene synthase from Narcissus pseudonarcissus: Functional expression, galactolipid requirement, topological distribution in chromoplasts and induction during flowering[J]. Plant J, 1996, 10(5): 781-792.
[20] AL-BABILI S, LINTIG J, HAUBRUCK H, et al. A novel, soluble form of phytoene desaturase from Narcissus pseudonarcissus chromoplasts is Hsp70-complexed and competent for flavinylation, membrane association and enzymatic activation[J]. Plant J, 1996, 9(5): 601-612.
[21] WELSCH R, BEYER P, HUGUENEY P, et al. Regulation and activation of phytoene synthase, a key enzyme in carotenoid biosynthesis, during photomorphogenesis[J]. Planta, 2000, 211(6): 846-854.
[22] WELSCH R, WUST F, BAR C, et al. A third phytoene synthase is devoted to abiotic stress-induced abscisic acid formation in rice and defines functional diversification of phytoene synthase genes[J]. Plant Physiol, 2008, 147(1): 367-380.
[23] ZHANG L, MA G, KATO M, et al. Regulation of carotenoid accumulation and the expression of carotenoid metabolic genes in citrus juice sacsinvitro[J]. J Exp Bot, 2012, 63(2): 871-886.
[24] MA G, ZHANG L, KATO M, et al. Effect of blue and red led light irradiation onβ-cryptoxanthin accumulation in the flavedo of citrus fruits[J]. J Agric Food Chem, 2012,60(1): 197-201.
[25] USDA. Vegetables and melons yearbook: Dataset. http://usda.mannlib. cornell.edu/MannUsda/viewDocumentInfo.do?documentID=1212, 2011
[26] 徐昌杰,陈大明,张上隆.甜橙辣椒红/辣椒玉红素合成酶同源基因的克隆(简报)[J]. 实验生物学报, 2001, 34(2): 147-150.
[27] 戴雄泽,王利群,陈文超,等. 辣椒果实发育过程中果色与类胡萝卜素的变化[J]. 中国农业科学, 2009, 42(11): 4004-4011.
[28] PARAN I, VAN DER KNAAP E. Genetic and molecular regulation of fruit and plant domestication traits in tomato and pepper[J]. J Exp Bot, 2007, 58(14): 3841-3852.
[29] HURTADO-HERNANDEZ H, SMITH P. Inheritance of mature fruit colour inCapsicumannuumL[J]. J Hered, 1985, 76(3): 211-213.
[30] LEFEBVRE V, KUNTZ M, CAMARA B, et al. The capsanthincapsorubin synthase gene: A candidate gene for the y locus controlling the red fruit colour in pepper[J]. Plant Mol Biol, 1998, 36(5): 785-789.
[31] LANG Y, YANAGAWA S, SASANUMA T, et al. Orange fruit colour in Capsicum due to deletion of capsanthin-capsorubin synthesis gene[J]. Breeding Science, 2004, 54: 33-39.
[32] POPOVSKY S, PARAN I. Molecular genetics of the y locus in pepper: Its relation to capsanthin-capsorubin synthase and to fruit colour[J]. Theor Appl Genet, 2000, 101(1/2): 86-89.
[33] THORUP T, TANYOLAC B, LIVINGSTONE K, et al. Candidate gene analysis of organ pigmentation loci in the Solanaceae[J]. PNAS, 2000, 97(21): 11192-11197.
[34] GUZMAN I, HAMBLY S, ROMERO J, et al. Variability of carotenoid biosynthesis in orange colouredCapsicumspp[J]. Plant Science, 2010, 179(1/2): 49-59.
Keywords: carotenoid; pepper; light; LED
Light-DependentRegulationofCarotenoidBiosynthesisandAccumulationinPlant
PENG Jianzong*, WEI Chengyong, CHEN Bishao, WANG Xiaojing
(College of Life Science, South China Normal University, Guangdong Provincial Key Lab of Biotechnology for Plant Development, Guangzhou 510631, China)
The results from our research group indicated that the total carotenoids and color of pepper depend on the wave length of LED light. The results will help reveal the signal pathway of light mediated carotenoid metabolism in pepper fruits, and will make it possible to enhance carotenoids content in earlier harvested pepper fruit after treating with LED light.
2013-09-02
广东省科技计划团队项目(2011A020102007);广东省科技计划项目(2010B020305008)
*通讯作者:彭建宗,教授,Email: pengjz@scnu.edu.cn.
1000-5463(2013)06-0165-06
Q946
A
10.6054/j.jscnun.2013.09.018
【中文责编:成文 英文责编:李海航】

