甜荞不同器官水提液体外抗氧化活性
张以忠, 李 晶, 邓琳琼
(毕节学院 地理与生命科学学院,贵州 毕节551700)
活性氧(reactive oxygen species,ROS)是指生物体内有氧代谢过程中产生或在外界物理化学因素诱导下产生含有氧原子且氧化能力很强的多种物质的总称[1-3]。主要有超氧阴离子自由基(·O2-)、羟基自由基(·OH)、过氧化氢(H2O2)等[4-7]。 正常情况下,人体内的自由基是处于不断产生与清除的动态平衡之中,确保机体有效、正常的生命活动。但如果自由基在机体内产生过多或清除过慢,均会通过攻击生命大分子物质及各种细胞,造成机体在分子水平、细胞水平及组织器官水平上的各种损伤,加速机体衰老并诱发各种疾病[8-10]。流行病学研究发现,人类长期摄入一定量的抗氧化物质能有效地降低心脑血管疾病和癌症发病率[11-12]。由于一些人工化学合成的抗氧化剂可能具有一定的毒副作用,以及人们越来越追求绿色环保消费,因此,从日常食物中寻找天然的抗氧化剂具有重要意义。
甜 荞 (F.esculentum Moench)属 于 蓼 科(Polygonaceae)荞麦属(Fagopyrum)[13]。 在中国和世界上许多国家广泛种植,果实较大,呈三棱形,表面光滑,食用品质较好,含有多种易被人体吸收的矿物质元素和人体所必需的8种氨基酸,非常接近人体需要14-15]。另外,它还含有其它谷物中没有的较为丰富的生物活性成分黄酮类化合物[16-18]。甜荞虽然属药食两用植物,但对其抗氧化活性的研究报道极少。何永艳等[19]研究发现,甜荞不同生育期地上部分乙醇提取液对·OH有一定的清除作用,且与生育期有关。但植物的不同器官对活性氧的清除作用有所不同[20]。而且有关甜荞根、茎、叶和花抗氧化活性的研究还未见报道。因此,作者利用体外法,研究了甜荞不同器官(根、茎、叶和花)水提液抗·OH、·O2-和H2O2的能力,筛选高抗氧化活性的甜荞器官,为对其深入研究及开发利用提供科学依据。
1 材料与方法
1.1 材料
供试材料为贵州毕节甜荞,来源于毕节学院地理与生命科学学院荞麦种子资源库。
1.2 仪器与试剂
723N可见分光光度计,上海精科产品;电子天平,奥豪斯仪器(上海)有限公司产品;双功能水浴恒温振荡器,江苏金坛亿通电子有限公司产品。
NBT为amresco公司产品;L-MET、核黄素为国产生化试剂,番红花红T为国产生物染色素,
EDTANa2、FeSO4·7 H2O、H2O2、EDTA、NaCl、KCl、Na2HPO4(无水)、KH2PO4、NaOH、(NH4)2MoO4均为国产分析纯。
1.3 方法
1.3.1 样品制备 荞麦种子从低温冰柜中取出,于2012年3月将其播种于贵州省毕节市七星关区鸭池镇试验田,盛花期时分别取其根、茎、叶和花,用蒸馏水洗净,40℃下恒温烘干至恒重,将其打粉,分别加干重15倍蒸馏水,80℃下恒温振荡 (140 r/min)1 h,过滤收集滤液,残渣再加5倍蒸馏水,80℃恒温振荡(140 r/min)1 h,过滤收集滤液,合并两次滤液即为甜荞各器官水提取液(质量浓度分别为 27.0、80.0、29.4 和 61.5 mg/mL),将其储存冰箱备用。
1.3.2 水提液对活性氧的清除测定
1)甜荞各器官水提液对·OH的清除试验:参照文献[20]的方法,稍加改动。每种样品(根、茎、叶和花)均设 5 个质量浓度梯度(0.15、0.30、0.45、0.60、0.75 mg/mL),分别测定各器官在各质量浓度下的清除率。反应体系总体积为3 mL,包含pH=7.4的PBS 0.75 mL、2 mmol/L 的 EDTANa2-Fe (Ⅱ)1 mL,70 μg/mL的番红花红T 0.5 mL,不同浓度供试液0.25 mL和体积分数0.33%的H2O20.5 mL。将其充分混匀,置37℃恒温水浴锅中保温30 min后,用723 N分光光度计于520 nm处测吸光度值(A),加不同浓度供试液的体系其吸光度为A样品,以提取介质代替供试液的体系其吸光度为A空白,两者均以未加 EDTANa2-Fe(II)(用蒸馏水代替)作对照,各自与其对照之差分别记为 ΔA样品和 ΔA空白。 供试液对·OH的清除能力以清除率E(%)表示,清除率按下式计算:

以提取液质量浓度为横坐标,清除率为纵坐标,绘制曲线。
2)甜荞各器官水提液对·O2-的清除试验:参照文献[20]的方法,并稍加改动。每种样品(根、茎、叶和花)均设 5 个质量浓度梯度(0.03、0.06、0.09、0.12、0.15 mg/mL),分别测定各器官在各质量浓度下的清除率。反应体系总体积为3.25 mL,包含不同浓度提取液 0.25 mL,14.5 mmol/L的 L-Met 2.7 mL,3.0 mmol/L 的 EDTA 0.1 mL,2.25 mmol/L的 NBT 0.1 mL,60 μmol/L 的核黄素 0.1 mL(EDTA、NBT、核黄素均以50 mmol/L pH 7.8的PBS配制)。混匀倒入吸光度一致的比色皿,在3 000 lx下光照10 min,反应后立即避光,迅速颠倒混匀,立即在560 nm下测吸光度值。加不同浓度供试液的体系为A样品,以提取介质代替供试液的体系为A对照,均以PBS代替NBT作空白。样品管和对照管吸光度与各自空白之差分别记为 ΔA样品和 ΔA对照。 供试液对·O2-的清除能力以清除率E(%)表示,清除率计算式:

以提取液质量浓度为横坐标,清除率为纵坐标,绘制曲线。
3)甜荞各器官水提液对H2O2的清除试验:参照文献[21]的方法,并稍加改动。具体方法如下:每种样品(根、茎、叶和花)均设5个质量浓度梯度(0.31、0.62、0.93、1.24、1.55 mg/mL),分别测定各器官在各质量浓度下的清除率。反应体系总体积为3.25 mL,在样品管中加入0.25 mL不同浓度的样品,然后放入37℃水浴锅,迅速加入1.5 mL基质液[60 mmol/L的 PBS(pH=7.4)含 65 μmol/L 的 H2O2]作为样品对照组,保温1.5 min后立即加入32.4 mmol/L的钼酸铵溶液1.5 mL,自来水中终止反应5 min,405 nm处测吸光度值(A)。以提取介质代替供试液作对照,均以PBS代替基质液作空白,样品管和对照管吸光度与各自空白之差分别记为ΔA样品和ΔA对照。清除率按下式计算:

以提取液质量浓度为横坐标,清除率为纵坐标,绘制曲线。
1.3.3 数据处理 利用Excel2003和SPSS11.5统计分析软件。
2 结果与分析
2.1 甜荞各器官水提液对·OH的清除作用
甜荞各器官水提液对·OH的清除作用见图1。

图1 甜荞各器官提取液对·OH的清除作用Fig.1 Scavenging of·OH by extractions from various organs of F.esculentum
由图1知,甜荞根、茎、叶和花水提液对·OH均有清除作用,茎和花水提液在该质量浓度范围内的清除率变化较大,而叶和根水提液对·OH的清除率变化较小。表明茎和花水提液随质量浓度升高对·OH的清除率逐渐升高,而叶和根水提液对·OH的清除率受质量浓度影响较小。各器官水提液对·OH清除能力强弱依次为茎>花>叶>根。多重比较见表1。
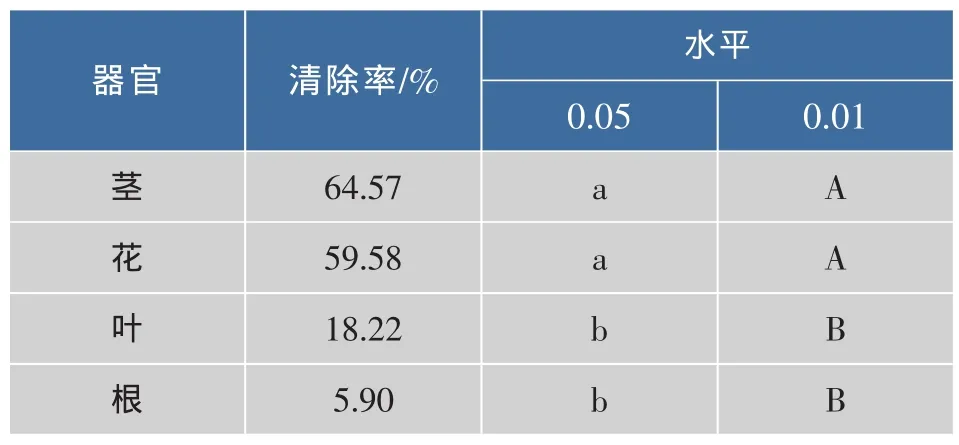
表1 甜荞各器官提取液清除·OH多重比较Tab.1 Multiple comparison of scavenging of·OH by extractions from various organs of F.esculentum
从表1可知,茎和花水提液对·OH的清除率差异不显著,但均极显著高于叶和根水提液。而叶和根水提液之间差异不显著。在0.01水平上对·OH的清除率大小排序为:茎、花>叶、根。
2.2 甜荞各器官水提液对·O2-的清除作用
甜荞各器官水提液对·O2-的清除作用见图2。
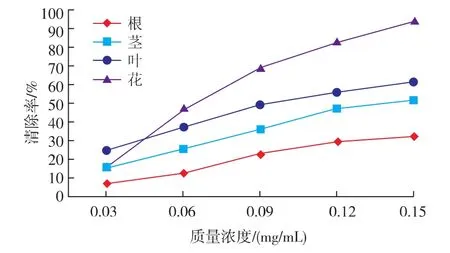
图2 甜荞各器官提取液对·O2-的清除作用Fig.2 Scavenging of·O2-by extractions from various organs of F.esculentum
由图2知,甜荞根、茎、叶和花水提液对·O2-均有清除作用,随质量浓度升高清除率逐渐增加。各器官水提液对·O2-清除能力强弱依次为花>叶>茎>根。多重比较见表2。

表2 甜荞各器官提取液清除·O2-多重比较Tab.2 Multiple comparison of scavenging of·O2-by extractions from various organs of F.esculentum
由表2知,花水提液对·O2-的清除率极显著高于茎和根水提液,显著高于叶水提液。叶和茎水提液之间差异不显著,但两者分别极显著和显著高于根水提液对·O2-的清除率。在0.05水平上对·O2-的清除率大小排序为:花>叶、茎>根。
2.3 甜荞各器官水提液对H2O2的清除作用
甜荞各器官水提液对H2O2的清除作用见图3。

图3 甜荞各器官提取液对H2O2的清除作用Fig.3 Scavenging of H2O2by extractions from various organs of F.esculentum
由图3知,叶和花水提液对H2O2的清除率相对较高,且二者均随质量浓度的增加逐渐升高,而根和茎水提对H2O2的清除率相对较低,且随质量浓度升高变化不大。各器官水提液对H2O2清除能力强弱依次为叶>花>根>茎。多重比较见表3。

表3 甜荞各器官提取液清除H2O2多重比较Tab.3 Multiple comparison of scavenging of H2O2by extractions from various organs of F.esculentum
从表3可看出,叶和花水提对H2O2的清除率无显著差异,但均极显著高于根和茎。而根和茎水提液之间对H2O2的清除率差异不显著。在0.01水平上清除率大小排序为:叶、花>根、茎。
3 讨论
自由基对人体危害很大,其具有高度的活泼性和极强的氧化能力,人体内过量的自由基会造成组织细胞中生物大分子化学结构的破坏性变化,体内羟基自由基(·OH)、超氧阴离子自由基(·O2-)和过氧化氢(H2O2)等活性氧过量会使机体受到损伤,从而引起癌症、衰老、心血管疾病等慢性病[9-10]。正常情况下,机体含有自由基清除剂,可以清除一定量的自由基。但当自由基过多,造成机体紊乱时,必须寻找外源性自由基清除剂——抗氧化剂,让其清除机体内过多的自由基,是减少癌症、衰老、心血管疾病等对人类健康威胁的有效手段之一[22]。由于一些人工化学合成的抗氧化剂可能具有一定的毒副作用,因此,从日常食物中寻找天然的抗氧化剂具有重要意义。
甜荞因种植适应性强,并含有黄酮、蛋白质、原花青素、膳食纤维等功效分子,具有降糖、抗缺血、抗菌、抗癌、助睡眠等保健功能,属于药食两用植物[14,16,23],因此越来越受到人们的重视。 目前有关荞麦抗氧化活性的研究报道很少。何永艳等[19]研究了甜荞不同生育期(出苗期、现蕾期、盛花期、灌浆期、收获期)地上部分乙醇提取液对·OH的清除作用,发现:甜荞地上部分乙醇提取液对·OH均有清除作用,随生育期推进,对羟基自由基清除率先增大,到盛花期达到最大,以后逐渐下降,在苗期和收获期,甜荞提取液几乎对羟基自由基没有清除作用。作者首次对甜荞盛花期不同器官水提液清除活性氧(·OH、·O2-和 H2O2)作研究,发现:甜荞根、茎、叶和花水提液对·OH、·O2-和H2O2均有清除作用,但存在一定的差异。清除·OH中,茎和花随提取液质量浓度升高清除率逐渐增加,而叶和根水提液的清除率受质量浓度影响较小。且茎和花水提液的清除率差异不显著,但均极显著高于叶和根水提液。而叶和根水提液之间差异不显著。清除·O2-中,根、茎、叶和花随提取液质量浓度升高清除率逐渐增加,但各器官之间的清除作用存在一定的差异,花水提液的清除率极显著高于茎和根水提液,显著高于叶水提液。叶和茎水提液之间差异不显著,但两者均显著高于根水提液的清除率,且叶和根水提液之间的差异达到极显著水平。清除H2O2中,叶和花水提液的清除率相对较高,且二者均随质量浓度升高逐渐增加,而根和茎水提液的清除率相对较低,且随质量浓度升高清除率变化不大。多重比较表明,叶和花水提液对自由基的清除率无显著差异,但均极显著高于根和茎水提液。而根和茎水提液之间差异不显著。综合以上分析发现,甜荞的花水提液对·OH、·O2-和H2O2均具有较高的清除作用,花是清除活性氧制剂的较好器官。而根是清除活性氧制剂的较差器官。因此本研究可为深入探讨甜荞不同器官的抗氧化机理和合理开发利用甜荞资源提供一定参考。但甜荞在苗期、现蕾期、盛花期、灌浆期和收获期各器官提取液对·OH、·O2-和H2O2的清除作用与何永艳等[19]报道是否一致有待进一步研究。
另外,甜荞中成分复杂,并含有糖类、蛋白质、黄酮、酚类、原花青素、膳食纤维等多种功效分子,这些功效分子均有抗氧化作用。因此甜荞各器官水提液的可能成分以及可能起到抗氧化作用的具体成分是什么等都有待作进一步研究。
[1]杨玲,许速.氧化应激与疾病发生的相关性[J].西南国防医药杂志,2012,22(11):1268-1270.YANG Ling,XU Su.Relationship between oxidative stress and disease[J].Medical Journal of National Defending Forces in Southwest China,2012,22(11):1268-1270.(in Chinese)
[2]Sarvajeet S G,Narendra T.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[3]Chen Y,Azad M B,Gibson S B.Superoxide is the major reactive oxygen species regulating autophagy[J].Cell Death and Differentiation,2009,16:1040-1052.
[4]赵保路.自由基、天然抗氧化荆与神经退行性疾病[J].生物物理学报,2010,26(4):263-274.ZHAO Bao-lu.Free radicals,natural antioxidants and neurodegenerative disease[J].Acta Biophysica Sinica,2010,26(4):263-274.(in Chinese)
[5]Chen Yi,Xie Ming-yong,Nie Shao-ping,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chemistry,2008,107(1):231-241.
[6]Ali S,Choudhary M I,Rahman A U.Superoxide anion radical,an important target for the discovery of antioxidants[J].Atherosclerosis Supplements,2008,9(1):268.
[7]左玉.自由基、活性氧与疾病[J].粮食与油脂,2011(9):9-11.ZUO Yu.Free radicals,reactive oxygen species and disease[J].Cereals&Oils,2011(9):9-11.(in Chinese)
[8]Sarvajeet S G,Narendra T.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[9]Kaliora A C,Dedoussis G V Z.Natural antioxidant compounds in risk factors for CVD[J].Pharmacological Research,2007,56:99-109.
[10]Valko M,Leibfritz D,Moncola J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry and Cell Biology,2007,39:44-84.
[11]Machlin L J.Critical assessment of the epidemiological data concerning the impact of antioxidant nutrients on cancer and cardiovascular disease[J].Critical Review in Food Science and Nutrition,1995,35:41-50.
[12]Muller F L,Lustgarten M S,Jang Y,et al.Trends in oxidative aging theories[J].Free Radical Biology and Medicine,2007,43:477-503.
[13]吴征镒.西藏植物志[M].北京:科学出版社,1983:604-605.
[14]张以忠,陈庆富.荞麦研究的现状与展望[J].种子,2004,23(3):39-42.ZHANG Yi-zhong,CHEN Qing-fu.Status and prospect of research on buckwheat[J].Seed,2004,23(3):39-42.(in Chinese)
[15]尹春,尹东方,张雄杰,等.甜荞种质资源种子化学成分比较研究[J].种子,2010,29(1):4-6.YIN Chun,YIN Dong-fang,ZHANG Xiong-jie,et al.Comparative study on buckwheat seed chemical constituents of germplasm Resources[J].Seed,2010,29(1):4-6.(in Chinese)
[16]赵秀玲.荞麦的功效因子与保健功能的研究进展[J].食品工程,2011(3):16-18.ZHAO Xiu-ling.Research progress on the functional components and healthy functions of buckwheat[J].Food Engineering,2011(3):16-18.(in Chinese)
[17]詹寿发,陈晔,彭琴,等.九江地区3种荞麦黄酮含量的测定与分析[J].江苏农业科学,2009(6):349-350.ZHAN Shou-fa,CHEN Ye,PENG Qin,et al.Determination and analysis of flavonoids content in 3 kinds of buckwheat in Jiujiang area[J].Jiangsu Agricultural Sciences,2009(6):349-350.(in Chinese)
[18]杨玉霞,蒋召雪,王安虎,等.荞麦茎叶中总黄酮的提取工艺研究[J].安徽农业科学,2011,39(16):9587-9589.YANG Yu-xia,JIANG Zhao-xue,WANG An-hu,et al.Study or extraction technology of total flavonoids from stems and leaves of buckwheat[J].Journal of Anhui Agricultural Sciences,2011,39(16):9587-9589.(in Chinese)
[19]何永艳,冯佰利,邓涛,等.荞麦提取物抗氧化活性研究[J].西北农业学报,2007,16(6):76-79,84.HE Yong-yan,FENG Bai-li,DENG Tao,et al.Antioxidant activity of ethanol extracts of different buckwheat[J].Acta Agriculturae Boreali-Occidentalis Sinica,2007,16(6):76-79,84.(in Chinese)
[20]龚宁,邓琳琼,曾坤.金线兰各器官水提液清除·OH和·O2-的比较研究[J].食品与生物技术学报,2010,29(6):821-824.GONG Ning,DENG Lin-qiong,ZENG Kun.Comparison of the effect in scavenging·OH and·O2-by the aqueous extraction from various Organs of anoectochilus roxburghii(Wall.)lindl[J].Journal of Food Science and Biotechnology,2010,29(6):821-824.(in Chinese)
[21]龚宁,邓琳琼,唐兰秀,等.花叶开唇兰清除活性氧作用研究[J].中药药理与临床,2006,22(2):39-41.GONG Ning,DENG Lin-qiong,TANG Lan-xiu,et al.Scavenging of reactive oxygen species by the extraction of Anoectochilus roxburghii(Wall.)Lindl[J].Pharmacology and Clinics of Chinese Materia Medica,2006,22(2):39-41.(in Chinese)
[22]李培培,戚向阳,罗彤,等.化学发光法研究不同杨梅黄酮提取物的抗氧化活性[J].中国食品学报,2011,11(7):190-194.LI Pei-pei,QI Xiang-yang,Luo Tong,et al.Antioxidant activity of flavonoids extracts from different varieties of Chinese bayberry by chemiluminescence[J].Journal of Chinese Institute of Food Science and Technology,2011,11 (7):190-194. (in Chinese)
[23]任顺成,孙军涛.荞麦粉、皮、芽中黄酮类化合物抗氧化研究[J].河南工业大学学报:自然科学版,2008,29(2):15-17,21.REN Shun-cheng,SUN Jun-tao.Study on antioxidant activity of flavonoids of buckwheat flour,bran and sprount[J].Journal of Henan University of Technology:Natural Science Edition,2008,29(2):15-17,21.(in Chinese)
——以渤海S油田为例

