电针治疗对大鼠脑缺血再灌注中AnnexinA1和TRPM7表达的影响
郑永强 叶 飞 刘南暖 邓晓玲 汪 健 王成谋 上官守琴
瞬时感受器电位M7通道(TRPM7)是一种具有丝氨酸、苏氨酸激酶结构域的特殊的阳离子通道蛋白。TRPM7的C端胞内区的丝氨酸、苏氨酸激酶可使自身和底物磷酸化,自身磷酸化发生在Ser1511和Ser1567两个位点而关于该激酶的底物正在研究当中。AnnexinA1是分子量约37KDa结构相关的磷脂结合蛋白。AnnexinA1的氨基末端在 Thr24、Ser27、Ser28、Thr41有蛋白激酶C的磷酸化位点,Tyr21有表皮生长因子受体酪氨酸激酶的磷酸化位点,在Ser5上有一个目前还只被一个具有离子通道功能和α激酶功能的蛋白质瞬时感受器电位M7通道的α激酶磷酸化位点[1]。这些蛋白激酶磷酸化AnnexinA1后可以引起AnnexinA1功能上的一些改变。最近一项研究表明AnnexinA1分子N端的Ser5残基可特异性地被TRPM7激酶磷酸化,而该部位磷酸化和AnnexinA1参与抗炎症反应,细胞生长、增殖、调亡等功能相关。本实验采用Morris水迷宫实验测定动物学习和记忆能力,免疫荧光双标方法检测AnnexinA1和TRPM7在大鼠脑组织中的共存表达,旨在研究脑中风发病的病理生理过程中探讨电针穴位的效应或作用;电针治疗中对AnnexinA1与TRPM7共存为探讨TRPM7在脑缺血再灌注损伤中的途径提供理论依据。
1.材料与方法
1.1 大脑中动脉栓塞动物模型的制备和评价
1.1.1 选用华中科技大学同济医学院实验动物中心提供的健康成年雄性S-D大鼠,体重150~200g,随机分组,每组8只:①正常对照组,②假手术组,③缺血再灌组:缺血再灌注24小时组,④电针治疗组:缺血再灌注24小时+电针组。术前动物禁食24小时。手术操作参照Longa[2]之方法,并稍加改进:10%水合氯醛(0.35ml/100g)腹腔注射麻醉动物后,大鼠仰卧位固定于手术台上。行大鼠大脑中动脉栓塞手术:颈部正中切口,分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),用电热烧灼器烧断ECA的分支,结扎并游离ECA主干一段,沿ICA向下分离翼颚动脉,穿线沿起点结扎。在ECA游离段上剪开一小口,插入尖端用火烧圆的4.0单尼龙丝线,轻推尾端使之由颈外动脉通过分叉部进入颈内动脉(由入口计算长度约18~20mm),栓塞右大脑中动脉(MCA)起始部从而减少大脑中动脉血液供应。1小时后缓慢退出尼龙线至颈外动脉结扎端,恢复血供。手术结束后,缝合皮肤,将动物放回笼中,保温喂养。以4.0尼龙丝线栓塞右侧大脑中动脉60分钟再灌注24小时后,大鼠均出现神经缺损体征。快速剖颅取脑,肉眼可见缺血侧大脑皮质苍白水肿,以2%TTC染色见缺血侧皮质梗死区呈苍白色,对照侧及非梗死区为红色,红白分明,极易鉴别。行为测试及形态学显示均表明:用大脑中动脉丝线栓塞法能得到理想的局灶性脑缺血模型。
1.1.2 以局灶性缺血区的TTC染色证实模型:TTC(triphenyl tetraxolium chloride)无色透明,对光、热敏感,在线粒体过氧化氢酶的作用下,作为受氢体易被还原成红色亲脂性的四唑氮红,因此,有线粒体存活的非梗死区脑组织染成红色,无线粒体存活的缺血梗死区脑组织不能发生过氧化氢反应而显示苍白色,二者界限清晰可辨.TTC染色可证实本实验栓线法脑缺血模型的可靠性。脑缺血再灌注后将大鼠断头处死,打开颅骨盖,剥去脑膜,快速取出整个大脑,用PBS液清洗后,将鼠脑置于1%TTC溶液中,再于37℃ CO2孵育箱温育20分钟,严格避光,20分钟后脑标本移置于4%多聚甲醛液中固定。TTC染色后可见缺血区呈苍白色,主要位于右侧大脑背外侧面额顶部的新皮层区,其余部位及左侧大脑均呈红色,表示供血状况未发生改变。
1.1.3 电针条件选择:选择“水沟”、“承浆”穴,于缺血前30分钟及缺血后30分钟予以电针,使用TDM2A定量针麻治疗仪(北京海淀电子医疗仪器厂制),选择间断疏密波(频率4~16Hz),刺激强度从1V起,每10分钟增加1V,终强度为3V,持续时共30分钟。
1.2 大鼠Morris水迷宫实验测定动物学习记忆能力实验条件与仪器参照Morris水迷宫法[3],实验分为两个部分:定位航行实验和空间搜索实验。Morri水迷宫包括一个直径120cm、高50cm盛有水的圆形水池、隐藏在水面下的平台以及一套图象自动采集和处理系统(摄像机、录像机、显示器和分析软件等),水温保持在26±1℃,水中加入奶粉,充分混匀,使水呈乳白色,致动物视觉无法辨认池内有无站台,不带任何标记,以池底圆心为中心将迷宫分为四个象限,平台位于某一象限中心位置,注水后水面超过平台2cm。
1.2.1 定位航行实验实验:造模前3天对大鼠实施水迷宫训练,第一天让大鼠自由游泳30秒以适应环境,从第2天开始,每天训练1次。训练时,按东北、西北、东南、西南4个象限依次将大鼠面向池壁放入水中,设定最长游动时间为120秒,观察并记录大鼠寻找并爬上平台所需时间(逃避潜伏期)。如果大鼠在120秒内未找到平台,则将其引至台,并将潜伏期记120秒。造模前1天进行水迷宫测试,记录大鼠找到平台所用的时间,作为大鼠学习成绩。第3天即造模结束后第1天再次测试各组大鼠水迷宫实验找到平台所需的时间,作为大鼠的记忆成绩,连续5天。
1.2.2 空间探索实验:定位航行实验结束后撤掉平台,选定和平台相对的象限中点为入水点,观察大鼠在120秒内跨越平台所在位置的路径和次数,记录大鼠穿越平台的次数和搜寻平台的轨迹。水迷宫实验持续7天。采用荷兰noldus公司研制的Moris水迷宫检测软件系统自动跟踪池内大鼠的活动轨迹并记录大鼠游泳时间、穿越平台次数等参数。行为学检测期间,保持室内安静。
1.3 Annexin A1和TRPM7免疫组织化学
1.3.1 主要试剂:Mouse anti-AnnexinA1单克隆抗体,Santa Cruz公司生产;Goat anti-TRPM7多克隆抗体,Novus Biologicals公司生产;抗mouse免疫组化试剂盒,武汉博士德提供;FITC-conjugated affinipure Donkey Anti-mouse IgG(USA)和 Texas red-conjugated affinipure Donkey Anti-goat IgG(USA)均由武汉众一公司提供。
1.3.2 脑片制备:大鼠在脑缺血60分钟再灌注24小时后经10%水合氯醛腹腔麻醉(350mg/kg),开胸经左心室行主动脉插管,剪开右心耳,以250ml生理盐水经升主动脉快速冲洗。随后灌注预冷的4℃的4%多聚甲醛固定液450ml,断头取脑后组织修块,再将大脑后固定于4℃的4%多聚甲醛固定液中,固定6小时后,脑组织经振荡切片机连续冠状切片,片厚20μm,收集于0.01mol/L PBS溶液(pH=7.4)中备用。
1.3.3 免疫荧光双标方法:取脑片0.01Mol/LPBS(pH:7.4)充分漂洗10分钟×3次,0.3%Triton 37℃恒温箱孵育30min,0.01Mol/L PBS充分漂洗10min×3次,5%BSA在室温(20~24℃)下孵育30分钟,吸干BSA后加入anti-mouse单克隆Annexin A1抗体(工作浓度为1∶25),anti-goat多克隆TRPM7抗体(工作浓度为1∶25),5%BSA混合液,放置4℃冰箱,孵育32小时,再置37℃恒温箱60分钟,0.01mol/L PBS(pH=7.4)充分漂洗10min×3次,加FITC-conjugated affinipure Donkey Anti-mouse IgG(USA)(工作浓度为1∶100)和Texas red-conjugated affinipure Donkey Anti-goat IgG(工作浓度为1∶100),5%BSA混合液,室温孵育60分钟,再37℃恒温箱孵育45分钟,0.01Mol/LPBS(pH:7.4)充分漂洗10分钟×3次,激光共聚焦照相。实验过程中以PBS代替一抗作空白对照
1.3.4 图像分析和统计处理 每组动物随机取3张切片,每张切片选取海马CA1,CA3和皮质区在20×10倍下用激光共聚焦分析系统对其免疫反应产物进行图像录入后,分别计数每一个视野(4,000,000μm2)中 CA1,CA3和皮质区阳性细胞数和细胞核和膜上阳性表达的细胞数。所得实验数据采用SPSS13.0系统做方差分析和t检验统计处理,结果以均数±标准差±s)表示,并以单因素方差分析,P<0.05有显著差异。
2.结果
2.1 电针治疗可显著改善缺血再灌注后大鼠的学习记忆能力检测结果
2.1.1 定位航行实验:如表1所示,定位航行实验中各组大鼠逃避潜伏期随训练次数的增多在不断缩短。各组在第1天显示出较强的学习能力,造模后缺血再灌组学习能力显著下降,电针治疗组与缺血再灌组相比学习能力均显著提高(P<0.05)。说明电针可提高大鼠的学习能力。
表1 各组大鼠定位航行试验中平均逃避潜伏期的比较(n=8,±s)

表1 各组大鼠定位航行试验中平均逃避潜伏期的比较(n=8,±s)
组别 第1天 第3天 第4天 第5天 第6天 第7天正常对照组 85.03±33.86 75.14±28.80 60.13±16.32 46.85±17.46 30.45±12.36 23.48±15.46假手术组 86.12±32.98 78.04±25.79a 61.28±23.16b 48.79±14.24 34.68±13.46 25.12±13.89缺血再灌组 85.35±33.76 108.26±30.12b 96.36±28.20 83.90±24.68b 60.87±20.12 45.36±25.12电针治疗组 85.98±32.26 97.58±28.85 90.45±30.16 76.24±39.44 50.43±23.65 30.26±23.16
2.1.2 空间探索实验:如表2所示,在定位航行实验结束后撤除平台,正常对照组、假手术组和电针治疗组大鼠搜寻目标的目的性较强,造模后在规定时间(120秒)内搜寻并穿越平台次数明显高于缺血再灌组,其中电针治疗组与缺血再灌组结果有显著性差异(P<0.01),说明电针能有效改善大鼠的记忆功能。
表2 各组大鼠空间探索试验中穿越平台的次数(n=8,±s)
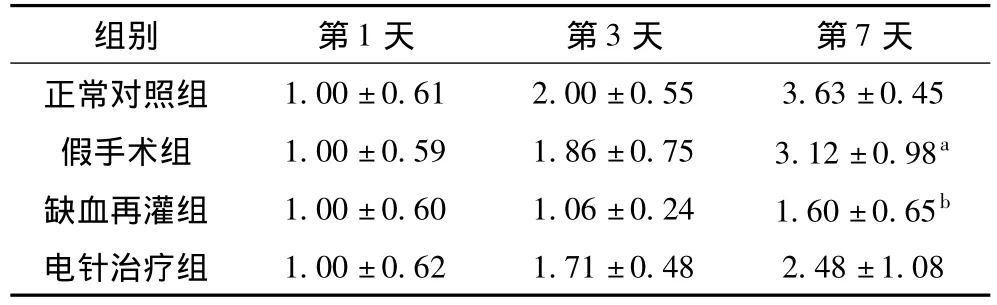
表2 各组大鼠空间探索试验中穿越平台的次数(n=8,±s)
组别 第1天 第3天 第7天正常对照组 1.00±0.61 2.00±0.55 3.63±0.45假手术组 1.00±0.59 1.86±0.75 3.12±0.98a缺血再灌组 1.00±0.60 1.06±0.24 1.60±0.65b电针治疗组1.00±0.62 1.71±0.48 2.48±1.08
2.2 免疫荧光双标方法检测AnnexinA1和TRPM7在大鼠脑组织中的共存表达结果 脑缺血再灌注后再进行电针治疗,①在海马CA1,CA3,皮质区,脑缺血再灌组与正常对照组相比,Annexin A1和TRPM7共存表达升高分别是48.06%,50.19%,30.07%(P<0.05);②电针治疗组与脑缺血再灌组相比,Annexin A1和 TRPM7共存表达水平下降分别是34.88%,47.80%,41.96%(P<0.05)。经激光共聚焦的图像显示AnnexinA1和TRPM7蛋白共存表达及分布,分别计数每一个视野(4,000,000um2)中 CA1,CA3和皮质区阳性细胞数。结果①在海马CA1区,正常对照组、缺血再灌组、电针治疗组Annexin A1和TRPM7共存表达平均阳性细胞数分别为16.75±0.0189、32.25±0.0442、21,10±0.0316;②在海马CA3区,正常对照组、缺血再灌组、电针治疗组AnnexinA1和TRPM7共存表达平均阳性细胞数分别为20.05±0.0420、39.25±0.0262、20.75±0.0221;③在皮质区,正常对照组、缺血再灌组、电针治疗组AnnexinA1和TRPM7共存表达平均阳性细胞数分别为 25.00±0.0509、35.75±0.0591、20.75±0.2501。结果提示:①在脑缺血再灌注损伤中有可能TRPM7的α蛋白激酶磷酸化AnnexinA1后可以引起AnnexinA1功能上的一些改变;②电针对AnnexinA1和TRPM7异常表达的调节也可能通过同一途径。(如表3、图1~图3所示)
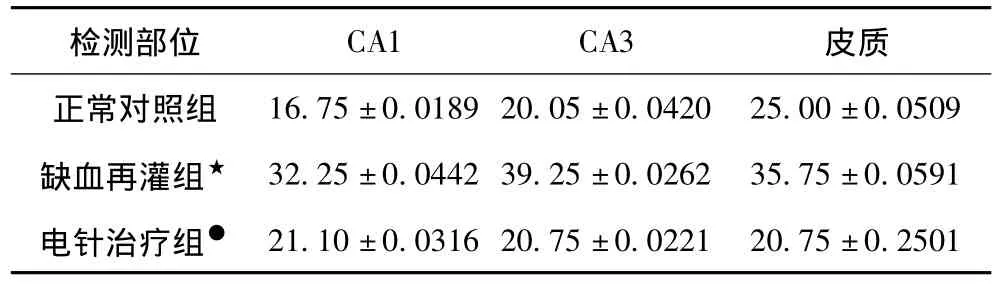
表3 电针治疗对缺血再灌注后AnnexinA1和TRPM7共表达的影响

图1 AnnexinA1和TRPM7共表达在海马CA1区共表达变化

图2 AnnexinA1和TRPM7共表达在海马CA3区共表达变化

图3 Annexin A1和TRPM7共表达在皮质区共表达变化
3.讨论
脑缺血再灌注损伤是指机体器官缺血一定时间后再恢复血流灌注,组织损伤反而进行性加重的病理生理过程。近年来研究发现,脑缺血再灌注使神经元产生损伤是一个快速的级联反应,这个级联反应包括许多环节,如能量障碍、细胞酸中毒、兴奋性氨基酸释放增加、N-甲基-D-天冬氨酸受体的过度激活、细胞内钙失稳态、自由基生成、凋亡基因激活等。这些环节互为因果,彼此之间相互关联、相互影响,最终通过多种因素共同作用导致神经元损伤。电针治疗脑中风有助于保护神经元,减少神经元凋亡而改善预后,对于探讨针灸治疗神经元凋亡机制提供新的途径。
海马是大脑对缺血、缺氧损伤最敏感的组织。由于海马CA1区与大鼠的学习和记忆功能有着密切的关系,因而用Morris水迷宫实验来检测脑缺血后大鼠的学习记忆功能的改变。神经细胞受到损伤,引起机能障碍,进而可使神经退变,学习记忆能力减退[4]。用定位航行实验主要以找到平台所用时间(逃避潜伏期)来衡量实验动物的学习能力,空间探索实验以穿越原平台次数(记忆频度)考察实验动物的记忆能力。本次实验水迷宫测试历时7天,定位航行实验中各组大鼠逃避潜伏期随训练次数的增多在不断缩短。各组在第1天显示出较强的学习能力,造模后缺血再灌组学习能力显著下降,电针治疗组与缺血再灌组相比学习能力均显著提高,说明电针可提高大鼠的学习能力。在定位航行实验结束后撤除平台,正常对照组、假手术组和电针治疗组大鼠搜寻目标的目的性较强,造模后在规定时间(120秒)内搜寻并穿越平台次数明显高于缺血再灌组,其中电针治疗组与缺血再灌组结果有显著性差异,说明电针能有效改善大鼠的记忆功能,提示电针有可能通过降低CA1区AnnexinA1和TRPM7表达,影响了大鼠的学习记忆能力。
近年来TRPM7的结构、功能、其通道活性的调节、其丝氨酸、苏氨酸激酶结构域的底物及TRPM7与各种疾病的关系已成为研究热点。TRPM7是一种具有丝氨酸、苏氨酸激酶结构域的特殊的阳离子通道蛋白。在大脑,TRPM7已被发现存在于海马和皮层神经元以及小胶质细胞中[5]。对大鼠和人TRPM7的研究表明,TRPM7是由7105个碱基对的转录物编码的含1863个氨基酸的的多肽链。其C端约347个氨基酸为丝氨酸、苏氨酸激酶区(accession number:AF149013)。该激酶区属于α-激酶家族成员,在氨基酸序列上与经典的丝氨酸、苏氨酸激酶不具同源性。此外,TRPM7的激酶区还含有与磷酸脂酶C-β及磷酸脂酶C-γ的C2结构域结合的区域。TRPM7的C端胞内区的丝氨酸、苏氨酸激酶可使自身和底物磷酸化,自身磷酸化发生在Ser1511和Ser1567两个位点而关于该激酶的底物正在研究当中。
AnnexinA1是分子量约37KDa结构相关的磷脂结合蛋白。膜上有高度保守的C-末端序列,由四个重复70个氨基酸组成。每个AnnexinA1的N-末端由44个氨基酸组成,含有蛋白激酶C、酪氨酸激酶磷酸化位点,以及糖基化、乙酰化和蛋白酶水解位点。AnnexinA1的氨基末端在 Thr24、Ser27、Ser28、Thr41有蛋白激酶C的磷酸化位点,Tyr21有表皮生长因子受体酪氨酸激酶的磷酸化位点,在Ser5上有一个目前还只被一个具有离子通道功能和α激酶功能的蛋白质TRPM7的α激酶磷酸化位点[1]。我们前期研究表明局灶性脑缺血再灌注损伤可诱导大鼠海马和皮层组织TRPM7的表达水平增加,而且电针治疗可抑制TRPM7的高表达[6]。某些蛋白激酶磷酸化AnnexinA1后可以引起AnnexinA1功能上的一些改变。最近一项研究表明AnnexinA1分子N端的Ser5残基可特异性地被TRPM7激酶磷酸化,而该部位磷酸化和AnnexinA1参与抗炎症反应,细胞生长、增殖、调亡等功能相关。有研究还显示,AnnexinA1在脑缺血再灌注中发挥着保护作用。但众多的资料显示AnnexinA1蛋白也介导了细胞凋亡。在本实验中发现脑缺血再灌注后AnnexinA1和TRPM7在海马和皮质明显表达上升;电针治疗后AnnexinA1和TRPM7的表达下降,提示AnnexinA1和TRPM7可能在脑缺血再灌注中不同部位发挥保护或损伤作用。海马是大脑内对缺血缺氧损伤最敏感的组织而且富含神经生长因子,在缺血缺氧条件下,神经生长因子可以通过激活靶细胞上的TrkA受体抑制TRPM7的高表达,减少TRPM7通道的数量,从而减少TRPM7对神经元的损伤。TRPM7是具有离子通道和α蛋白激酶双重功能的蛋白质,TRPM7的α蛋白激酶能够在Ser5上磷酸化AnnexinA1,引起AnnexinA1生物学功能的改变。在本实验研究中我们发现脑缺血再灌注后AnnexinA1和TRPM7的共表达上调,经电针治疗后AnnexinA1和TRPM7的共表达下调,提示电针治疗Annexin A1的表达调控可能是神经生长因子可以通过激活靶细胞上的TrkA受体抑制TRPM7的表达,进而调控AnnexinA1的表达。AnnexinA1的转位被认为是TRPM7的活化指标[7]。有研究显示:在遗传性镁血症的小鼠随着TRPM7的底物AnnexinA1表达的减少,镁离子转运体TRPM7的血管表达增加[8],磷酸化的AnnexinA1调节生成血管的效应是通过血管内皮细胞生长因子与p38/LIM激酶1轴的活化有关[9]。人胚肾母细胞瘤系293细胞TRPM7的超表达扩大在急性缺血缺糖和化学性缺血1小时后基础水平和增加的镁离子浓度,这暗示在大鼠海马神经元缺氧诱导镁离子浓度的增加是经TRPM7 通道[10]。
1 Dorovkov MV,Ryazanov AG.Phosphorylation of annexin I by TRPM7 channel- kinase[J].JBiol Chem,2004,279,50643-50646.
2 Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1998,20:84-91.
3 Morris R.Development of a water maze procedure for studying spatial learning in the rat[J].JNeurosci Methods,1984,11:47
4 Joshua A.Sonnen,John C.Breitner,Mark A.Lovell,etal.Free radical-mediated damage to brain in Alzheimer's disease and its transgenic mouse models[J].Free Radical Biology and Medicine,2008,45(3):219-230
5 Lipski J,Park TI,Li D,Lee SC,Trevarton AJ,Chung KKH,Freestone PS,Bai JZ.Involvement of TRP-like channels in the acute ischemic response of hippocampal CA1 neurons in brain slices[J].Brain Res,2006,1077:187-199.
6 Zhao L,Shi J,Sun N,Tian S,Meng X,Liu X etal.Effect of electroacupuncture on TRPM7 mRNA expression after cerebral ischemia/reperfusion in rats via TrkA pathway[J].JHuazhong Univ Sci Technolog Med Sci,2005,25:247-250.
7 Touyz RM,He Y,Montezano AC,Yao G,Chubanov V,Gudermann T,Callera GE:Differential regulation of transient receptor potential melastatin 6 and 7 cation channels by ANG II in vascular smooth muscle cells from spontaneously hypertensive rats[J].Am JPhysiol Regul Integr Comp Physiol,2006,290(1):R73-78.
8 Tamara M.Paravicini,Alvaro Yogi,etal.Dysregulation of Vascular TRPM7 and Annexin-1 Is Associated With Endothelial Dysfunction in Inherited Hypomagnesemia[J].Hypertension,2009,53:423-429.
9 Maxime C.C?té,Jessie R.Lavoie,etal.Regulation of vascular endothelial growth factor-induced endothelial cell migration by lim kinase 1-mediated phosphorylation of annexin 1[J].The Journal of Biological Chemistry,2010,285:8013-8021.
10 Jing Zhang,Fengbo Zhao,Yin Zhao,Jing Wang,Lei Pei,Ning Sun,and Jing Shi.Hypoxia Induces an Increase in Intracellular Magnesium via Transient Receptor Potential Melastatin 7(TRPM7)Channels in Rat Hippocampal Neurons in Vitro[J].J.Biol.Chem,2011,286:20194-20207.

