腹部结内淋巴瘤的超声诊断
王亚红,蔡 胜,王 蕾,张晓东,齐振红,徐钟慧,李建初
中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京100730
淋巴瘤是一组起源于淋巴结和/或结外淋巴组织的恶性肿瘤。近年来,淋巴瘤的发病率呈上升趋势,目前已成为我国十大恶性肿瘤之一。腹部淋巴结是淋巴瘤常见的受累部位[1],但以腹部包块或腹部淋巴结肿大起病时,往往与腹部其他肿瘤、淋巴结转移性肿瘤或其他疾病难以鉴别。本研究对41例以腹部包块或腹部淋巴结肿大起病的淋巴瘤患者资料进行分析,总结这类病例的临床及超声图像特点,以期提高诊断准确率。
对象和方法
对象选取我院1991至2011年收治的41例累及腹部淋巴结的淋巴瘤患者,其中男性18例、女性23例,年龄23~79岁,平均 (50.4±14.6)岁。以腹部包块起病者30例,以腹部淋巴结肿大起病者11例。均经病理证实,其中剖腹探查肿物活检27例、CT或超声引导下穿刺活检7例、浅表淋巴结活检7例。霍奇金淋巴瘤1例,为结节硬化型;非霍奇金淋巴瘤40例 (B细胞来源30例、T细胞来源5例、5例未分型)。全部病例均有术前超声检查资料。
方法回顾性分析41例累及腹部淋巴结的淋巴瘤患者的临床资料和声像图表现。超声检查仪器主要包括HDI5000(PhilipsMedicalSystems, Bothell, WA)、Logiq 7 及 Logiq 9(GE Medical Systems,Milwaukee,WI)。一般选用凸阵探头,频率2.0~5.0 MHz,体瘦、腹壁较薄的患者或肿大淋巴结位置较为表浅时,选用3.0~8.0 MHz的凸阵探头或5.0~10.0 MHz的线阵探头。患者均空腹8 h以上,必要时饮水以胃做为透声窗帮助显示腹腔干、肠系膜根部等淋巴结区域。患者取平卧位,必要时辅以侧卧位,并保持腹壁肌肉松弛。检查者适当加压腹壁,既可减少肠气干扰的影响,又可提高探头频率以改善分辨力。检查过程中,尽量充分显示腹膜后淋巴结区域,并对腹盆腔及腹膜后淋巴结区域进行完整扫查。根据超声资料,详细记录肿物的位置、数目、大小、形态、内部回声及与周边组织的关系等。进行彩色多普勒超声检查时,血流速度刻度范围设置在+5~-5 cm/s至+15~-15 cm/s,并尽量提高彩色增益,以血流清晰显示,又不出现明显的噪声信号为准。结合腹部淋巴结的解剖分布及超声显像特点,将腹部淋巴结分为4个区域[2]:腹腔淋巴结 (主要包括肝门、脾门、腹腔干淋巴结)、肠系膜淋巴结 (肠系膜上、下淋巴结)、腹膜后淋巴结 (腹主动脉周围、肾门、肾上腺区淋巴结)和盆腔淋巴结 (髂总、髂内、髂外淋巴结)。
结 果
临床表现及分期伴有腹痛、腹胀者20例;腹泻者2例;腰背部疼痛者3例;下肢浮肿者3例;伴有浅表淋巴结肿大者9例;伴有B组症状者17例 (有以下至少1个症状者称为B组症状:发热达38℃以上连续3 d、盗汗及6个月内体重减轻10%以上)。Ann Arbor分期:Ⅰ期2例、Ⅱ期3例、Ⅲ期8例、Ⅳ期25例、3例未分期。
实验室检查结果乳酸脱氢酶升高者17例 (17/33);β2微球蛋白升高者11例 (11/14);血沉加快者13例 (13/26);C反应蛋白或超敏-C反应蛋白增高者18例 (18/23);结核菌素试验阳性者2例 (2/17)。发现骨髓受累者2例 (2/21)。癌组织相关抗原异常者9例 (9/26),其中CA125升高者6例,CA19-9升高者3例。15例进行了自身免疫性抗体检测,结果均为阴性。
超声表现
单发包块型:共14例,占34.1%,均位于肠系膜根部或腹膜后。包块最大径5.6~28 cm,其中10例为巨块型 (>10 cm)。14例病灶中1例呈类圆形,5例呈分叶状,其余8例形态不规则。11例病灶边界清晰,3例呈弥漫性浸润,边界不清。所有病灶内部均呈低回声,回声不均者11例,其中7例病灶内部可见不规则纤细高回声带,将肿物分隔成网格状。2例病灶后方回声增强,其中1例表现为边界规整的类圆形低回声肿物 (图1);另1例病灶回声极低,似无回声的囊性肿物。14例病灶中共10例进行了彩色多普勒超声 (简称彩超)检查,其中6例病灶血流信号丰富 (血管数≥4条,或相互连通、交织成网),3例病灶内仅探及少许血流信号 (血管数≤3条),1例病灶内部未探及血流信号。在9例可探及血流的病灶中,1例病灶内血流呈典型门型分布 (图1),表现为粗大的主干血流穿入肿物内部,并向外周发出分支,呈树枝状或放射状,其余病灶内门型血流不典型或血流分布不规则。7例伴有内部分隔的病灶中,5例进行了彩超检查,均可探及沿分隔处走行的血流信号。2例出现“血管包绕征”,表现为肿物包裹肠系膜血管或腹主动脉、下腔静脉,受累血管无明显移位 (图2);另有3例出现病变部位血管管腔受压而未受包绕,其中1例为门脉、腹腔干及肠系膜上动静脉受压,1例为下腔静脉受压,1例为左肾静脉受压并移位。2例病灶包裹并侵犯小肠,导致肠管壁节段性增厚,回声减低,与病灶分界不清 (肠管包绕征)。另有2例伴有右肾积水,3例伴有腹水。
多发结节型:共27例,占65.9%,其中最大结节长径<5 cm者12例,5~10 cm者12例,>10 cm者3例。结节多呈区域性分布,其中累及腹膜后淋巴结者21例,主要位于腹主动脉周围;累及肠系膜淋巴结者13例;累及腹腔淋巴结者9例;累及盆腔淋巴结者8例。出现腹腔、腹膜后及盆腔淋巴结广泛受累,呈弥漫性分布者2例。超声典型表现为多个边界清晰的类圆形低回声,边界规整,内部回声均匀。结节呈聚集分布时,可呈现“鹅卵石征”(图3)。而结节相互融合时,多呈不规则形或分叶状。9例患者的最大病灶内部可见纤细分隔,这些病灶最大径均>5 cm。1例病灶内部出现不规则液化坏死区。另有1例内部可见点状、斑块状强回声,部分伴声影,病理证实为钙化。本组病例共18例进行了彩超检查,并记录了最大病灶内部的血流分布情况。其中8例最大病灶内部血流信号丰富,为短条状,呈门型或不规则分布;5例病灶内部见少许血流信号,其余5例未探及血流信号。本组3例出现“血管包绕征”,其中1例包绕下腔静脉、腹主动脉中远段及双侧髂总动静脉;1例包绕下腔静脉及腹主动脉;1例包绕肠系膜上、下动静脉。另有3例出现血管腔受压但无包绕,分别为腹主动脉、左肾静脉受压移位及下腔静脉受压变形、无移位。2例伴有邻近肠管受累,4例伴有肾积水,10例伴有腹水。
讨 论
腹部结内淋巴瘤可单纯累及腹部淋巴结,也可为系统性淋巴瘤的一部分。病理上,绝大多数为非霍奇金淋巴瘤。本病起病隐匿,多无特异性临床表现,因此患者就诊时往往已出现腹部较大包块或多部位淋巴结肿大。受累的淋巴结以腹膜后、肠系膜区最为多见[2]。
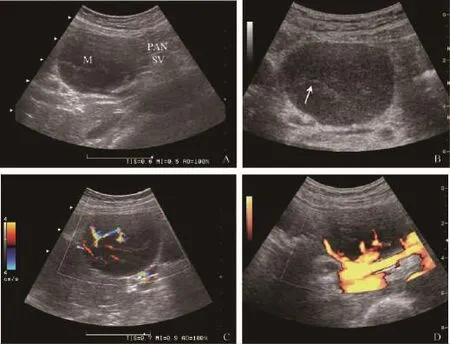
图1 腹部结内淋巴瘤 (单发包块型,非霍奇金淋巴瘤,探头频率5.0 MHz)Fig 1 Lymphoma in abdominal lymph nodes(solitary mass type,non-Hodgkin lymphoma,with transducer frequency of 5.0 MHz)
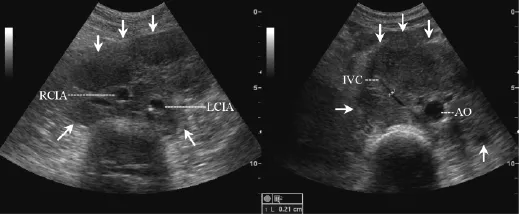
图2 腹部结内淋巴瘤 (单发包块型,非霍奇金淋巴瘤),巨大肿物 (箭头)包绕腹主动脉、下腔静脉及双侧髂血管生长,形成“血管包绕征”,下腔静脉管腔受压明显变窄,腹主动脉及双侧髂总动脉管腔形态无明显改变Fig 2 Lymphoma in abdominal lymph nodes(solitary mass type,non-Hodgkin lymphoma),ultrasonography shows the aorta,inferior vena cava and iliac vessels were embedded by a huge mass(arrows),forming“vessels-embedded sign”,the luminal diameter of inferior vena cava was distinctly reduced

图3 腹部结内淋巴瘤 (多发结节型,非霍奇金淋巴瘤),腹腔及腹膜后多发类圆形低回声结节,密集分布,呈“鹅卵石征”(箭头)Fig 3 Lymphoma in abdominal lymph nodes(multiple nodular type,non-Hodgkin lymphoma):ultrasonography shows multiple,round-like,enlarged lymph nodes in the intra-and retroperitoneal regions,forming the characteristic“cobblestone sign”(arrows)
基于以下考虑,本研究将腹部结内淋巴瘤超声特征分为两型:单发包块型及多发结节型。多发结节型超声表现较为典型,诊断相对容易;而单发包块型多呈不典型超声表现,易与腹部多种疾病相混淆,超声误诊的病例绝大多数属于此类型,因此将其单独提出,有助于对该病的全面认识。目前尚未检索到对腹部结内淋巴瘤进行超声分型的文献报道,有研究将其进行了CT影像学分型[3],分为单发包块型、多发结节型及弥漫型,其中弥漫型指淋巴瘤累及所有腹腔及腹膜后淋巴结区域。但是,有时由于肥胖、肠气等影响,超声对于腹部淋巴结区域的检查受限,往往不能将每处病灶都充分显示,因而本研究未将2例弥漫型单独分出,而是统归于多发结节型。
本研究单发包块型多表现为形态不规则的低回声包块,可呈分叶状,内部回声不均,术中显示往往由于多个淋巴结相互浸润、黏连及融合所致,而较少表现为单发淋巴结肿大所致的类圆形低回声包块。
包块内部有时可见不规则线状或网状分隔,以后者多见。与淋巴结融合时残留的包膜回声不同,这种分隔纤细,走行平直,可能由肿瘤的纤维结缔组织等间质成分构成,而间质区多伴有血管走行,故彩超检查时往往能观察到沿分隔处走行的血流信号。这种分隔在多发结节型的病灶内也可观察到,而当淋巴瘤累及浅表部位淋巴结时,由于探头分辨力更高而显示的更为清晰[4]。
当单发包块型淋巴瘤压迫、浸润周围器官时,应与该器官的原发肿瘤相鉴别。本研究2例出现“肠管包绕征”,其中1例同时伴有肝内外胆管扩张、胰管扩张及胆囊增大,而误诊为十二指肠来源肿瘤,但是,这2例病灶的瘤体大部分位于肠管壁外的肠系膜区,伴有周边组织的广泛浸润,病灶巨大 (均>10 cm)而肠道相关症状不明显,与肠道原发淋巴瘤有所不同[5]。另有3例病灶与胰腺紧邻,胰头部受压,而胰管无扩张,其中1例回声极低,似囊性肿物,边界清晰,内部可见网状分隔;1例包绕肠系膜血管及部分下腔静脉、腹主动脉,形成血管包绕征;另1例呈边界清晰的类圆形低回声(图1),内部可见分隔及门型血流,这3例均符合结内淋巴瘤的特征。而胰腺癌边界不清,形态不规则,多伴有胰管扩张及CA19-9的升高。胰腺原发淋巴瘤也可不伴胰管扩张,但该病罕见,形态不规则,少有周边大血管的侵犯[6]。
单发包块型还应与腹膜后纤维化相鉴别,后者常出现血管包绕征,但其病灶呈弥漫性分布的均匀低回声,很少呈融合性或分叶状,内部多无血流信号显示[7],而且病变主要集中在肾动脉至髂动脉水平的腹膜后区域。而淋巴瘤病灶部位更集中于腹主动脉中上段[8],病灶内可见血流信号,甚至能探及丰富血流。
多发结节型的典型超声表现为多个边界清晰的类圆形低回声,呈散在或聚集性分布 (鹅卵石征)。由于肿瘤内部细胞成分多、排列均匀密集,界面声阻抗差小,故病灶内部回声低但均匀,少数病灶甚至呈均质的低至无回声区伴后方回声增强,似囊性结构[9-10]。但是随着超声仪器分辨力的提高,这种假囊性征象较为少见,对于回声极低的淋巴瘤,提高增益有助于与囊性肿物鉴别,必要时可辅以彩超检查。多个结节可相互融合,甚至形成巨大包块,此时内部回声多不均匀,但少有钙化、坏死及囊性变[6,11]。本研究出现坏死液化及钙化的病例各有1例。
多发结节型应与以下疾病相鉴别。(1)淋巴结转移性肿瘤:有原发病史及相应肿瘤标记物异常,受累淋巴结主要位于原发灶周围淋巴引流区,其回声特点与原发灶相似。而由于病理特点的差异,淋巴瘤的回声水平更低,同时可伴有纤细分隔。(2)淋巴结结核:多累及肠系膜区,融合现象更多见。受累淋巴结回声多样,常见钙化及液化坏死。当合并结核性腹膜炎时,可伴肠系膜及大网膜的增厚、回声减低[12],同时,由于纤维素的渗出、黏连,腹水内部往往可见杂乱分隔。结核菌素试验可呈阳性。
淋巴瘤病灶内血流信号的多少及分布各有不同,与仪器的敏感性、病灶的大小、部位等因素有关,以门型血流较具特异性[4,13]。但由于瘤细胞对淋巴结的破坏,典型门型血流较少见,往往伴有血管受压扭曲、血流分布不均 (局部血流信号丰富或缺失)及包膜下血流等[14]。
综上,无论单发包块型,还是多发结节型,超声检查均有助于腹部结内淋巴瘤的诊断,同时还可评估受累区域及病灶特征,为临床分期及治疗提供依据。对于较为典型的腹部结内淋巴瘤,尤其是多发结节型,超声能够做出明确诊断。对于不典型的淋巴瘤,需要仔细观察肿瘤的声像图特点,并结合临床及实验室检查,以提高诊断准确性。鉴别困难时,可行其他影像学检查或穿刺活检。
[1]孙燕.内科肿瘤学[M].北京:人民卫生出版社,2001:824.
[2]吴宁,刘瑛,林冬梅,等.中国人非霍奇金淋巴瘤侵犯腹部和盆腔淋巴结的病变分布 [J].中华肿瘤杂志,2002,24(6):580-584.
[3]Yu RS,Zhang WM,Liu YQ.CT diagnosis of 52 patients with lymphoma in abdominal lymph nodes [J].World J Gastroenterol,2006,12(48):7869-7873.
[4]Ahuja AT,Ying M,Ho SY,et al.Ultrasound of malignant cervical lymph nodes[J].Cancer Imaging,2008,25(8):48-56.
[5]Ghai S,Pattison J,Ghai S,et al.Primary gastrointestinal lymphoma:spectrum of imaging findings with pathologic correlation [J].Radiographics,2007,27(5):1371-1388.
[6]Lin H,Li SD,Hu XG,et al.Primary pancreatic lymphoma:report of six cases [J].World J Gastroenterol,2006,12(31):5064-5067.
[7]张璟,姜玉新,孙惠文,等.特发性腹膜后纤维化的超声诊断 [J].中国医学影像技术,2006,22(7):1058-1060.
[8]曹晓林,韩治宇,范瑾,等.超声检查在特发性腹膜后纤维化诊断治疗中的应用价值[J].中国超声医学杂志,2008,24(4):376-379.
[9]Kaude JV,Joyce PH.Evaluation of abdominal lymphoma by ultrasound [J].Gastrointest Radiol,1980,5(3):249-254.
[10]周琛云,彭玉兰,蔡迪明.腹膜后非霍奇金淋巴瘤的超声图像特点分析[J].华西医学,2006,21(4):714-715.
[11]Apter S,Avigdor A,Gayer G,et al.Calcification in lymphoma occurring before therapy:CT features and clinical correlation [J].Am J Roentgenol,2002,178(4):935-938.
[12]Jain R,Sawhney S,Bhargava DK,et al.Diagnosis of abdominal tuberculosis:sonographic findings in patients with early disease [J].AJR Am J Roentgenol,1995,165(6):1391-1395.
[13]Hosaka S,Watanabe M,Matsuzawa K,et al.Mesenteric malignant lymphoma detected with routine color Doppler ultrasonography [J].Intern Med,2003,42(6):500-502.
[14]Neumann-Silkow H,Görg C.Differentiation of abdominal lymphadenoptahy with power Doppler sonography [J].Rofo,2010,182(3):229-234.

