新型(4R,5R)-2-苯基-1,3-二氧戊环-4,5-二(2-吡啶甲氧基)甲烷的合成*
姜 艳, 杜晓莹, 卞 静, 王丽丽, 孙小强
(常州大学 江苏省精细石油化工重点实验室,江苏 常州 213164)
在手性合成领域中,采用手性催化剂进行不对称催化反应是近年来进展最快的手性合成方法[1]。不对称催化合成的关键是手性配体的结构,一般应具有配位原子,并且同中心金属络合作用强等特点。吡啶是一类非常重要的杂环,拥有很好的螯合金属的能力,有较强的反应活性,能作为桥连基,与手性源反应形成一类有结合腔的手性配体。
本文设计并合成了一种以L-酒石酸为手性源的具有C2-对称轴吡啶衍生物手性配体——(4R,5R)-2-苯基-1,3-二氧戊环-4,5-二(2-吡啶甲氧基)甲烷(4, Scheme 1),其结构经1H NMR和MS表征。
4是一种含吡啶环的新型手性多齿配体,期待其中的多个O, N杂原子能与金属配位[2],形成手性配合物,能选择性的催化一些不对称反应。
1 实验部分
1.1 仪器与试剂
LS-2型显微熔点仪(温度未经校正);Perkin Elmer 141型旋光仪;Bruker ARX-500 MHz核磁共振仪(CDCl3为溶剂,TMS为内标);岛津LCMS-2010 EV型质谱议。
1 2
3 4
Scheme1
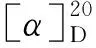
1.2 合成
(1) (4R,5R)-1,3-二氧戊环-2-苯基-4,5-二羧酸二甲酯(2)的合成
在带分水器的干燥三口烧瓶中加入119.0 g(86.36 mmol),苯甲醛13.6 g(128.00 mmol), NaHSO40.154 g(1.28 mmol)和甲苯70 mL,搅拌下回流反应至无水分出。加水50 mL,分液,水层用二氯甲烷(3×30 mL)萃取,合并有机层,旋蒸脱溶后用乙酸乙酯重结晶得淡黄色固体218.0 g,收率79%, m.p.80.3 ℃~82.6 ℃;1H NMRδ: 7.57~7.59(m, 2H, PhH), 7.39~7.42(m, 3H, PhH), 6.15(s, 1H, PhCH), 4.98~4.99(d,J=5.0 Hz, 1H, CH), 4.86~4.87(d,J=5.0 Hz, 1H, CH), 3.87(s, 3H, CH3), 3.83(s, 3H, CH3)。
(2) (4R,5R)-1,3-二氧戊环-2-苯基-4,5-二乙醇(3)的合成[4]
在干燥三口烧瓶中加入LiAlH45.7 g(146 mmol)的THF(10 mL)溶液,搅拌下于0 ℃滴加215.0 g(56 mmol)的THF(50 mL)溶液,滴毕,回流反应2 h。加水10 mL,用乙酸乙酯(3×30 mL)萃取,合并萃取液,旋蒸除去大部分溶剂后经硅胶柱层析分离[洗脱剂:A=V(乙酸乙酯) ∶V(石油醚)=1 ∶3]得白色固体38.0 g,收率56%, m.p.57.4 ℃~58.2 ℃;1H NMRδ: 7.42(s, 2H, PhH), 7.38~7.41(m, 3H, PhH), 5.98(s, 1H, PhCH), 4.16~4.21(m, 2H, CH), 3.77~3.91(m, 4H, CH2), 1.66(s, 2H, OH)。
(3)4的合成
在三口烧瓶中加入30.4 g(1.90 mmol), NaH 0.9 g(37.50 mmol)的THF(15 mL)溶液,搅拌10 min;加入溴甲基吡啶溴酸盐1.04 g(5.93 mmol),反应至终点(TLC跟踪)。过滤,滤液经硅胶柱层析(洗脱剂:A=1 ∶1)分离得黄色液体40.5 g,产率63%, [α] +1.8°(c0.1, CH2Cl2);1H NMRδ: 8.54(s, 2H, PyH), 7.64~7.71(m, 2H, PyH), 7.50~7.72(m, 2H, PhH), 7.42~7.47(dd,J=17.5 Hz, 7.8 Hz, 2H, PyH), 7.36~7.37(m, 3H, PhH), 7.17~7.21(dd,J=12.2 Hz, 5.2 Hz, 2H, PyH), 6.00(d, 1H, PhCH), 4.73~4.75(d,J=10.2 Hz, 4H, PyCH2), 4.37~4.39(m, 2H, CH), 3.80~3.85(m, 4H, CH2);13C NMRδ: 157.2, 157.1, 148.0, 136.4, 135.7, 135.6, 128.3, 127.2, 125.7, 121.4, 120.3, 103.2, 73.4, 70.2, 70.1; MSm/z: 393.2{[M+1]+}。
2 结果与讨论
Hiyoshizo Kotsuki等[4]报道了以酒石酸为手性源合成含吡啶的手性配体,用来催化苯甲醛与二乙基锌的不对称加成反应。本文设计并合成的配体4的结构与其比较有以下三点变化: (1)引入了两个氧原子使得金属在空腔内更容易配位; (2)缩短了吡啶环与手性碳的空间位置从而增大了整个分子的刚性; (3)合成方法更加简便廉价,为其在工业生产中的应用提供了一定的基础。
由1合成2时,采用NaHSO4作催化剂,相对于磷钨酸、对甲基苯磺酸等催化剂来说,后处理简单且产率更高。
合成3时,考虑到乙醚的沸点低,反应难以完全,转化率太低;改用严格除水的THF为溶剂比较好,转化率高,而且后处理十分简单,产率高。
合成4所用的碱很重要,尝试了用碳酸钠或碳酸钾作缚酸剂,发现延长反应时间或提高温度始终都有单取代产物生成,而且单取代化合物之间的关系是一对非对映异构体(与苯环相连的碳是一个潜手性碳,吡啶环和苯环的空间位置不同,化合物的极性不同),分离有难度。以氢化钠作缚酸剂,先生成醇钠,顺利得到双取代产物4,提高了产率。
[1] Guo Q S, Liu B, Lu Y N,etal. Synthesis of 3 or 3,3′-substituted BINOL ligands and their application in the asymmetric addition of diethylzinc to aromatic aldehydes[J].Tetrahedron:Asymmetry,2005,16(22):3667-3671.
[2] Yosuke T, Hisanaka I, Mineki H. Catalytic enantioselective [2+2]-cycloaddition reaction of 2-methoxycarbonyl-2-cyclop enten-1-one by chiral copper catalyst[J].Tetrahedron,2006,62(14):3380-3388.
[3] Tapasi C, Subhagata C. A simple,convenient and expeditious route to methyl esters of carboxylic acids by thionyl chloride-methanol[J].Oriental Journal of Chemistry,2002,18(2):187-190.
[4] Takashi T, Yukishige I. Concise syntheses of immunostimulating glycolipids, a-galactoaylceramides[J].Tetrahedron Letters,2007,48(31):5513-5516.
[5] Hiyoshio K, Yuichi N, Narimasa M,etal. A novel synthesis of optically activeC2-symmetric pyridine derivatives efficient reaction of chiral triflates with 2-picolyllithium reagents[J].Tetrahedron:Asymmetry,1995,6(5):1165-1174.

