戊二醛对原子力显微镜观测大肠杆菌的影响
杨浩,李菊,吕中,赵慧平,陈嵘
(武汉工程大学绿色化工过程教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430073)
0 引言
细菌的形貌通常会随着环境的变化而发生改变,因此对细菌形貌的观测是研究细菌行为的基础[1-3].为了准确观测不同的细菌,人们已采用各种固定方法对生物细胞进行固定[4-6].细胞固定的作用主要是防止细胞的分解,保持细胞的组成和形貌,并获得清晰的微观结构[7-8].常用的固定剂包括戊二醛、甲醛和低聚甲醛,它们与生物细胞中的蛋白质会产生共价化学键,起到交联作用,从而保存天然的蛋白质结构[4,9].
原子力显微镜(AFM)自1986年发明以来已被广泛用在生物科学领域[10-12].与传统的电子显微镜相比,AFM能在空气或液相中对样品成像,获得纳米级别的三维图像,使生物细胞表面形貌的定量分析成为了可能[13].一些前期工作报道了用AFM观测不同固定剂对细菌表面形貌的影响[6,14],然而关于戊二醛在AFM观测大肠杆菌中的作用还没有系统研究.
本文中主要探讨戊二醛的浓度和固定时间对AFM图像以及大肠杆菌形貌的影响.一方面定性分析不同固定条件下所得到的AFM图像质量的好坏,包括假像的产生和图像的清晰度等;另一方面定量分析不同条件下大肠杆菌形貌的几何参数,包括细胞的长度、宽度和高度,并引入长宽比和宽高比对细胞形貌的变化进行评价.
1 实验部分
1.1材料与仪器大肠杆菌(CCTCC AB 90054),由华中师范大学生命科学学院提供.将大肠杆菌接种于LB液体培养基中,在37 ℃,150 r/min下震荡培养12 h(对数生长期),然后吸取一定量的原始菌液,稀释至OD660值为0.068~0.075.戊二醛购于国药集团化学试剂有限公司,分析纯.
实验仪器采用美国Veeco公司生产的Multimode型AFM.扫描采用RTESP型硅探针(Veeco),共振频率为235~287 kHz,弹性指数为20~80 N/m,针尖曲率半径8 nm,正面角(15±2)°.大肠杆菌的形貌同时采用Hitachi S224800型扫描电子显微镜进行观测.
1.2 实验方法
1.2.1 样品的固定 采用盖玻片作为AFM测试的基底.盖玻片分别经丙酮和无水乙醇超声清洗10 min,然后浸泡在无水乙醇中待用.固定前先用氮气将盖玻片表面吹干,然后用PBS缓冲液将菌液冲洗、离心两次,并重新分散在无菌水中,以避免PBS在空气中干燥时产生结晶.移取20 μL的菌液滴在盖玻片上,自然晾干,然后将盖玻片浸入不同浓度的戊二醛PBS溶液中,固定一段时间后用无菌水冲洗表面未反应的戊二醛和PBS缓冲液,并将盖玻片放置于无菌处自然干燥.
1.2.2 表面形貌观测及分析 AFM测量采用轻敲模式在空气中对大肠杆菌进行扫描.初始扫描范围为10 μm×10 μm,在此范围内观察AFM图像质量及是否出现假像,然后缩小扫描范围为2 μm×2 μm,观测细胞表面的微观结构.记录下AFM振幅(amplitude)图和高度(height)图.振幅图用来定性分析细胞表面特征以及产生的假像,而高度图用来定量分析大肠杆菌表面形貌参数.所有的图像和分析通过AFM自带的软件Nanoscope Ⅲa(版本号5.31r1)进行处理.大肠杆菌表面形貌参数的测定是选取10~20 个细菌的统计结果.扫描电子显微镜(SEM)测试前对大肠杆菌采用2.5%戊二醛固定15 min,然后进行漂洗、90%乙醇脱水、临界干燥,最后喷金后再进行观测.
2 结果与讨论
2.1AFM假像分析在AFM观测生物样品时难以避免的是产生假像.假像可由固定工艺或因AFM扫描不当而产生.固定工艺产生的假像包括结晶、碎片和细胞萎缩,而AFM扫描不当则会使图像出现条纹、失真或者饱和.结晶经常在扫描图中出现,并对细胞观测和高度分析产生影响,因而需尽量减小结晶的产生.实验对戊二醛和PBS缓冲液在玻片上形成的薄膜分别进行了扫描(图1),以确定结晶的来源.从图中可知,戊二醛对扫描图像几乎没有影响(图1(a)),而PBS缓冲液扫描出的图像模糊不清,图像出现失真和饱和(图1(b)),并且部分区域根本无法进行扫描,说明PBS缓冲液在干燥过程中产生了结晶,使表面凹凸不平,导致探针出现振荡或无法下针.因此,实验在样品干燥前需用无菌水对样品进行充分洗涤,以确保不产生PBS结晶.

图1 戊二醛(a)和PBS缓冲液(b)薄膜的AFM图
传统的固定剂主要适用于电子显微镜,在电子显微镜中由固定剂产生的一些碎片是透明的,而AFM是通过探针在样品表面的扫描来获得图像,因此透明的碎片在AFM中将显现出来,影响图像的观测[6].另一种产生碎片的原因是由于样品在最后清洗的时候没有洗干净,导致培养基中的一些组分残留在细胞表面,如图2(a1)中箭头所指,这些碎片一般可通过加强后期的洗涤效果即可避免.
AFM图像出现条纹可能是由于细胞表面残留的戊二醛使探针与细胞之间产生较大粘附力,探针接触到细胞表面后难以脱离,从而使探针发生振荡[15],如图3(b2)和(c2)中箭头所指.实验采用E型扫描器,垂直扫描范围在2.5 μm以内,因此当样品高度超过2.5 μm时,图像将出现饱和现象.部分样品在扫描过程中出现饱和,此时可降低菌液浓度或更换扫描区域再进行扫描,即可得到正常的AFM图像.
细胞萎缩使观测到的图像反映不了在生理条件下细胞的真实形貌和大小.当细胞脱离液体时,细胞由于干燥而脱水,使饱满的胞体收缩变小,而采用戊二醛固定的作用就是要防止细胞过度收缩.下面将从细胞的三维尺寸定量分析不同固定条件对细胞萎缩产生的影响.
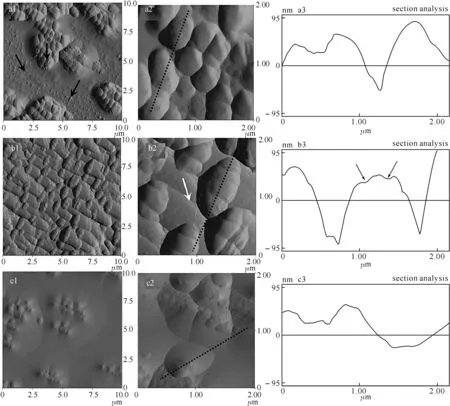
图2 戊二醛体积分数为1.0%(a)、2.5%(b)和5.0%(c),固定时间为10 min时大肠杆菌的AFM图第1、2列为AFM振幅图,扫描范围分别为10 μm×10 μm和2 μm×2 μm;第3列为图中虚线处的剖面图分析.
2.2戊二醛浓度的影响在固定时间为10 min,不同戊二醛浓度下得到的AFM图像明显不同.如图2所示,体积分数在1%和2.5%时得到的AFM图像清晰可见,特别是在2.5%时可以观察到大肠杆菌的鞭毛(图2(b2)箭头所示).鞭毛是大肠杆菌的微观结构,通常可用鞭毛的检测来评价AFM对微生物细胞观测的精度[16].而当体积分数增大到5%时,大肠杆菌发生了较严重的宽化,图像变得模糊,细胞的鞭毛也消失不见.对不同体积分数下大肠杆菌表面形貌分析后可知(见表1),2.5%体积分数下得到的大肠杆菌长度和高度最大,分别为1 047和147 nm.而体积分数为1%的大肠杆菌长宽比和宽高比与2.5%的相差不大,只是整体尺寸较小,说明在戊二醛体积分数较小时细胞发生了脱水萎缩.从剖面图分析来看,1%体积分数下的大肠杆菌细胞表面较光滑,而2.5%体积分数下的大肠杆菌细胞表面发生了轻微的皱褶(图2(b3)中箭头所指),说明戊二醛虽可抑制大肠杆菌脱水萎缩,但也会引起表面结构发生变化.综合以上因素,最终选取戊二醛的体积分数为2.5%,此时不仅细胞收缩较小,而且还可观测到表面的微观结构.
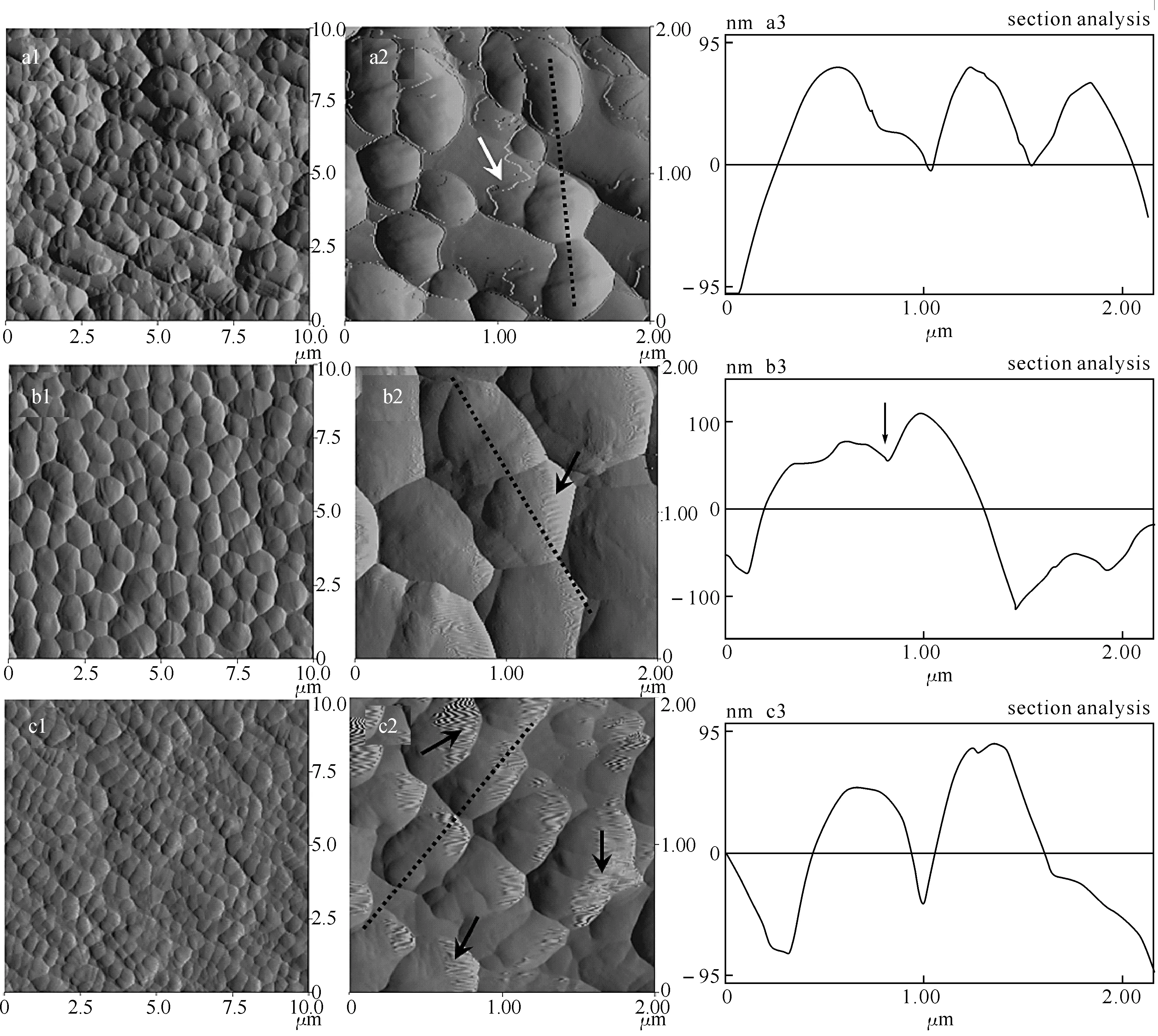
图3 戊二醛体积分数为2.5%,固定时间为5 min(a)、15 min(b)和720 min(c)时大肠杆菌的AFM图第1、2列为AFM振幅图,扫描范围分别为10 μm×10 μm和2 μm×2 μm;第3列为图中虚线处的剖面图分析.
2.3固定时间的影响在戊二醛体积分数为2.5%,不同固定时间得到的AFM图像如图3所示.当固定时间为5 min时,AFM图像较清晰,细胞轮廓分明,且鞭毛也较10 min明显(图3(a2)中箭头所指).当固定时间为15 min时,图像开始出现条纹,鞭毛消失不见,并且当固定时间继续延长至720 min时图像出现大面积的条纹,这时已很难观察到细胞的表面微观结构.对大肠杆菌形貌进一步分析发现(表1),不同固定时间所得到的大肠杆菌长宽比在1.6左右,而宽高比除了5 min扫描得到的样品以外,其余都在3.5附近,说明固定时间不够容易使细胞的高度降低.从细胞尺寸来看,15 min得到的大肠杆菌尺寸最大,其余的样品都有不同程度的萎缩.从剖面图来看,固定时间较短时细胞表面较光滑(图3(a3)),而其余样品都有轻微皱褶.图3(b3)中出现的明显凹陷是在细胞的中部,这是由细胞分裂所产生的,而非表面皱褶.通过以上分析可知,戊二醛的固定会同时影响细胞表面的微观结构和形貌大小:固定时间较短时细胞表面光滑,可观测到鞭毛等微观结构,但细胞会脱水收缩;固定时间较长时,细胞形貌保存较完整,但由于表面富集过多的戊二醛使AFM探针与细胞表面作用力增强,表面出现条纹和皱褶.因此,可针对不同的实验要求对样品分别进行处理.

表1 大肠杆菌的表面形貌分析
为了证实AFM图像的准确性,实验对大肠杆菌进行SEM扫描.SEM样品固定采用2.5%戊二醛,固定时间15 min,然后用90%乙醇进行脱水、干燥,所得到的形貌如图4所示.从图4可知,大肠杆菌呈短杆状,杆的两端为半圆形,中间有明显的界线。整个细胞长为1 086 nm,宽为652 nm,长宽比为1.67,与相同固定条件下AFM图像相比,长宽比相近,而尺寸略有减小,这是因为在SEM扫描前还对细胞进行了脱水处理,使细胞收缩所致.此外,AFM图像可直接观测到细胞表面微观结构(如鞭毛),分辨率较SEM图像高,且AFM可对细胞的高度进行测量,而SEM无法直接观测到高度的变化.

图4 大肠杆菌的SEM图
3 结论
采用AFM对大肠杆菌扫描时,合适的固定条件和工艺是得到最佳图像和真实形貌的前提.样品处理过程中要避免PBS结晶对AFM图像的影响.本实验中戊二醛的最佳体积分数为2.5%,固定时间则对细胞的表面微观结构和形貌大小产生影响.若要观测细胞表面的微观结构可减少戊二醛的作用时间,而要得到真实细胞的大小固定时间选在10~15 min为宜.在戊二醛体积分数为2.5%,固定时间为15 min时,此时AFM扫描所得到的大肠杆菌形貌与SEM的相似.通过比较AFM图像和SEM图像发现,AFM图像分辨率更高,可观测到细胞表面的微观结构,而且AFM可对细胞的高度进行测量,在定量分析上比SEM更具优势.
[1] Chatterjee A K, Sarkar R K, Chattopadhyay A P, et al. A simple robust method for synthesis of metallic copper nanoparticles of high antibacterial potency againstE.coli[J]. Nanotechnology,2012,23(8):085103.
[2] Young K D. Bacterial morphology: why have different shapes?[J]. Curr Opin Microbiol,2007,10(6):596-600.
[3] Andre G, Kulakauskas S, Chapot-Chartier M-P, et al. Imaging the nanoscale organization of peptidoglycan in livingLactococcuslactiscells[J]. Nat Commun,2010,1:27.
[4] Meade A D, Clarke C, Draux F, et al. Studies of chemical fixation effects in human cell lines using Raman microspectroscopy[J]. Anal Bioanal Chem,2010,396(5):1781-1791.
[5] Kailas L, Ratcliffe E C, Hayhurst E J, et al. Immobilizing live bacteria for AFM imaging of cellular processes[J]. Ultramicroscopy,2009,109(7):775-780.
[6] Moloney M, McDonnell L, O’Shea H. Atomic force microscopy of BHK-21 cells: an investigation of cell fixation techniques[J]. Ultramicroscopy,2004,100(3/4):153-161.
[7] Paavilainen L, Edvinsson A, Asplund A, et al. The impact of tissue fixatives on morphology and antibody-based protein profiling in tissues and cells[J]. J Histochem Cytochem,2010,58(3):237-246.
[8] Braet F, Rotsch C, Wisse E, et al. Comparison of fixed and living liver endothelial cells by atomic force microscopy[J]. Appl Phys A-mater.,1998,66:S575-S578.
[9] Francis L W, Gonzalez D, Ryder T, et al. Optimized sample preparation for high-resolution AFM characterization of fixed human cells[J]. J Microsc,2010,240(2):111-121.
[10] Kuznetsov Y G, McPherson A. Atomic force microscopy in imaging of viruses and virus-infected cells[J]. Microbiol Mol Biol R,2011,75(2):268-285.
[11] Scheuring S, Dufrene Y F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution[J]. Mol Microbiol,2010,75(6):1327-1336.
[12] Hansma H G, Pietrasanta L. Atomic force microscopy and other scanning probe microscopies[J]. Curr Opin Chem Biol,1998,2(5):579-584.
[13] Gaboriaud F, Dufrene Y F. Atomic force microscopy of microbial cells: application to nanomechanical properties, surface forces and molecular recognition forces[J]. Colloids Surf B,2007,54(1):10-19.
[14] Chao Y, Zhang T. Optimization of fixation methods for observation of bacterial cell morphology and surface ultrastructures by atomic force microscopy[J]. Appl Microbiol Biot,2011,92(2):381-392.
[15] Braet F, Seynaeve, De Z, et al. Imaging surface and submembranous structures with the atomic force microscope: a study on living cancer cells, fibroblasts and macrophages[J]. J Microsc,1998,190(3):328-338.
[16] Touhami A, Jericho M H, Boyd J M, et al. Nanoscale characterization and determination of adhesion forces ofPseudomonasaeruginosaPili by using atomic force microscopy[J]. J Bacteriol,2006,188(2):370-377.

