水中苯氧羧酸类除草剂的液相色谱-串联质谱测定方法研究
张蓓蓓,章 勇,赵永刚,胡冠九,陈素兰
(江苏省环境监测中心 国家环境保护地表水环境有机污染物监测分析重点实验室,江苏 南京 210036)
苯氧羧酸类除草剂是第一类投入商业生产的选择性除草剂。苯氧基醇类除草剂主要用作茎叶处理剂,施用于禾谷类作物田、针叶树林、非耕地、牧草场、草坪等,防除一年生和多年生的阔叶杂草,大多数阔叶作物,特别是棉花和葡萄等对这类除草剂很敏感。苯氧羧酸类除草剂易溶于水中,因此会在农田生态系统中迁移,引起土壤、地下水、大气等污染。这类除草剂本身有中等毒性,其代谢产物(特别是一些卤化物)也会对人类和生物体造成危害,研究表明其可以引起人类软组织恶性肿瘤,对动物体表现出胎盘毒性。经其处理过的植物调亡前会在体内蓄积很高浓度的硝酸盐或氰化物。同时因被杀死的有毒杂草和有害植物固有的毒性未改变,因而容易引起动物中毒。苯氧羧酸类除草剂对环境的危害已引起世界各国环境管理组织的重视。中国《生活饮用水水质标准》中规定2,4-D的浓度限值为0.03 mg/L;世界卫生组织(WHO)饮用水标准规定7种苯氧羧酸类农药的浓度限值在0.002~0.9 mg/L之间;美国联邦饮用水标准规定2,4-D、MCPP的浓度限值分别为0.07 mg/L和0.01 mg/L。
目前,对苯氧羧酸类除草剂多残留的分析多采用气相色谱法或气相色谱质谱联用法[1-7],由于此类化合物极性较强、稳定性较差、不易气化,需衍生后才能测定,整个操作过程步骤繁琐,费时费力,且衍生化反应容易带来较多的副产物,干扰目标化合物的测定。也有文献报道采用毛细管电泳法[8-9]进行苯氧羧酸类的分离测定,由于毛细管电泳法具有很高的分离度,可实现对这类农药的手性分离,但灵敏度不高。而采用液相色谱或液相色谱-串联质谱法[10-16]测定苯氧羧酸类除草剂多残留时,前处理方法相对简单,无需衍生化,可直接萃取。目前国内相关报道均是对食品和农产品的检测。本实验针对环境水质样品,通过优化实验条件,将水样经固相萃取技术提取浓缩后,采用UPLC-MS/MS法进行分离和定量,可在6 min内完成8种组分的定性定量分析,实现样品的快速检测。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-串联质谱(Waters Aquity/TQD);Masslynx 4.0工作站;自动固相萃取仪(Zymark公司),HLB固相萃取柱(1 g,Waters公司);氮吹浓缩仪(美国Labconco公司),0.22 μm混合纤维素酯微孔滤膜、0.22 μm针头过滤器。
2-甲-4-氯丙酸(MCPP)、2-甲基-4-氯苯氧乙酸(MCPA)、2-甲-4-氯丁酸(MCPB)、2,4-滴丙酸(2,4-DP)、2,4-二氯苯氧乙酸(2,4-D)、4-(2,4-二氯苯氧)-丁酸(2,4-DB)、2,4,5-三氯苯氧乙酸(2,4,5-T)、2,4,5-涕丙酸(2,4,5-TP)、2,4-二氯苯氧乙酸 -13C6(2,4-D -13C6),纯度在98.5%~99.5%之间,质量浓度均为100 mg/L,购于Dr.Ehrenstorfer公司,甲醇、乙腈(色谱纯,Merck公司),乙酸铵(色谱纯),纯化水(Millipore)。
1.2 色谱分析条件
BEH C18色谱柱 (100 mm×2.1 mm×1.7 μm);流动相为2 mmol/L乙酸铵水溶液(A)和甲醇(B),采用梯度洗脱模式:0 min,80%A,并保持1 min;3 min时,60%A;5 min时,20%A;6 min时,80%A。流速0.3 mL/min,进样量10 μL,色谱柱温为40℃。内标法定量。
1.3 质谱分析条件
电喷雾离子源(ESI),负离子扫描方式,多反应监测。毛细管电压2.8 kV,离子源温度120℃,雾化温度350℃,雾化气流速800 L/h,反吹气流速10 L/h,碰撞气流速0.10 mL/min,监测驻留时间0.02 s。多反应监测条件见表1。
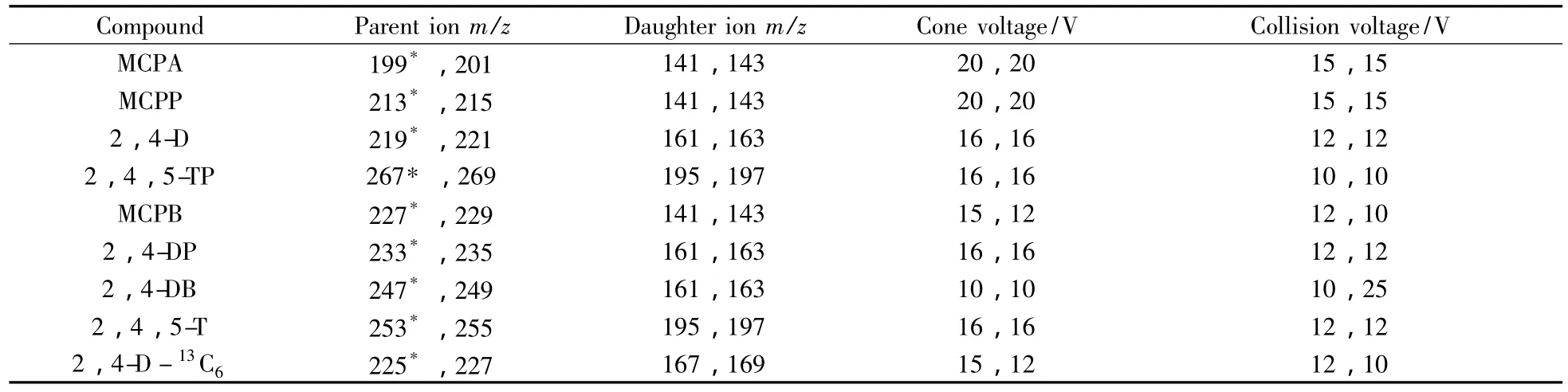
表1 目标化合物的多离子反应监测条件Table 1 MS parameters for target pesticides
1.4 样品制备
活化:用10 mL甲醇活化固相萃取柱,保证小柱柱头浸润;再用10 mL去离子水活化小柱,保证小柱柱头浸润。上样:量取500 mL水样,调节水样pH值至中性,以约10 mL/min的流速将水样通过小柱,以富集水样中的苯氧羧酸类化合物。废水样品体积可根据实际情况适当减少。淋洗:用10 mL甲醇-水(1∶4)溶液淋洗小柱,将在小柱上保留较弱的杂质淋洗下来。吹干:用氮气吹扫小柱10 min,将小柱中的残留水分完全去除。洗脱:用10 mL甲醇洗脱富集后的小柱,并用接收管接收。浓缩:将上述提取溶液浓缩至近干,用去离子水定容至1.0 mL,加入5.0 μL内标使用液,混匀后过0.22 μm滤膜,置于进样瓶中,等待进样。
2 结果与讨论
2.1 固相萃取条件的选择
2.1.1 不同固相萃取柱与水样pH值的比较 比较了C18柱与HLB柱对苯氧羧酸类除草剂的萃取效果,结果表明HLB柱对8种苯氧羧酸类除草剂均有较好的萃取效果 (74%~90%),而采用C18柱进行萃取时MCPA和2,4-D的回收率均低于50%。由于苯氧羧酸类化合物具有较强的亲水性,而HLB柱填料为亲水亲脂型聚合物,适合保留亲水性物质,这与实验结果相吻合。
考虑到苯氧羧酸类除草剂属于弱酸性、极性化合物,采用C18柱进行萃取时,萃取原理为疏溶剂效应,为了达到最佳的萃取效果,需使苯氧羧酸类物质在水样中以分子状态存在,故将水样pH值调至2.0后上样分析。结果表明,该条件下,MCPA和2,4-D的回收率显著提高,均达到80%以上,但MCPB和2,4-DB的回收率明显下降,低于60%。因此采用C18柱萃取时,无法使得8种苯氧羧酸类除草剂均获得较高的回收率。
采用HLB柱萃取,水样调节为酸性后上样与中性上样相比,部分组分回收率下降明显。根据上述实验结果,最终选择HLB柱中性上样方式。
2.1.2 淋洗液的选择 考察了不同比例的甲醇-水溶液作为淋洗液对目标化合物损失水平的影响。结果表明,当淋洗液中洗脱能力较强的甲醇比例达到25%时,MCPA、2,4-D和2,4-DP已有少量损失。最终选择20%甲醇-水溶液作为淋洗液。
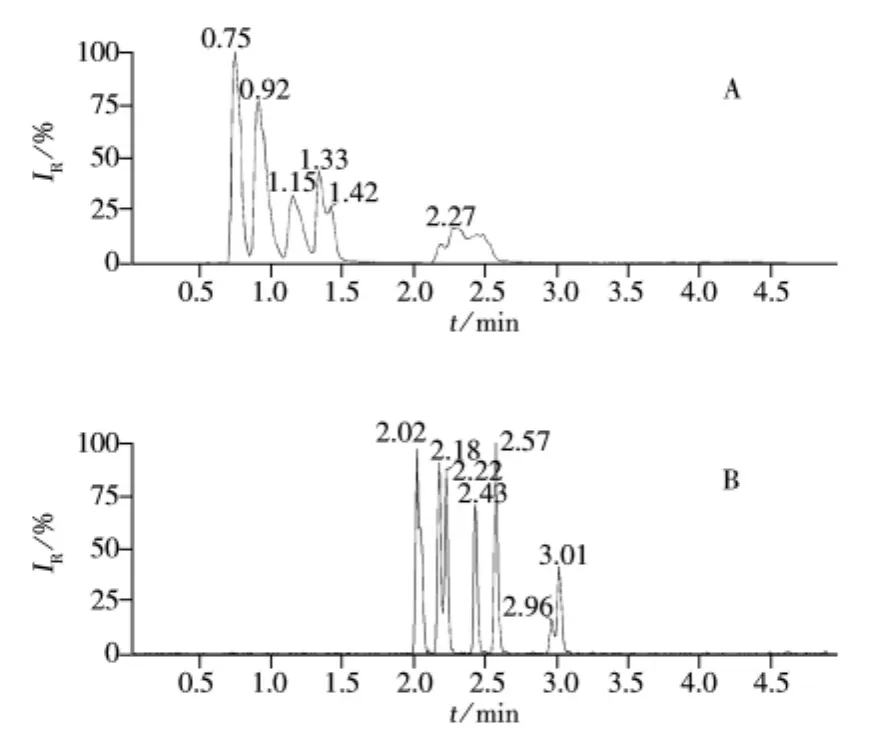
图1 8种苯氧羧酸类在不同流动相下的色谱图Fig.1 TIC chromatograms of eight phenoxy acid herbicides at different mobile phases mobile phase:A.acetonitrile-water,B.acetonitrile-2 mmol/L ammonium acetate
2.2 色谱条件的选择
考察了乙腈-水(图1A)、乙腈-不同浓度乙酸铵水溶液(1、2、5 mmol/L)等流动相对目标化合物保留行为的影响,结果表明当采用乙腈-水作为流动相时,目标化合物的峰形较宽并带有拖尾现象,分离度较差;当水相中添加乙酸铵后,目标化合物的色谱峰峰形得到极大改善,峰形尖锐而对称,分离度有所改善。但随着乙酸铵浓度的提高,对样品的质谱响应抑制也相应增大,故最终使用2 mmol/L乙酸铵水溶液作为流动相(图1B)。
同时还对流动相梯度洗脱程序进行了优化,由于8种组分极性十分接近,未能使其色谱峰达到完全分离,考虑到本实验使用的是质谱检测器,采用多离子反应监测模式,故对未达到基本分离的目标化合物也能进行准确的定性定量分析,不影响分析结果。
2.3 质谱条件的选择
采用流动注射泵连续进样,对8种苯氧羧酸类除草剂的质谱条件进行了优化。由于苯氧羧酸类除草剂的极性较大,选择电喷雾离子源,比较正离子和负离子模式下的扫描结果,8种目标物在负离子模式下有更好的响应,基峰均为[M-H]-,同时由于苯氧羧酸类物质在苯环上均含有氯原子,故[M+2-H]-峰响应较高。
选定[M-H]-为母离子,进行二级质谱扫描,寻找子离子碎片。8种化合物的[M-H]-经碰撞后产生的碎片很少,大多数都只有一个高响应碎片([M-RCOOH]-),其它碎片的相对丰度均较小,因此本实验采用同位素离子(即[M+2-H]-)和其产生的二级碎片作为定性离子对。
2.4 标准曲线
分别配制质量浓度为 0.8、1.0、2.0、5.0、10.0、20.0、50.0、100 μg/L的系列苯氧羧酸类除草剂标准工作液,以苯氧羧酸类化合物的质量浓度(X,μg/L)对其峰面积(Y)进行线性回归,得到的标准曲线见表2。结果表明,在该浓度范围内8种组分的相关系数均大于0.995。色谱图如图2所示。
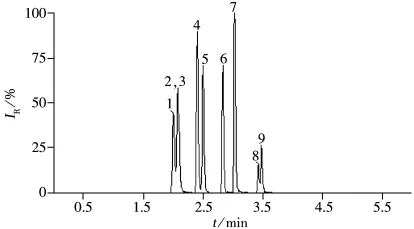
图2 8种苯氧羧酸类除草剂和内标物的总离子流色谱图(50 μg/L)Fig.2 TIC chromatogram of eight phenoxy acid herbicides standard(50 μg/L)
2.5 精密度与回收率
对两个浓度水平分别为0.02、0.20 μg/L的地表水和废水加标样品进行回收率测定,每个加标水平平行配制6份样品,其加标回收率及精密度结果见表2。结果表明:8种农药的回收率为74%~90%,测定结果的相对标准偏差为1.0%~12.0%。方法的准确度和精密度均符合痕量分析的要求。
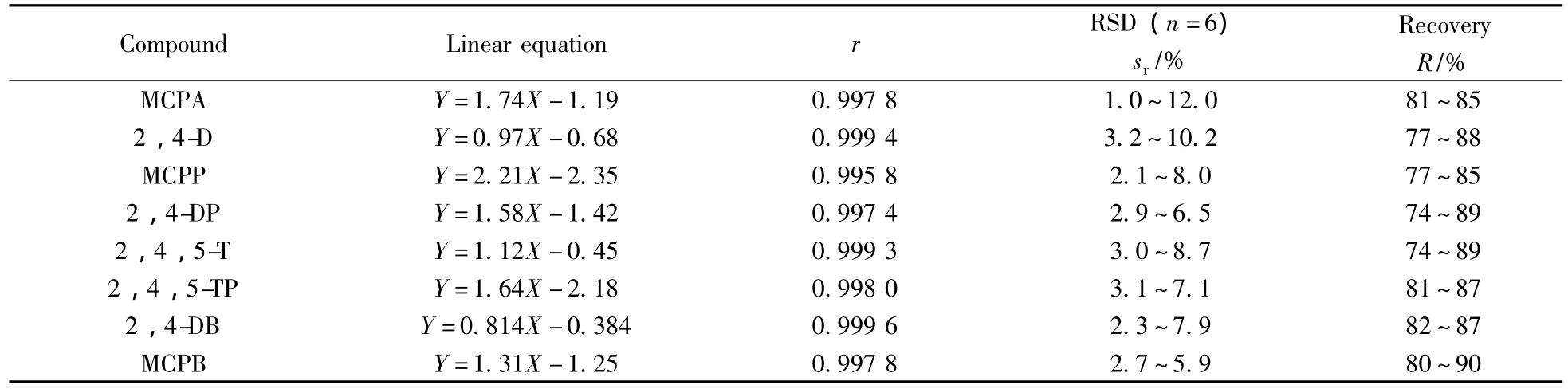
表2 8种苯氧羧酸类农药的线性关系、回收率及相对标准偏差Table 2 Linear relationships,recoveries and RSDs of eight phenoxy acid herbicides
2.6 检出限
根据HJ/T 168-2010空白实验中未检出目标物质的检出限测定方法,本实验以4.0 ng/L的水样浓度作为检出限测定的浓度,配制7份平行水样,水样体积为500 mL。经全过程分析,计算其浓度的标准偏差SD。以3S为检出限(LOD),4倍检出限为定量下限(LOQ),结果见表3。8种农药的检出限为1.0~1.8 ng/L,方法具有较高的灵敏度,完全满足水体中农残分析的要求。
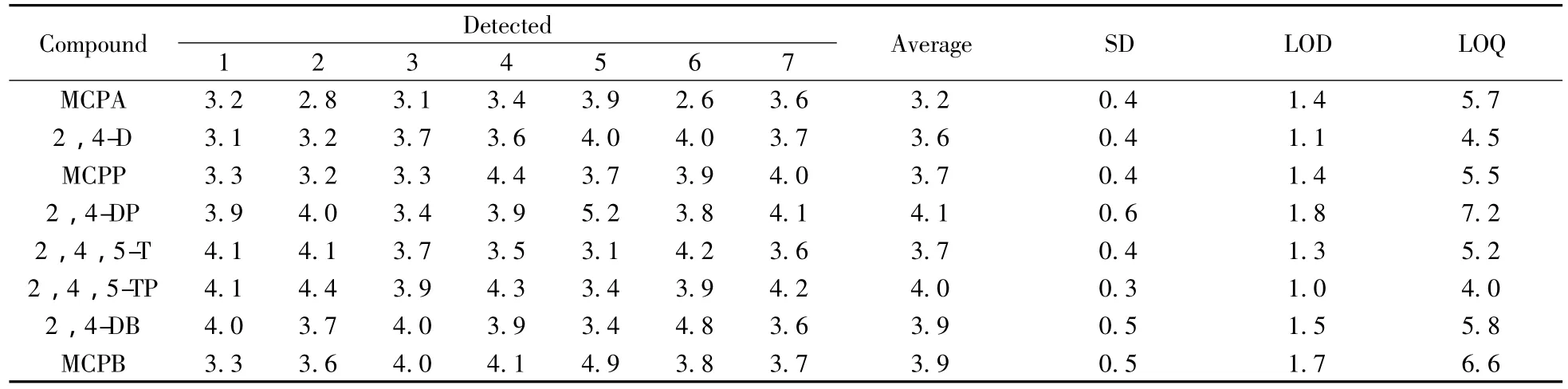
表3 方法检出限计算结果(n=7)Table 3 Method detection limits of eight phenoxy acid herbicides(n=7) ρ/(ng·L-1)
2.7 实际样品分析
应用建立的分析方法,测定了南京地区长江水中8种苯氧羧酸类农药的含量,结果均为未检出,表明该监测水域目前未受到苯氧羧酸类农药的污染。
各国对饮用水中苯氧羧酸类的含量限值规定为0.003~0.9 mg/L,而本方法中水样经过固相萃取富集浓缩后检出限为1.0~1.8 ng/L,灵敏度非常高,远低于限值要求。因此在样品分析量较大、不追求极高灵敏度时,可省略富集浓缩过程,水样经pH值调节和过滤后直接进样,检出限亦可达0.39~0.65 μg/L(根据HJ/T 168-2010要求测定计算),完全满足监测需求,同时也可提高样品分析的高通量性。
3 结论
建立了SPE/UPLC-ESI/MS/MS分析水中苯氧羧酸类除草剂的方法,该法具有操作简便、灵敏度高、准确、重现性好的特点,且杂质干扰少,定性定量准确可靠,适合于大批量复杂水样中苯基羧酸类除草剂的分析。
[1]Wei F,Dong Z L,Yu L.J.Instrum.Anal.(卫锋,董振霖,于玲.分析测试学报),2005,24:304-306.
[2]Kuang H,Chu X G,Hou Y X,Qi Y.Chin.J.Food Hyg.(匡华,储晓刚,侯玉霞,祁彦.中国食品卫生杂志),2006,18(6):503-508.
[3]Xin G B,Tan J Y,Yao L J,Jiang Z L,Zhu Y,Song H.J.Anal.Sci.(辛国斌,谭家镒,姚丽娟,姜兆林,朱昱,宋辉.分析科学学报),2007,23(4):429-432.
[4]Zhao S C,Dong Z L,Wei F,Jiang J Y,Jiang W F,Xie B.J.Chin.Mass Spectrom.Soc.(赵守成,董振霖,卫锋,蒋景阳,姜文凤,谢波.质谱学报),2005,26(4):206-210.
[5]Catalina M I,Dnlluge J,Vreuls R J J,Brinkman U A T.J.Chromatogr.A,2000,877:153 -166.
[6]Lan Z Y,Martha J M W.J.Chromatogr.A,2007,1143:16-25.
[7]Liu J,Zhu Y,Qi B K,Tan J Y.J.Anal.Sci.(刘娟,朱昱,齐宝坤,谭家镒.分析科学学报),2010,26(1):47-50.
[8]Cai C P,Wang D H,Wu L W,Chen X H.Inspection and Quarantine Science(蔡春平,王丹红,吴灵威,陈晓华.检验检疫科学),2004,14(6):23-25.
[9]Adriana F,Santiago R.J.Chromatogr.A,2004,1024:267-274.
[10]Pozo O,Pitarch E,Sancho J V.J.Chromatogr.A,2001,923:75-85.
[11]Lagana A,Bacaloni A,Leva I.Chromatographia,2002,56(5/6):337-343.
[12]Wu J M,Ee K H,Lee H K.J.Chromatogr.A,2005,(1082):121-127.
[13]Mou R X,Chen M X.J.Instrum.Anal.(牟仁祥,陈铭学.分析测试学报),2008,127(9):973-976.
[14]Niu Z Y,Luo X,Tang Z X,Ye X W,Sun Y F,Zhang H W,Wang F M.Chin.J.Anal.Chem.(牛增元,罗忻,汤志旭,叶曦雯,孙银峰,张鸿伟,王凤美.分析化学),2009,37(4):505-510.
[15]Cheng J,Ding L,Jiang J S,Lu Y J.Food Sci.(程静,丁磊,蒋俊树,卢业举.食品科学),2010,31(20):389-393.
[16]Hong H Y,Zhang X F,Wei Y,Yin P J,Hao S H.Agrochemicals(洪海燕,张相飞,魏艳,殷培军,郝双红.农药),2009,48(10):744-746.

