超高效液相色谱法测定稻田土壤及水中的噻虫啉与氟虫双酰胺残留
王点点,陈 源,宋宁慧,吴文铸,石利利*
(1.南京信息工程大学 环境科学与工程学院,江苏 南京 210044;2.环境保护部南京环境科学研究所 国家环境保护农药环境评价与污染控制重点实验室,江苏 南京 210042)
噻虫啉(Thiacloprid)为氯代烟碱类杀虫剂,能够防治水稻、蔬菜、果树、棉花和马铃薯等作物上的大多数害虫,对稻蓟马、稻飞虱等害虫有较好防效[1]。氟虫双酰胺(Flubendiamide)是一种新型邻苯二甲酰胺类杀虫剂,主要对蔬菜、水果、水稻和棉花上的鳞翅目害虫有光谱防效[2-5]。氟虫双酰胺是目前为数不多的作用于昆虫细胞兰尼碱受体的化合物[6],其主要代谢产物简称为NNI-des-iodo,有报道[7]显示,NNI-des-iodo 对水蚤的 EC50值为881 μg·L-1,对摇蚊的 EC50值为18.6 μg·L-1,并且对大鼠的生殖系统有影响。
近年来,噻虫啉和氟虫双酰胺在多种作物病害防治上应用广泛,同时,为了延缓氟虫双酰胺的抗药性,其与噻虫啉的复配制剂已应用于水稻大田害虫的防治[8],导致其在环境中广泛存在。因此研究噻虫啉与氟虫双酰胺在稻田土壤和水中的残留检测方法具有十分重要的意义。噻虫啉、氟虫双酰胺在蔬菜、水果、土壤等样品中的检测方法[9-14]已有报道。Battu等[10]采用液相色谱紫外检测器分析、高效薄层色谱确证了甘蓝、番茄、大豆、红辣椒和土壤中残留的氟虫双酰胺及其代谢产物;秦冬梅等[11]采用高效液相色谱法分析了土壤和白菜中的氟虫双酰胺;张征等[13]采用高效液相色谱/二极管阵列检测器对蔬菜中的噻虫啉残留量进行测定;刘金凤等[15]采用超高效液相色谱-串联质谱法分析了氟虫双酰胺在土壤和水中的消解动态,但目前尚未见同时测定水和土壤中噻虫啉和氟虫双酰胺的报道[16]。本文建立了超高效液相色谱/二极管阵列检测器同时测定稻田土壤及水中噻虫啉与氟虫双酰胺及其代谢产物残留的方法,并进一步分析了39.6%氟虫双酰胺·噻虫啉悬浮剂在南京江宁区稻田土壤和水中的残留消解情况。该方法操作简便、萃取效率高,适用于水稻环境样品中残留量的分析研究。
1 实验部分
1.1 仪器与试剂
Waters Hclass超高效液相色谱仪,二极管阵列检测器(Waters,US);CR22GⅡ高速离心机(Hitachi,JP);E24A恒温振荡器(NBS,US);R210旋转蒸发仪(Buchi,SW);WH-3微型旋涡混合仪(上海泸西分析仪器厂有限公司);PL402-L电子天平(梅特勒-托利多仪器有限公司)。
噻虫啉标准品(纯度99.0%)、氟虫双酰胺标准品(纯度98.1%)、氟虫双酰胺代谢产物标准品(纯度99.8%)均由拜耳公司提供;乙腈、甲醇(色谱纯,Merck);乙酸乙酯、丙酮、磷酸(分析纯,南京化学试剂有限公司);氯化钠(分析纯,南京化学试剂有限公司,140℃烘烤4 h);实验用水为纯水。
1.2 液相色谱检测条件
色谱柱:高强度硅胶HSS T3色谱柱(ACQUITY UPLCHSS T3,2.1 mm×100 mm,1.8 μm),柱温:35℃,流动相A为乙腈,B为水,梯度洗脱:0.0~3.0 min,20%A;3.0~6.0 min,20%~70%A;6.0~10.0 min,70%A;10.0~11.0 min,70%~20%A。流速为0.3 mL·min-1,检测波长为230 nm,进样量为 5 μL。
1.3 样品的采集与保存
稻田水:于江苏省南京市江宁区横溪镇试验基地水稻田采集,样品不少于500 mL,贴好标签,-20℃条件下冷冻保存。
稻田土壤:于江苏省南京市江宁区横溪镇试验基地水稻田取耕作层(0~15 cm深)土壤至少10个点,除去碎石、植物根茎等杂物混合均匀,冷冻干燥,粉碎,过20目筛,置于-20℃冰箱中储存。
1.4 样品的提取及净化
水样处理:准确量取过滤后的稻田水样100 mL,置于250 mL分液漏斗中,分别用乙酸乙酯30 mL萃取两次,弃去水相,合并有机相,50℃恒温水浴浓缩至近干,用乙腈-水(3∶7)定容至2.0 mL,过0.22 μm滤膜,待UPLC测定。
土壤样品处理:准确称取制备好的稻田土壤样品20.00 g(精确至0.01 g),置于250 mL离心瓶中,用10 mL水润湿后再加入30 mL丙酮混匀,在恒温振荡器中振荡30 min,重复上述步骤两次,合并提取液转入150 mL烧瓶中,50℃恒温水浴除去丙酮后,水相分别用乙酸乙酯30 mL萃取两次,合并乙酸乙酯相,50℃恒温水浴浓缩至近干,用乙腈-水(3∶7)定容至2.0 mL,过0.22 μm滤膜,待UPLC测定。
1.5 方法验证
通过对实际样品(稻田水和土壤)的加标回收实验,考察“1.4”方法对实际样品检测的适用性及可靠性。
2 结果与讨论
2.1 色谱柱的选择
比较了BEH C18色谱柱、HSS T3色谱柱(均为美国Waters公司,ACQUITY UPLC色谱柱)对噻虫啉、氟虫双酰胺及其代谢产物分析的适用性。C18色谱柱是通用型色谱柱,适用的化合物种类广泛;T3色谱柱是与100%水性流动相兼容的C18柱,适用于保留和分离极性好的化合物,能提高目标物在水性流动相中的稳定性。噻虫啉属于较亲水性化合物,而且初始流动相中纯水的比例较高,因此采用HSS T3色谱柱对噻虫啉、氟虫双酰胺及其代谢产物进行检测。结果显示,待测组分能与杂质完全分离,峰形对称,出峰时间适当且稳定,峰面积较大,灵敏度较高。而在相同条件下采用BEH C18色谱柱进行检测时,待测组分虽能与杂质分离,但基线和出峰时间不稳定,且噻虫啉的灵敏度相对较低。另外,普通C18色谱柱长期使用纯水比例高的流动相容易出现疏水塌陷现象,降低色谱柱的保留能力以及寿命。综合考虑以上因素,选择HSS T3色谱柱作为分离柱。

图1 噻虫啉、氟虫双酰胺及其代谢产物混合标准溶液(0.50 mg·L-1)的色谱图Fig.1 UPLC chromatograms of thiacloprid,flubendiamide and its metabolite standards(0.50 mg·L-1)
2.2 检测波长的确定
标样在上述流动相条件下,用二极管阵列检测器在190~300 nm范围进行扫描,结果显示噻虫啉的最大吸收波长在240 nm左右,而氟虫双酰胺及其代谢产物在200 nm处有最大吸收。综合考虑,确定检测波长为230 nm,在此波长下3种化合物均有较好的灵敏度,峰形较好,且样品的干扰较少,标样图谱见图1。噻虫啉、氟虫双酰胺及其代谢产物的保留时间分别为6.063、8.841、8.310 min。
2.3 流动相的选择
由于噻虫啉的极性较强,而氟虫双酰胺及其代谢产物的极性相对较弱,在等度洗脱条件下,噻虫啉出峰太快导致基质效应较强,而氟虫双酰胺及其代谢产物无法出峰或保留时间过长,因此采用梯度洗脱进行分析。在同样梯度条件下对比了以甲醇-水和乙腈-水作为流动相的分离效果,实验表明,以甲醇-水作为流动相时噻虫啉的灵敏度稍有改善,保留时间后延,但氟虫双酰胺及其代谢产物的灵敏度均有所降低。综合考虑,最终确定乙腈-水作为流动相,梯度条件见“1.2”。
实际样品检测中,既要保证目标化合物出峰时间适当以避免杂质的干扰,又要保证目标化合物的灵敏度,因此流动相的流速很重要。实验发现,当流速为0.3 mL·min-1时,目标物可获得较高灵敏度,且峰形对称,能与杂质峰分离,保留时间适当。所以本方法选择流动相的流速为0.3 mL·min-1。
2.4 水样、土壤样品的净化
分别考察了二氯甲烷和乙酸乙酯两种溶剂对目标物回收率和净化效果的影响。实验表明,用二氯甲烷作萃取溶剂时,氟虫双酰胺及其代谢产物的回收率较低,在8.1%~40.5%之间,而使用乙酸乙酯时,噻虫啉、氟虫双酰胺及其代谢产物的回收率均在80%以上,能满足农药残留分析的要求。
2.5 工作曲线与检出限
准确称取噻虫啉、氟虫双酰胺及其代谢产物的标准品分别配制成1 000.0 mg·L-1的标准储备液,用乙腈-水(3∶7)作溶剂,采用梯度稀释法准确配制成质量浓度分别为0.01、0.10、0.20、0.50、1.00、5.00、10.00 mg·L-1的噻虫啉、氟虫双酰胺及其代谢产物的混合标准溶液,在上述色谱条件下测定。以标准溶液的质量浓度为横坐标,峰面积为纵坐标作标准曲线,所得线性方程:噻虫啉为y=60 292x-131.46(r2=1.000);氟虫双酰胺为y=24 650x-121.78(r2=1.000);NNI-des-iodo为y=23 219x-191.79(r2=0.999 9)。以10倍信噪比(S/N≥10)计算得噻虫啉、氟虫双酰胺及其代谢产物的仪器测定限(IDL)分别为0.001、0.001、0.002 mg·L-1。
2.6 方法的回收率、精密度与检出限
取空白水样和土壤样品,分别进行3个水平的加标回收率实验,每个水平平行做5个加标样品且各测定1次,按照上述样品前处理方法及检测条件进行实验,另设空白对照,实验测定结果见表1,色谱图见图2。结果表明:噻虫啉、氟虫双酰胺及其代谢产物在稻田水中的平均回收率为92%~106%,相对标准偏差为0.81%~2.5%;在稻田土壤中的平均回收率为82%~104%,相对标准偏差为1.1%~3.8%。噻虫啉、氟虫双酰胺及其代谢产物的加标回收率和相对标准偏差均在农药残留试验准则允许的范围内,说明该方法符合农药残留分析的要求。
在该方法条件下,噻虫啉、氟虫双酰胺及其代谢产物的方法检出限(MDL)依次为:稻田水0.000 4、0.000 9、0.001 0 mg·L-1,稻田土壤 0.002 2、0.002 8、0.003 6 mg·kg-1。
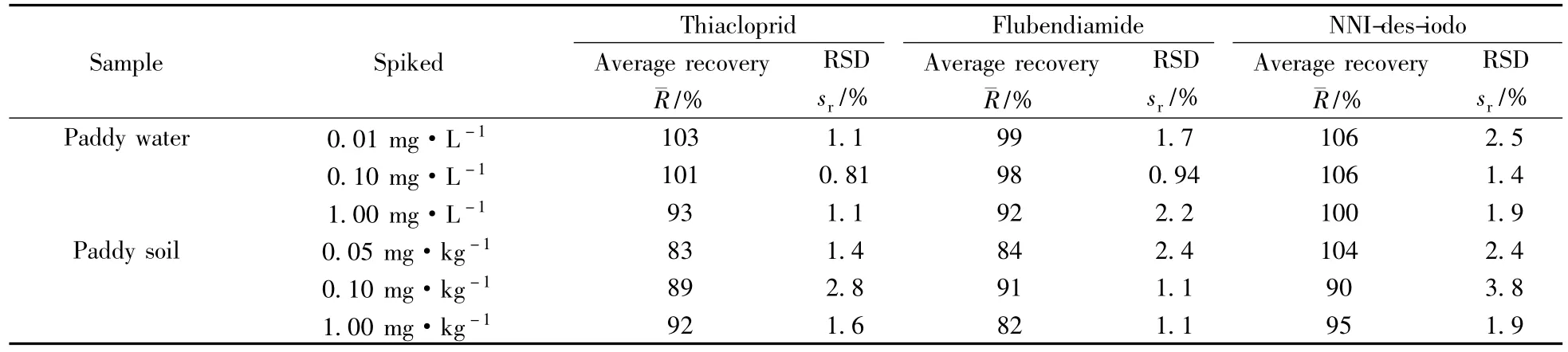
表1 噻虫啉、氟虫双酰胺及其代谢产物在稻田水和土壤中的加标回收率及相对标准偏差(n=5)Table 1 Recoveries and RSDs of thiacloprid,flubendiamide and its metabolite(NNI-des-iodo)in paddy water and soil(n=5)
2.7 实际样品的分析
采用上述方法测定了39.6%氟虫双酰胺·噻虫啉悬浮剂在南京江宁区稻田土壤和水中的残留消解情况。结果表明:稻田土壤中噻虫啉的消解半衰期为12.0 d,氟虫双酰胺为22.4 d,其代谢产物未检出;稻田水中噻虫啉的消解半衰期为21.0 d,氟虫双酰胺为16.1 d,其代谢产物NNI-des-iodo的浓度很低,为 0.002~0.018 mg·L-1。
3 结论
本文建立了同时测定稻田水样和土壤样品中噻虫啉和氟虫双酰胺及其代谢产物残留的方法,对其在稻田水和土壤中分别进行不同水平的加标回收实验,方法的回收率为82%~106%,相对标准偏差为0.81%~3.8%;噻虫啉、氟虫双酰胺及其代谢产物的方法检出限依次为:稻田水0.000 4、0.000 9、0.001 0 mg·L-1,土壤0.002 2、0.002 8、0.003 6 mg·kg-1。该方法符合农药残留分析与检测的要求,应用于实际环境样品的残留量测定,简易有效、成本低、灵敏度高、结果准确可靠。

图2 噻虫啉、氟虫双酰胺及其代谢产物加标样品的色谱图Fig.2 UPLC chromatograms of thiacloprid,flubendiamide and its metabolite spiked samples
[1]Xie X H,Wang F J.Agrochemicals(谢心宏,王福久.农药),2001,41(1):41-42.
[2]Masanori T,Tetsuyoshi N,Kazuhiko M.J.Pestic.Sci.,2010,35(4):490 -491.
[3]Ebbinghaus D,Schnorbach H J,Elbert A.Pflanzenschutz-Nachrichten Bayer,2007,60(2):219 -246.
[4]Singh G,Sahoo S K,Takkar R.Chemosphere,2011,84(10):1416-1421.
[5]Hirooka T,Kodama K.Pflanzenschutz-Nachrichten Bayer,2007,60(2):203 -218.
[6]Kato K,Kiyonaka S,Sawaguchi Y.Biochemistry,2009,48(43):10342 -10352.
[7]Hall T.Pflanzenschutz-Nachrichten Bayer,2007,60(2):167 -182.
[8]Deng L N,Li B T,Xu Y M,Shi Q H,Pan X H.Chin.Agric.Sci.Bull.(邓理楠,李保同,徐月明,石庆华,潘晓华.中国农学通报),2011,27(12):286-290.
[9]Paramasivam M,Banerjee H.Bull.Environ.Contam.Toxicol.,2012,88(3):344 -348.
[10]Battu R S,Singh B,Kooner R.J.Agric.Food Chem.,2008,56:2299-2302.
[11]Qin D M,Qin X,Sun Y,Xu Y M.Agrochemicals(秦冬梅,秦旭,孙扬,徐应明.农药),2009,48(10):755-756.
[12]Paramasivam M,Banerjee H.Bull.Environ.Contam.Toxicol.,2012,88(4):511 -514.
[13]Zhang Z,Wu Z P,Zhang X Q,Lu J.Food Sci.(张征,武中平,张晓强,卢剑.食品科学),2011,32(24):241-243.
[14]Liu L D,Hou Z G,Yin L D,Chen C,Lu Z B,Xie W M.J.Anhui Agric.Sci.(刘丽丹,侯志广,殷利丹,陈超,逯忠斌,谢文明.安徽农业科学),2010,38(23):12556-12558.
[15]Liu G F,Zhu G N,Ding W,Wu H M.Chin.J.Pestic.Sci.(刘金凤,朱国念,丁伟,吴慧明.农药学学报),2011,13(3):310-313.
[16]Gopal M,Mishra E.Bull.Environ.Contam.Toxicol.,2008,81(4):360 -364.

