响应面法优化罗非鱼鱼皮胶原多肽螯合镁的工艺条件的研究
崔 潇,江虹锐,*,刘小玲,林 莹,肖碧红,白 洋
(1.广西大学轻工与食品工程学院,广西南宁530000;2.百洋水产集团有限公司,广西南宁530000;3.广东百维生物科技有限公司,广东化州525100)
罗非鱼又称非洲鲫鱼,属鲈形目、丽鱼科,是我国主要的淡水经济鱼种。目前我国罗非鱼出口呈逐年上升趋势,产品主要是冻鱼片和冻全鱼两大类,在加工过程中产生的鱼皮、鱼骨、鱼头等下脚料高达原料的60%以上,不仅形成极大的浪费还造成了环境污染[1]。因此,充分利用罗非鱼下脚料资源,采用现代生物技术方法对罗非鱼下脚料资源进行再加工,提高其经济价值势在必行。近年来,人们开始关注从水产类下脚料中获得的胶原肽的活性以及与金属螯合的研究。如霍健聪等研究了带鱼下脚料制备多肽铁螯合物[2]。张俊敏等研究了鳕鱼皮胶原蛋白锌肽螯合物的制备[3]。陆剑锋等研究了斑点叉尾回鱼鱼骨胶原蛋白螯合钙的制备[4]。许庆陵等研究了罗非鱼鱼肉与锌的螯合条件[5]。但是,关于镁(Mg)与胶原肽的螯合工艺研究未见报道。镁(Mg)是人体内能量代谢和许多酶促反应的激活剂,低Mg可使机体细胞溶血脆性升高导致人体新陈代谢紊乱[6],包括血压升高、胰岛素分泌障碍、血脂代谢障碍及引发相关的代谢综合症。摄入充足的Mg制剂可以对这些代谢紊乱症起到预防和改善的作用[7]。探讨镁离子与胶原多肽螯合反应最佳工艺条件,旨在为罗非鱼下脚料的深加工提供新途径,同时为镁补充剂提供一种新的来源。
1 材料与方法
1.1 材料与仪器
罗非鱼鱼皮胶原多肽 广西百洋水产集团股份有限公司提供,分子量≤3000u;氯化镁(MgCl2),分析纯 成都市科隆化学试剂厂;EDTA二钠盐,分析纯 西陇化工股份有限公司;络黑T,分析纯 天津科密欧试剂有限公司。
pH5J-3F实验室pH计 上海佑科仪器仪表有限公司;GSY-Ⅱ电热恒温水浴锅 北京医疗设备厂;台式低速自动离心机 长沙平凡仪器公司;FA电子分析天平 上海精科仪器;傅里叶变换红外光谱仪(FTID Spectrometer) 天津港东科技发展股份有限公司。
1.2 实验方法
1.2.1 螯合反应工艺流程 鱼皮胶原多肽→温水溶解(60℃)→加入MgCl2→调节温度→调节pH→鳌合反应→加入乙醇洗涤→离心(5000r/min)→取沉淀→纯化→烘干→多肽镁鳌合物。
1.2.2 响应面优化鱼皮胶原多肽镁离子螯合反应的工艺条件 胶原多肽与镁离子螯合反应过程中,以螯合率为评价指标,以胶原蛋白多肽与MgCl2的质量比(实验时固定胶原蛋白多肽的质量为恒量,改变镁离子的质量)、反应体系的pH、温度和时间为影响因素设计螯合反应单因素实验,根据单因素实验结果,质量比、pH、温度对螯合体系反应的影响较大,而当反应时间大于30min对螯合体系无影响。因此,设计以螯合率为响应值,以胶原蛋白肽:MgCl2的质量比、pH、反应温度为影响因素的三因素三水平17个试验点的响应面分析实验,因素水平编码见表1。

表1 因素水平表Table 1 Factors and levels of orthogonal test
1.2.3 螯合率的测定 采用EDTA络合法对胶原蛋白肽Mg螯合反应进行评价[8]。
螯合率(%)=螯合态Mg的含量/Mg的总量×100=CV1/CV0×100
式中:C为 EDTA二钠盐标准溶液的浓度,mol/L;V1为滴定螯合态Mg的含量所消耗的EDTA二钠盐溶液体积,mL;V0为滴定Mg的总量所消耗的EDTA二钠盐溶液体积,mL。
1.2.4 傅里叶红外光谱分析 取已经制备好的罗非鱼鱼皮胶原多肽镁的螯合物约2mg放入玛瑙研钵中,与200mg左右干燥的光谱纯级KBr混合并研磨均匀。将研磨后的混合物制成压片,采用傅里叶变换红外光谱仪,采用漫光反射模式测定在4000~400cm-1区间吸收光谱,分析特征峰。
1.2.5 数据分析 所有实验均进行3次平行实验,利用Design Expert8.05b软件对响应面实验数据分析处理,探究影响相应值的最关键因素,并找出制备罗非鱼鱼皮胶原多肽镁螯合物的最优条件。p<0.05为差异性显著。
2 结果与分析
2.1 单因素实验对罗非鱼鱼皮多肽镁螯合率的影响
2.1.1 质量比对螯合率的影响 固定胶原多肽与Mg离子螯合反应过程中体系温度为70℃,pH7.0,反应时间30min,以胶原多肽:MgCl2的质量比为变量探究质量比对多肽镁螯合率的影响,结果如图1所示。螯合率随着质量比的增加而增大,当质量比为1∶5时螯合率达到最大值,当继续增大质量比螯合率开始下降。螯合反应体系的质量比是影响多肽与金属离子发生螯合反应的一个重要因素,质量比太小时,胶原多肽与Mg离子很难形成环状稳定配合物[9],质量比过大,螯合反应后剩余的胶原多肽增多,造成了原料的浪费。因此,胶原多肽:MgCl2的质量比设定为1∶5。

图1 质量比对螯合率的影响Fig.1 Effect of Collagen Petide/Mg2+weight ratio on ability of chelation
2.1.2 pH对螯合率的影响 固定胶原多肽与Mg离子螯合反应过程中体系温度为70℃,质量比为1∶5,时间30min,改变体系pH,探究不同pH对螯合率的影响,结果如图2所示。pH对螯合率的影响很大,随着pH的升高螯合率逐渐增大,当pH7.0时螯合率达到最大值,继续增大pH螯合率明显下降。pH过小时,体系中含有大量H+,H+会与Mg2+争夺供电基团,不利于螯合物的形成,当pH过大时,镁离子形成氢氧化物沉淀,也会影响螯合物的形成[10]。因此,胶原多肽与Mg离子螯合反应,体系pH7.0时为宜。

图2 pH对螯合率的影响Fig.2 Effect of pH on ability of chelation
2.1.3 温度对螯合率的影响 固定胶原多肽与Mg离子螯合反应过程中体系质量比为1∶5,pH7.0,时间30min,探究不同温度对螯合率的影响,结果如图3所示。随着温度的升高,螯合率明显增加,当温度达到70℃时,螯合率达到最大值,再升高温度,螯合率开始快速下降。这是由于螯合反应是一个放热反应,温度过高不利于螯合反应的进行[4]。因此,胶原多肽与Mg离子螯合反应,体系温度控制在70℃时为宜。

图3 温度对螯合率的影响Fig.3 Effect of temperature on ability of chelation
2.1.4 时间对螯合率的影响 固定胶原多肽与Mg离子螯合反应过程中体系质量比为1∶5,pH7.0,温度70℃。以反应时间为变量,探究时间对螯合率的影响,结果如图4所示。在30min内,螯合率随时间的延长逐渐上升,当T=30min时,螯合率达到最大值,继续延长反应时间对螯合率影响不大。一般的金属离子配位反应是室温下的快速反应。大多数的金属离子在溶液中可以发生快速反应,其半衰期仅为毫秒到微妙之间[11]。因此,实验将胶原多肽与镁离子螯合反应时间设定为30min。
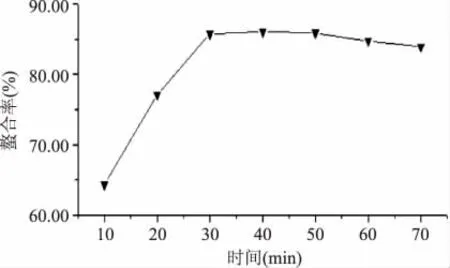
图4 时间对螯合率的影响Fig.4 Effect of time on ability of chelation
2.2 响应面优化实验
2.2.1 响应面分析方案与实验结果 根据表1因素水平编码表选择质量比、pH、温度为自变量,分别记为X1、X2、X3,并以螯合率为响应值Y,设计响应面实验,实验方案及结果见表2。实验结果经过Design Expert8.05b软件处理,得到响应面二次回归方程:Y=84.48+1.46X1-0.49X2+0.88X3-1.60X1X2+0.36X1X3+3.96X2X3-6.96X12-3.23X22-5.92X32。
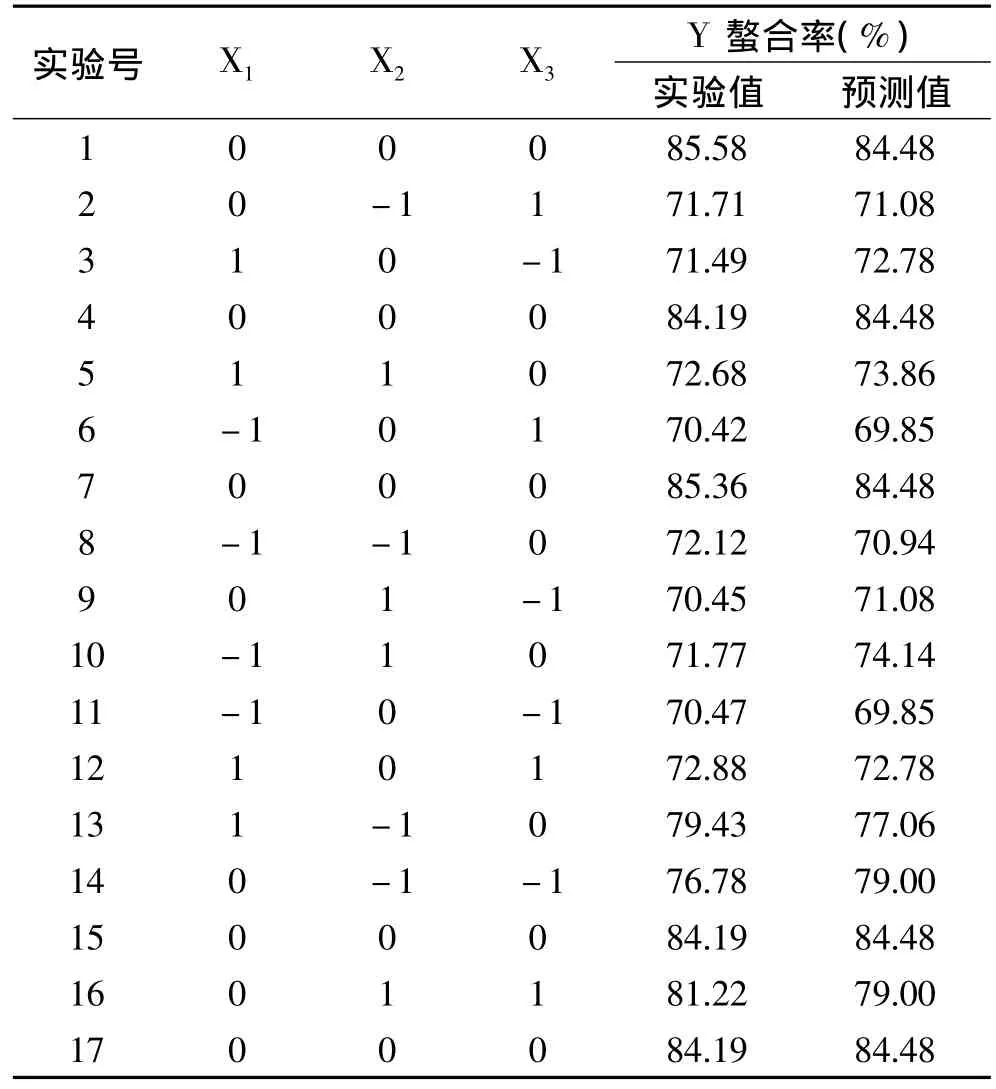
表2 响应面实验方案及实验结果表Table 2 The response surface experiment schemes and experiment results
响应面实验中,质量比、温度、pH对胶原肽与Mg离子螯合反应影响的方差分析,见表3。表中直观的反映出这三个因素对螯合率影响的显著性,依次为质量比>温度>pH。质量比和温度直接影响螯合率的大小,而pH对螯合率的影响相对较小。响应面实验中复合相关系数R2=0.94640,R2adj=0.91430说明该模型与实验拟合程度好;在p<0.05为差异性显著的条件下,失拟项不显著;回归方程显著。建立的回归方程模型符合实际情况,回归方程有效。

表3 回归模型方差分析表Table 3 The results of Regression model of variance analysis
2.2.3 响应曲面图型分析与优化 鱼皮胶原多肽与镁离子的响应曲面图见图5~图7。图5~图7非常直观的反映出各个因素对响应值的影响,曲面图形的形状可以反映出影响因素的显著性。图形的形状近似圆形说明各个因素之间的交互作用不很显著。经过Design Expert8.05b对数据处理得出的最优条件是:质量比为 1∶5.12,pH6.93,温度为 70.53℃,响应面模型预测的螯合率为84.315%。
根据实验室的实际情况及方案实施的可操作性将最优方案工艺参数修正为质量比为1∶5,pH为7.0,温度为70℃,以此条件进行三次平行试验测得的螯合率为84.580%,与预测值相比误差为0.265%。因而,说明通过响应曲面法预测得到的优化工艺参数准确可靠具有实用价值。在相关研究中,罗非鱼下脚料蛋白多肽在最优条件下与锌的螯合率为87.56%[12]。带鱼蛋白水解液在最适条件下与亚铁离子的螯合率为93.000%[13]。因此,本实验所得的螯合工艺条件比较合理。

图5 质量比和pH对鱼皮胶原蛋白多肽镁螯合物的响应面图Fig.5 Quality ratio and pH on the response surface of fish skin collagen peptides chelating magnesium
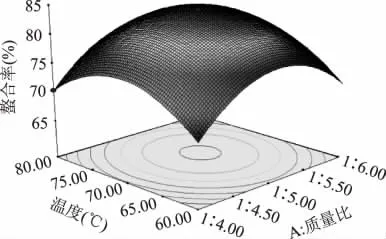
图6 质量比和温度对鱼皮胶原蛋白多肽镁螯合物的响应面图Fig.6 Quality ratio and temperature on the response surface of fish skin collagen peptides chelating magnesium
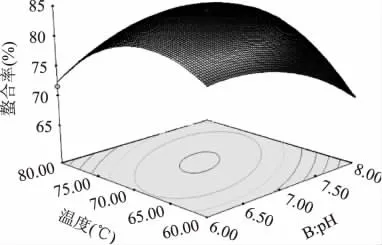
图7 温度和pH对鱼皮胶原蛋白多肽镁螯合物的响应面图Fig.7 Temperature and pH of the response surface of fish skin collagen peptides chelating magnesium figure
2.3 鱼皮胶原多肽及鱼皮胶原多肽镁螯合物的红外光谱分析研究
胶原蛋白溶液中存在氨基酸残基之间的酰胺键,还有少量的氨基和羧基。通过红外光谱分析,胶原多肽的图谱中会出现氨基(-NH2)和羧基(C=O)的吸收峰,胶原多肽与镁离子螯合后,使吸收峰发生改变或者偏移[14]。
胶原蛋白与胶原蛋白螯合镁的红外光谱如图8(a,b)所示,图8a为鱼皮胶原多肽的红外光谱图,8b为鱼皮胶原多肽镁螯合物的红外光谱图。图8a中3411.51cm-1是-NH2的吸收峰,是由N-H的伸缩振动引起;1646.94cm-1属于酰胺Ⅰ带,是由C=O的伸缩振动引起[15];1162.89cm-1是NH3+的变角振动吸收峰。622.89cm-1处则是由N-H面外变形振动引起[16]。图8b加入Mg离子后,3411.51cm-1氨基的伸缩振动吸收峰出现偏移,向高波位移动,且吸收峰变弱,622.89cm-1处吸收峰向高波数移动,吸收峰变弱,表明Mg2+与氨基有结合[17]。酰胺Ⅰ带吸收峰1646.94-1cm-1向高波移动且鳌合前后出现强弱变化,推测羧基可能也以共价建的方式与镁离子结合。1162.89cm-1处的NH2吸收峰向低波位发生了偏移,且吸收峰变弱,推测Mg2+与-NH2之间存在的结合用。

图8 胶原多肽和胶原多肽螯合镁的FT-IR光谱图Fig.8 FT-IR spectrogram of collagen and petide chelate magnesium
3 结论
本实验在单因素实验结果的基础上,运用响应面优化实验的方法,确定了罗非鱼鱼皮胶原蛋白多肽螯合镁的最佳工艺条件为:质量比1∶5、温度70℃、pH7.0、时间30min,螯合率达到84.580%。其中各因素对螯合率影响大小的顺序是质量比>温度>pH。并且通过红外光谱实验证明了胶原多肽镁螯合物的存在。
[1]秦刚,王庭.罗非鱼下脚料鱼糜系列功能性产品的研发[J].肉类研究,2010,137(7):78-81.
[2]霍健聪,邓尚贵,谢超.带鱼下脚料蛋白多肽铁螯合物的制备及抗氧化活性研究[J].食品工业科技,2009,30(4):267-270.
[3]张俊敏,乐辉,陈忻,等.响应面法优化微波固相合成鳕鱼皮胶原蛋白锌肽螯合物的工艺[J].广东农业科学,2011,(22):87-90.
[4]陆剑锋,孟昌伟,李进,等.斑点叉尾鮰鱼骨胶原多肽螯合钙的制备及其特征[J].水产学报,2012,36(2):314-319.
[5]许庆陵,曾庆祝,闫磊,等.罗非鱼肽-锌配合物的制备及其生物活性[J].食品科学,2010,31(10):75-80.
[6]黄晓钰,刘邻渭.食品化学综合实验[M].北京:中国农业大学出版社,2002:131-132.
[7]Gums JG.Magnesium in cardiovascular and other disorders[J].Am J Health Syst Pharm,2004,61(15):1569-1576.
[8]程春萍,张丽娜.连续滴定法测定蛋壳中钙、镁离子的含量[J].内蒙古石油化工,2010(8):35-36.
[9]杨姗姗.罗非鱼皮多肽锌螯合盐的制备及性质研究[M].南昌:南昌大学,2008.
[10] Wedekind K J A E Hortin,DH Baker.Methodology forassessing Zinc bioavailability efficacy estimates for Zinc-2 methionihe,Zinc Sulfate,and Zinc Oxide[J].J A nim Sci,1992,70:178-187.
[11]巴索洛,皮尔逊.无机反应原理-溶液重金属络合物的研究[M].1987,5.
[12]李彤刚,洪鹏志,杨萍,等.二次回归正交旋转组合优化罗非鱼下脚料超滤酶解液螯合锌的工艺条件[J].食品工业科技,2013,34(2):234-237.
[13]钟明杰.带鱼下脚料蛋白水解螯合物制备及生物特性研究[D].青岛:中国海洋大学,2009.
[14]付文雯,马美湖,蔡朝霞.牛骨蛋白酶解制取肽钙的研究进展[J].食品与发酵科技,2009,45(1):1-5.
[15]张晓霞,刘剩取,李国英.碱法水解黑鱼鱼鳞及制备多肽螯合钙工艺的研究[J].食品科技,2010,35(12):130-134.
[16]孙胜玲,王爱勤,高忆慈,等.D-氨基葡萄糖与锌盐配位的红外光谱研究[J].光谱学与光谱分析,2005,25(3):374-376.
[17]E P Paschalis,O Jacenko,B Olsen,et al.Fourier transform infrared microspectroscopic analysis identifies alterations in mineral properties in bones from mice transgenic for type X collagen[J].Bone,1996,2(19):151-156.

