食前热水处理提高鲜切黄瓜微生物安全性的研究
张甜甜,李天琪,王庆国,王 敏
(山东农业大学食品科学与工程学院,山东泰安271018)
鲜切蔬菜具有方便、营养、新鲜、可食率高等特点,在发达国家广受消费者的欢迎[1-3],也将是我国蔬菜供应的发展方向之一。很多鲜切蔬菜品种,既可生食,又可加热烹调食用。保证生食鲜切蔬菜的食用安全性是世界各国广泛关注的重要研究课题。然而,至今尚没有安全、有效的解决方法。过去10年[4],鲜切蔬菜食源性致病菌导致的食品安全事件在发达国家也时有发生。鲜切蔬菜从田间生长、采收及后续的运输、加工、包装及货架销售过程中,均存在着食源性致病菌污染的风险。前人的研究[5-8]多集中在避免污染和采后加工中,应用二氧化氯、细菌素等化学或生物抗菌剂和低温、气调、辐照等物理方法控制食源性致病菌,从成品前食源性致病菌得到很好控制,但从市场销售到食用前的过程中,少量的食源性致病菌仍有可能快速繁殖,使人致病。为此,食前彻底消除食源性致病菌是保证消费者食用安全的最后且十分关键的措施,然而,过去的研究极少。食用前的处理,既可在酒店、餐厅等食品服务部门,也可在家庭进行。热处理是一种最广泛应用的物理杀菌方法,可以有效地杀死食源性致病菌[9-11]。前人也有在加工过程中,热处理抑制鲜切蔬菜食源性致病菌的研究,然而由于杀死食源性致病菌的热条件往往对鲜切蔬菜造成热损伤,至今没有得到应用[12]。热处理导致的热损伤当时可能不显现,而在贮藏期或货架期表现出来,但食用前热处理则可避免这些后显现的热损伤,从而提高热处理的强度和杀菌效果。我国民间有部分生鲜蔬菜食用前热处理的做法,但这仅是经验,缺少科学支持。本研究旨在探讨食用前热水处理彻底杀灭鲜切黄瓜上食源性致病菌,保证食用安全,又保持其鲜度的可能性。
1 材料与方法
1.1 材料与仪器
本实验所使用的黄瓜 购自山东省济南市济阳县花园小区,选择优质、无腐烂、无机械伤、大小均匀的黄瓜为材料,于10℃的冷库中贮藏,24h内进行实验;实验菌株单增李斯特菌(ATCC 19111)、鼠伤寒沙门氏菌(ATCC 13311),所用培养基Brain-Heart Infusion agar(BHIA,脑心浸液琼脂培养基)、PALCAM agar(PALCAM琼脂培养基)和Hektoen Enteric agar(HE,肠道菌琼脂培养基)及无菌均质袋 均由北京陆桥技术有限公司提供。
YXQ-LS-SⅡ型立式电热压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;微量移液枪 上海宙辉生化仪器有限公司;BHC-1300IIA2型生物安全柜 苏州市安泰空气技术有限公司;PX-300B-G型微电脑光照培养箱 上海博讯实业有限公司医疗设备厂;HBM-400B型拍击式均质机 天津市恒奥科技有限公司;DDS-307型电导率仪 上海伟业仪器厂;TA-XT2i型物性测试仪 英国Stable Micro System公司;普析通用T6新世纪分光光度计 北京普析通用仪器有限责任公司;Pocket refractometer Pal-1型手持糖量计 日本ATAGO。
1.2 实验方法
1.2.1 实验内容 实验分四部分进行:a.热水处理鲜切黄瓜并进行感官评定;b.体外热水处理食源性致病菌(鼠伤寒沙门氏菌和单增李斯特菌);c.热水处理染菌的鲜切黄瓜,并测定残余致病菌数量;d.测定热水处理对鲜切黄瓜品质(硬度、细胞膜透性、可溶性固形物含量、抗氧化活性)的影响。
1.2.2 热水处理对鲜切黄瓜感官品质的影响 将在本地市场上购买的新鲜黄瓜用清水洗净,实验室条件(25℃)风干,切成4~5mm厚的薄片,进行表1所示处理,处理之后立即用20℃冷水冷却1min,对鲜切黄瓜进行感官评定。表1所示处理条件根据文献资料[13]及热水处理鲜切黄瓜的预实验确定。
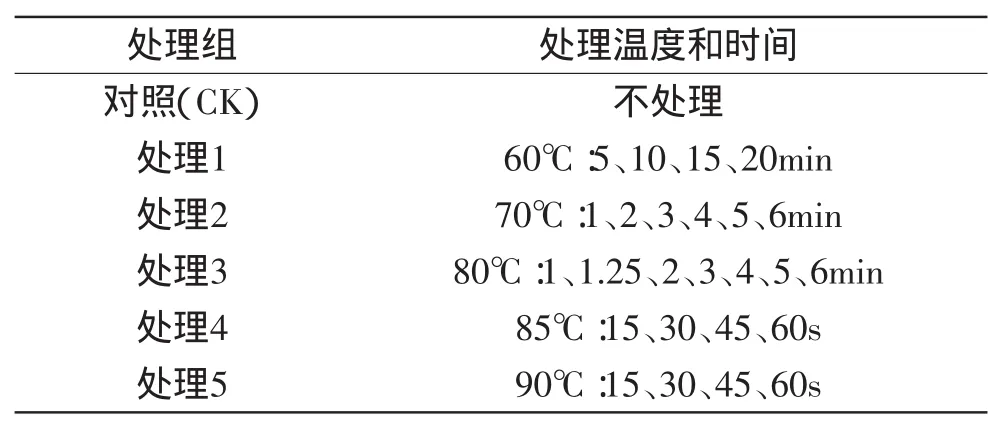
表1 热水处理鲜切黄瓜条件Table 1 Temperature and time of hot water treatments for fresh-cut cucumber
1.2.3 菌悬液制备及接种 无菌操作条件下,将致病菌接种于脑心浸液琼脂平板上,于(37±1)℃培养24h,取培养物,用无菌蛋白胨水(0.85%)将菌苔洗下,制成菌悬液,菌悬液浓度约为8log CFU/mL[14]。无菌操作条件下,将鲜切黄瓜在菌悬液中浸沾10min,风干0.5h。
1.2.4 体外热水处理食源性致病菌 将9mL无菌水加入到试管中,加热至需要温度,迅速加入1mL菌悬液,同时计时,达到需要的时间后取出,迅速用凉水(20℃)冷却,不加热的试管样品作为对照。对于每一个处理,各自吸取1mL,加入到9mL 0.85%的无菌蛋白胨水中,制成10-2稀释液,如此连续稀释。
1.2.5 热水处理接种的鲜切黄瓜 据1.2.2和1.2.4的实验结果选择热水处理条件,在无菌条件下,对接种的鲜切黄瓜进行热水处理。处理完成后,每25g装入一个无菌袋中,加入225mL无菌蛋白胨水,用均质拍打机处理60s(6h/s),制成1∶10的样品匀液。准确吸取1∶10的样品匀液1mL,放入装有9mL 0.85%无菌蛋白胨生理盐水的试管中迅速振摇,制成10-2浓度的稀释液,如此连续稀释。
1.2.6 食源性致病菌的计数 对于每一个样品,选用合适的三个连续稀释度的样品液进行平板计数。分别吸取100μL样品液加到HE琼脂培养基/PALCAM琼脂培养基平板上,用涂布棒涂布至干。每个稀释度的样品液涂布两个平皿(如果某一样品液在取出供试部分前的放置时间超过3min,应按上述方法再振摇该样品液)。
涂布完成后,翻转平皿,于(36±1)℃的恒温培养箱内培养18~24h。根据同一稀释度的两个平板菌落数的平均值或两个稀释度的平板菌落数平均值乘以相应稀释倍数计算出每克样品中菌落数。
1.3 测定指标及方法
1.3.1 鲜切黄瓜感官评定 鲜切黄瓜感官评定标准[7]如表2所示。

表2 鲜切黄瓜感官评定标准Table 2 Standard for organolrptic evaluation of fresh-cut cucumber
1.3.2 鲜切黄瓜细胞膜透性的测定 参考赵世杰等[15]方法,采集圆柱状果肉,切成1mm厚组织圆片,50mL去离子水淋洗,吸干表面水分,装入盛有15mL去离子水的具塞试管中,真空泵抽气20min,25℃保温1h,测定初电导值(S1)以及所用无离子水的电导(S0),测毕,置沸水浴10min,取出后在25℃水浴中平衡10min,摇匀,测终电导(S2)。相对电导率(L,%)=[(S1-S0)/(S2-S0)]×100。
1.3.3 鲜切黄瓜硬度测定 应用TA-XT2i物性测试仪进行测定。
测定参数[16]为:测量模式:TPA;测量参数:测试前速度:1.0mm/s,测试速度:0.5mm/s,测试后速度:1.0mm/s,距离:1.0mm,时间:3.0s;探头:P5(直径5mm)。
1.3.4 鲜切黄瓜可溶性固形物含量测定 用日本ATAGO PAL-1数显糖度计测定。
1.3.5 鲜切黄瓜抗氧化活性测定 采用DPPH法测定,参照胡喜兰等[17]的方法。
1.4 数据分析
实验数据用Sigmaplot 12.1(Systat Software Inc,USA)统计作图,方差分析及差异显著性检验(LSD)用SPSS 16.0软件分析。
2 结果与分析
2.1 鲜切黄瓜热水处理条件的初步确定
由表1预实验筛选鲜切黄瓜热水处理条件见表3。由表3可以看出,热水处理会降低鲜切黄瓜的感官品质。根据实验结果,选择鲜切黄瓜硬度、颜色及口感评分都在4以上的热水处理温度及时间,进行体外热水处理食源性致病菌的实验。
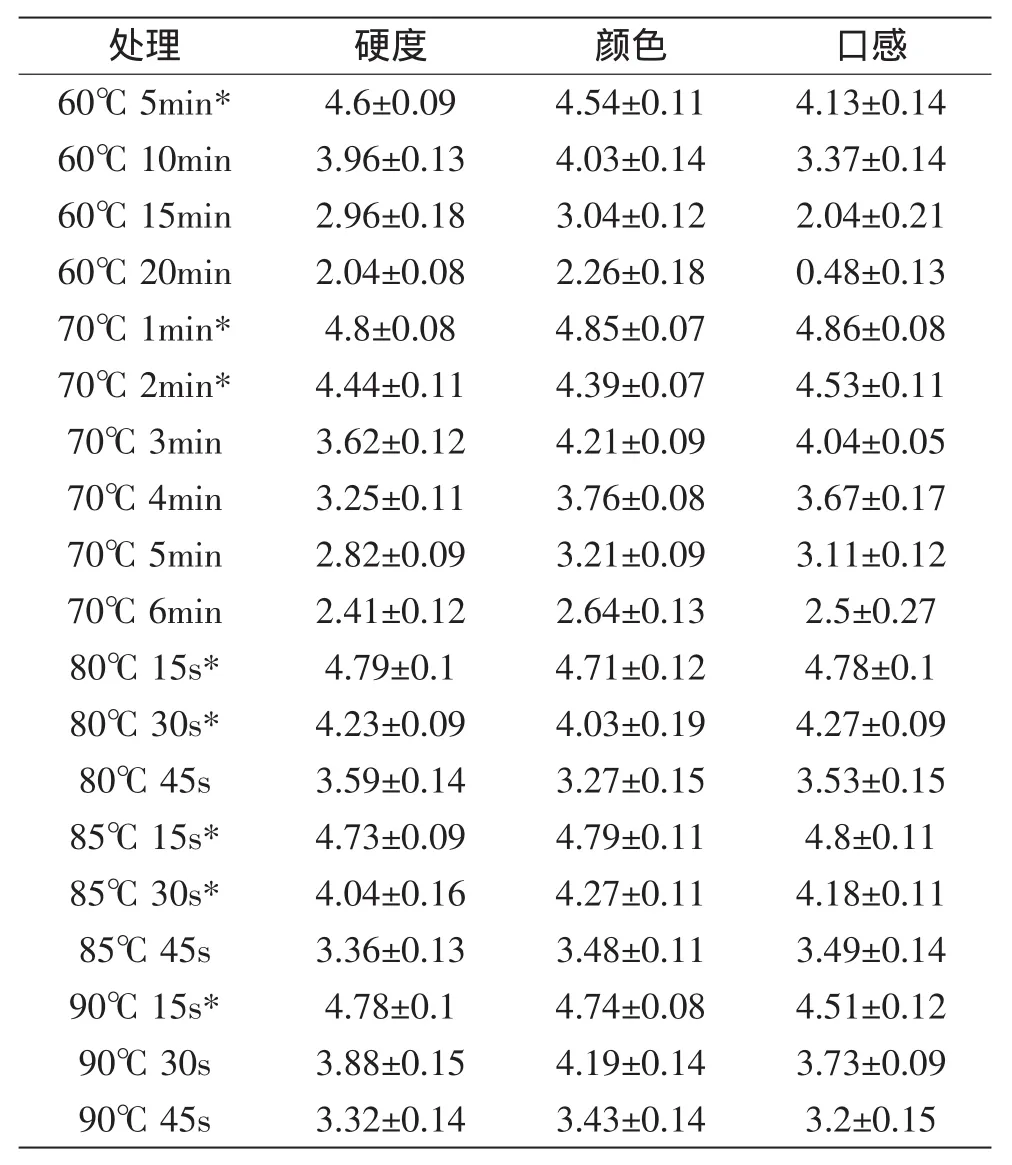
表3 不同热水处理条件对鲜切黄瓜感官品质的影响Table 3 Effect of hot water treatment on organoleptic evaluation of fresh-cut cucumber
2.2 鲜切黄瓜热水处理条件的最终确定
由图1~图2可以看出,体外热水处理可以有效降低食源性致病菌的数量,60℃ 5min、70℃ 1min、70℃2min、80℃15s、80℃ 30s、85℃ 15s、85℃ 30s及90℃15s条件下,可减少鼠伤寒沙门氏菌的数量为2.53~4.87log CFU/mL,减少单增李斯特菌的数量为2.53~4.97log CFU/mL。温度越高,对鼠伤寒沙门氏菌和单增李斯特菌的灭杀效果越好;相同的温度条件下,时间越长灭杀效果越好。随热水处理条件的变化,两种菌的变化趋势一致。其中,90℃15s热水处理条件效果最好,减少鼠伤寒沙门氏菌和单增李斯特菌的数目分别为4.87、4.97log CFU/mL。由此可以看出,与低温较长时间处理相比,高温瞬时处理能更有效地杀灭食源性致病菌。结合感官品质评定结果,选取60℃5min,70℃ 1min,70℃ 2min,80℃ 15s,85℃ 15s以及90℃15s作为鲜切黄瓜的热水处理条件。
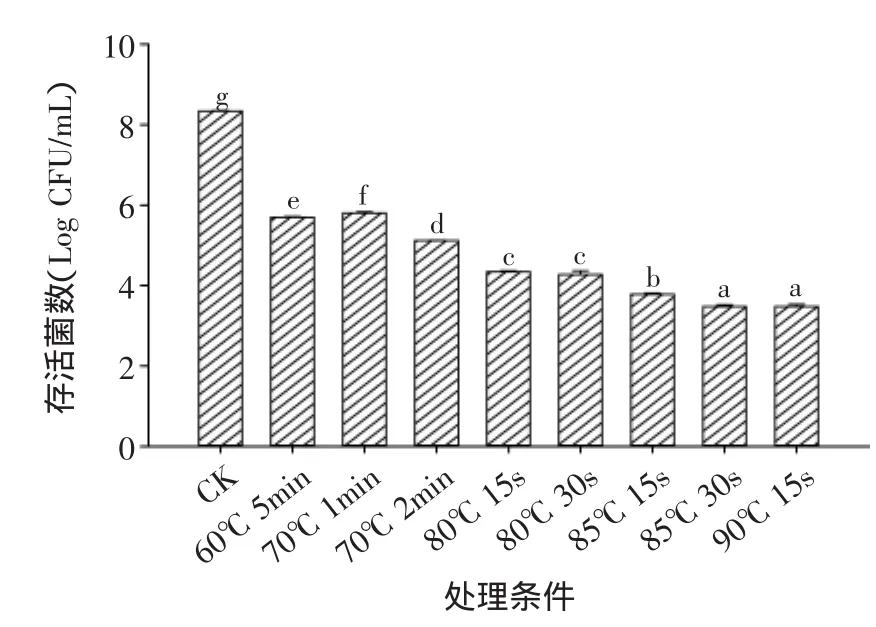
图1 体外热水处理对鼠伤寒沙门氏菌的灭杀效果Fig.1 Inactivity of hot water treatment for S.Typhimurium in vitro

图2 体外热水处理对单增李斯特菌的灭杀效果Fig.2 Inactivity of hot water treatment for L.monocytogenes in vitro
2.3 热水处理对鲜切黄瓜上食源性致病菌的灭杀效果
由图3~图4可以看出热水处理可以有效减少鲜切黄瓜表面食源性致病菌的数目,在初始染菌浓度为5.42log CFU/g的鼠伤寒沙门氏菌和5.16log CFU/g的单增李斯特菌条件下,常温清水浸泡1min减少鼠伤寒沙门氏菌和单增李斯特菌的数目分别为0.43、0.02log CFU/g,热水处理减少两种菌的数目均≥0.77log CFU/g,其中,60℃ 5min及70℃ 2min热水处理的鲜切黄瓜检测不到鼠伤寒沙门氏菌的存在,同时60℃5min热水处理也检测不到单增李斯特菌的存在;而高温瞬时热水处理,如80℃ 15s,85℃ 15s和90℃15s对两种食源性致病菌的灭杀效果明显不如60℃ 5min,70℃ 1min和70℃ 2min热水处理,说明与高温短时间处理相比,低温较长时间热水处理能更有效地减少鲜切黄瓜表面的食源性致病菌。
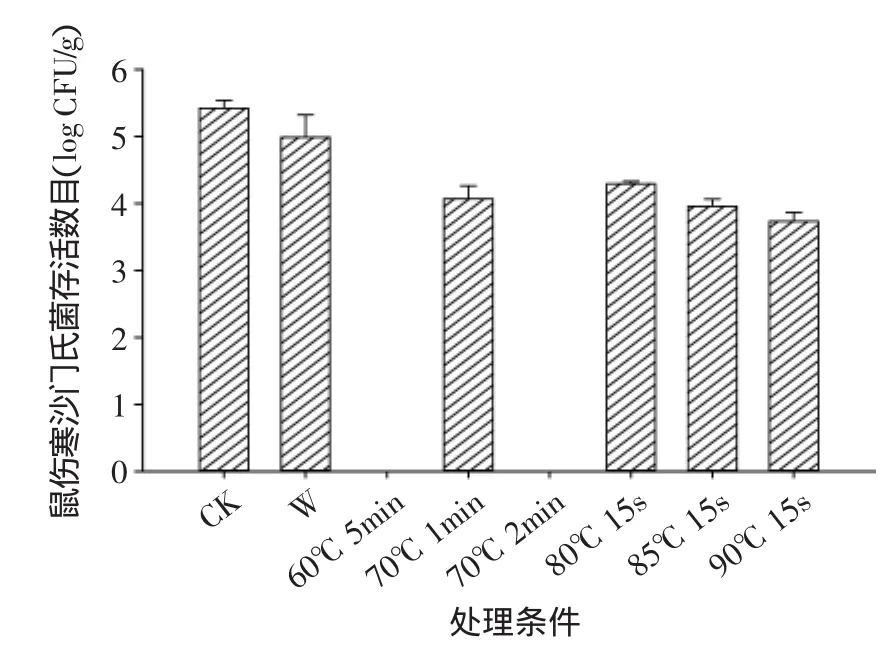
图3 热水处理对鲜切黄瓜表面鼠伤寒沙门氏菌的灭杀效果Fig.3 Inactivity of hot water treatment for S.Typhimurium on fresh-cut cucumber

图4 热水处理对鲜切黄瓜表面单增李斯特菌的灭杀效果Fig.4 Inactivity of hot water treatment for L.monocytogenes on fresh-cut cucumber
2.4 热水处理对鲜切黄瓜品质的影响
相对电导率是衡量细胞膜透性的重要指标,其值越大,表示电解质的渗漏量越多,细胞膜受害程度越重[18],由图5可知热水处理的鲜切黄瓜相对电导率显著高于对照样品,说明热水处理严重破坏了鲜切黄瓜的细胞膜,导致鲜切黄瓜品质下降。
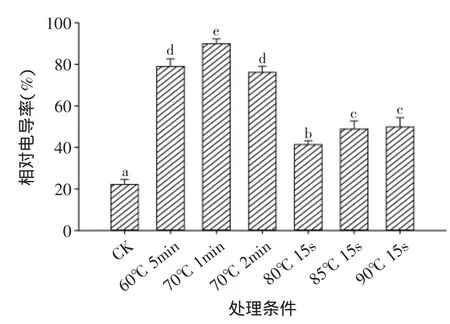
图5 热水处理对鲜切黄瓜相对电导率的影响Fig.5 Effect of hot water treatment on relative electroconductibility
图6和图7中可以看出热水处理对鲜切黄瓜的硬度和可溶性固形物含量影响不大,只有70℃ 2min热水处理显著降低了鲜切黄瓜的硬度值,其他处理样品与对照之间没有明显差异。
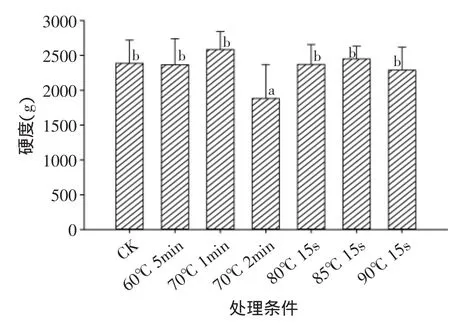
图6 热水处理对鲜切黄瓜硬度的影响Fig.6 Effect of hot water treatment on firmnessfirmness
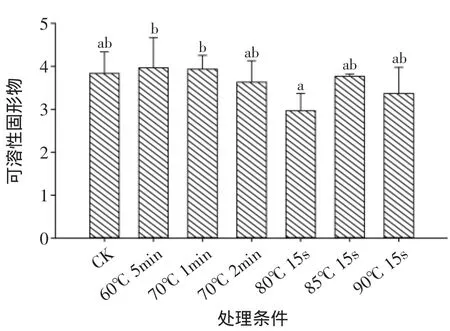
图7 热水处理对鲜切黄瓜可溶性固形物的影响Fig.7 Effect of hot water treatment on soluble solids
图8可以看出,热水处理显著降低了鲜切黄瓜的抗氧化活性(损失58.47%~63.95%),热水处理样品之间的抗氧化活性值没有明显差别。

图8 热水处理对鲜切黄瓜抗氧化值的影响Fig.8 Effect of hot water treatment on antioxidant activity
实验中采用DPPH法测定鲜切黄瓜抗氧化活性,综上所述,60℃ 5min、70℃ 1min、70℃ 2min、80℃15s、85℃ 15s、90℃ 15s热水处理会破坏鲜切黄瓜的细胞膜,降低其抗氧化活性,但对鲜切黄瓜的硬度和可溶性固形物含量影响不明显(除70℃2min热水处理显著降低了样品的硬度外)。
3 结论与讨论
3.1 本研究结果表明,热水处理显著降低了鲜切黄瓜上和试管中鼠伤寒沙门氏菌和单增李斯特菌数量,但是热水中实验与鲜切黄瓜的结果有所不同。体外热水实验中,高温短时间的热水处理比较低温度和较长时间的热水处理更能有效地减少食源性致病菌,而在热水处理鲜切黄瓜上趋势相反,可能的原因是长时间的热水处理能更有效地减少致病菌在鲜切黄瓜上的附着。本实验结果与Spinks等[19]的研究结果一致,55~65℃对清除致病菌是关键温度范围,并且支持了热水操作体系最低温度为60℃的理论。
3.2 实验结果表明,热水处理显著提高了鲜切黄瓜的相对电导率,降低了其抗氧化活性,但是除70℃2min热水处理显著降低了样品的硬度外,其他条件均对鲜切黄瓜的硬度及可溶性固形物的含量没有明显的影响,而且感官品质仍在可接受范围,这说明适宜的热水处理可以作为杀灭食源性致病菌,保持鲜度的技术措施。实验结果显示,60℃5min热水处理的鲜切黄瓜,食源性致病菌从高起始染菌量降低到检测线以下,而且感官上仍然鲜脆。
[1]Clemens R.The expanding US market for fresh produce[J].Iowa Agric Rev,2004,10(1):1-4.
[2]Lin BH.Fruits and vegetables consumption:looking ahead to 2010[N].Washington D C:U.S.Dept of Agriculture,Economic Research Service,2004:1-4.
[3]Berger C N,Sodha S V,Shaw R K,et al.Fresh fruit and vegetables as vehicles for the transmission of human pathogens[J].Environmental Microbiology,2010,12(9):2385-2397.
[4]Chua D,Goh K,Saftner R A,et al.Fresh-cut lettuce in modified atmosphere packages stored at improper temperatures supports enterohemorrhagic E.coli isolates to survive gastric acid challenge[J].Food Microbiology and Safety,2008,73(3):148-153.
[5]Singh N,Singh R K,Bhunia A K,et al.Efficacy of chlorine dioxide,ozone,and thyme essential oil or a sequential washing in killing Escherichia coli O157:H7 on lettuce and baby carrots[J].Lebensmittel-Wissenschaftund-Technologie,2002,35(8):720-729.
[6]Gálvez A,Abriouel H,Benomar N,et al.Microbial antagonists to food-borne pathogens and biocontrol[J].Current Opinion in Biotechnology,2010,21(2):142-148.
[7]Gabriela L V,Alejandro T C,Adrian S,et al.Chlorine dioxide dose,water quality and temperature affect the oxidative status of tomato processing water and its ability to inactivate Salmonella[J].Food Control,2012,26(1):28-35.
[8]Farber J N,Harris L J,Parish M E,et al.Microbiological safety of controlled and modified atmosphere packaging of fresh and fresh-cut produce[J].Comprehensive Reviews in Food Science and Food Safety,2006,2(1):142-160.
[9]Orta-Ramirez A,Smith D M.Thermal inactivation of pathogens and verification of adequate cooking in meat and poultry products[J].Advances in Food and Nutrition Research,2002,44:147-194.
[10]Hassani M,Álvarez I,Raso J,et al.Comparing predicting models for heat inactivation of Listeria monocytogenes and Pseudomonas aeruginosa at different Ph[J].International Journal of Food Microbiology,2005,100(1-3):213-222.
[11]Alegria C,Pinheiro J,Gonçalves E M,et al.Evaluation of a pre-cut heat treatment as an alternative to chlorine in minimally processed shredded carrot[J].Innovative Food Science and Emerging Technologies,2010,11(1):155-161.
[12]苏亚东,王庆国,陈玉贞,等.热激处理对黄瓜片保鲜效果的影响[J].农业工程学报,2011,27(3):381-387.
[13]冯晓慧,王庆国,王仁欢,等.牛肉中单增李斯特菌的热失活模型[J].微生物学报,2011,51(5):684-691.
[14]Callegan M C,Hobden J A,Hill J M,et al.Topical antibiotic therapy for the treatment of experimental staphylococcus aureus keratitis[J].Investigative Ophthalmology & VisualScience,1992,33(11):3017-3023.
[15]赵世杰,史国安,董新纯,等.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002:129-131,142-143.
[16]Wtada A E,Qi L.Quality of fresh cut produce[J].Postharvest Biology and Technology,1999,15(1):201-205.
[17]胡喜兰,韩照祥,陶莹,等.DPPH法测定17种植物的抗氧化活性[J].食品科技,2006(10):264-268.
[18]陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88-91.
[19]Spinks A T,Dunstan R H,Harrison T,et al.Thermal inactivation of water-borne pathogenic and indicator bacteria at sub-boiling temperatures[J].Water Research,2006,40(6):1326-1332.

