干旱条件下AM真菌对植物生长和土壤水稳定性团聚体的影响
叶佳舒,李 涛,胡亚军,郝志鹏,高彦征,王幼珊,陈保冬,*
(1.南京农业大学资源与环境科学学院,南京 210095;2.中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085;3.北京市农林科学院植物营养与资源研究所,北京 100097)
我国是世界上受土壤退化影响最严重的国家之一,而土壤侵蚀和水土流失是最主要、危害最严重的土壤退化形式[1]。在退化土壤地区特别是退化荒地,水土流失严重地区以及沙漠化地区大力恢复植被是生态重建的必然选择,而改善土壤结构提高土壤保水保肥能力是进行植被重建的关键环节之一。
土壤结构的形成是土壤生态系统中物理、化学和生物诸因素综合作用的结果[2]。在诸多影响因素中,生物因子对土壤结构的稳定起着重要作用。Díaz-Zorita等人指出土壤大团聚体(>250 μm)主要是由土壤根系和真菌菌丝胶结作用形成,而微团聚体(<250 μm)则非常稳定,主要是通过多价阳离子桥和多糖形成[3],即使经过50a轮作,其数量仍变化较小[4]。充分挖掘植物和真菌的生物作用潜能将更有效地促进土壤大团聚体形成,从而稳定土壤结构。
在自然界中近85%的植物种类和几乎所有的农作物能够形成丛枝菌根(arbuscular mycorrhiza,AM)[5]。AM真菌不仅通过多种途径影响植物的矿质营养和生长发育过程,同时还能够在植物群落、植物个体根系和根外菌丝体三个层次上对土壤结构产生深刻影响[6]。AM真菌及其多样性是植物群落构成的重要影响因子[7],而植物群落组成的变化将会影响土壤结构。在个体根系层次,菌根真菌能改变植物根系形态[8],最终能影响根系对土壤的穿透[9]和缠绕作用[10]。在菌丝体层次,AM真菌通过生物化学作用、生物作用和生物物理作用深刻地影响着土壤结构。菌丝体产生的球囊霉素(Glomalin)具有“超级胶水”的性能,比其他土壤碳水化合物黏附土壤颗粒的能力强3—10倍[11-12],因而在土壤颗粒黏附成大聚合体的过程中发挥着重要作用。从生物物理作用角度,根外菌丝能通过物理缠结作用,菌丝交结作用[13]以及改变土壤干湿循环作用[14],促进土壤团聚体的形成。试验数据表明,AM真菌对土壤大团聚体的形成与稳定具有重要作用[15],而根据“团聚体形成等级学说”,微团聚体形成在很大程度上又受到大团聚体周转的影响[16]。可见,AM真菌作为大多数植物根系和土壤密切联系的桥梁,能够在不同层次,运用不同的作用,促进土壤团聚体的形成,改善土壤结构,进而改善土壤的耕性和土壤肥力,减少土壤侵蚀和水土流失,保持土壤生态系统的稳定性。
有关AM真菌影响土壤结构的效应及机制已有较为系统深入的研究[6,17],最近的研究报道也揭示了不同种属AM真菌影响土壤结构作用潜力的差异[18]。然而,目前为止对于不同水分条件下AM真菌对土壤水稳性团聚体形成和结构稳定性的影响尚未见报道。众所周知,水分条件是土壤团聚体和土壤结构形成的重要影响因素,干湿交替对于土壤团粒结构形成具有关键作用[19],而施加保水剂则通常被作为改善土壤结构和水分状况的重要技术措施[20-21]。另一方面,土壤水分条件也直接影响到菌根共生体的发育和机能。干旱胁迫下,菌根侵染率通常会严重下降[22-23]。基于此,本研究选择菌根研究模式植物紫花苜蓿(Medicago sativa L.)为植物材料,通过分室盆栽试验研究干旱胁迫下不同种属AM真菌对紫花苜蓿生长和土壤团聚体形成的影响,同时综合分析土壤理化性质和植物生理指标以揭示菌根作用机制,旨在为筛选具有干旱生态适应性的菌株用于退化土壤生态恢复提供科学依据。
1 材料与方法
1.1 试验装置
本试验采用三分室培养系统:中间分室为植物生长室(PC);一侧分室以孔径1 mm粗尼龙网与植物生长室分隔,允许根系和根外菌丝通过,作为菌根室(MC);另一侧分室以孔径37 μm的尼龙网与植物生长室分隔,仅允许菌丝通过,作为菌丝室(HC)。分室培养系统长(3+3+3)cm,宽10 cm,高12 cm。应用这种培养系统可比较分析根系和菌丝对水稳定性土壤团聚体的影响,从而揭示AM真菌影响土壤结构的直接和间接作用。
1.2 试验材料
供试土壤采自中国科学院植物研究所多伦恢复生态学试验示范研究站(42°02'N,116°17'E),土壤基本理化性质:pH 值(水土比 1∶2.5)7.02,速效磷(0.5 mol/L NaHCO3提取,钼锑抗比色)6.73 mg/kg,全氮(元素分析仪,Vario ELⅢ,Elementar company,Germany)0.17%,有机质(重铬酸钾氧化法)30.45 g/kg,最大田间持水量(环刀法)24.22%。土壤风干后过2 mm筛,送至中国农业科学院原子能所辐照中心采用25 kGy γ射线辐照灭菌。将土壤以每盆用量1.08 kg分装到干净自封袋内,加入基础养分:30 mg/kg P,120 mg/kg N和120 mg/kg K。最后,加入10 mL土壤微生物过滤液,与土壤混匀风干后装入盆中。土壤微生物过滤液以未灭菌土壤与无菌水体积分数1∶40混合,100 r/min匀速振荡30 min,以双层孔径2—4 μm滤纸过滤获得。
供试植物:紫花苜蓿(Medicago sativa L.),品种为“阿尔冈金”,购自中国农业科学院。植物种子以10%H2O2表面消毒10 min,催芽后播种。
供试 AM真菌菌种:细凹无梗囊霉(Acaulospora scrobiculata Trappe BGC HK02A)、沾屑多孢囊霉(Diversispora spurcum syn.Glomus spurcum Pfeiffer,Walker& Bloss BGC SD03)和根内球囊霉(Glomus intraradices Schenck and Smith BGC AH01)。3种菌剂均由北京市农林科学院中国丛枝菌根真菌种质资源库(BGC)提供,按照30 g/kg土菌剂量,采用湿筛-倾注-孢子离心法将孢子筛出,以孢子悬浮液形式加入植物生长室,并与植物生长室土壤搅拌混匀。未接种对照加入等体积孢子滤液(由孢子悬浮液通过双层慢速定量滤纸获得),以保证土壤中微生物区系一致。
1.3 试验设计
对紫花苜蓿分别接种A.scrobiculata、D.spurcum或G.intraradices,同时设不接种对照。正常水分处理土壤重量含水量为15%(相当于70%最大田间持水量),干旱处理为7%,幼苗生长两周后开始进行不同水分处理。试验为双因素完全随机区组设计,共8个处理,每处理重复4次,总计48盆。
1.4 试验管理
试验在中国科学院生态环境研究中心智能温室中进行。试验期间保持室内温度为25℃,空气湿度60%,每天光照时间16 h,光照不足时以高压钠灯补充光照。为减少浇水对土壤带来的扰动,分别在菌根室与菌丝室内侧加入两根带筛孔的塑料管,每日称重浇水。
1.5 试验收获与样品分析
植物生长6个月后,分别收获植物地上部和根系,根系分为植物生长室与菌根室两部分。将植物生长室中植物地上部剪下,并从土壤中拣出根系用水清洗干净。菌根室与菌丝室中的土壤分别沿自然结构小心掰成小土块,并将菌根室土壤中根系挑出,清洗干净。植物样品放入-20℃冰箱保存,菌根室和菌丝室土壤样品风干备用。
1.5.1 菌根指标
植物根系洗净后剪成1 cm左右小段,采用曲利苯蓝染色-根段法观测菌根侵染率[24-25]。
土壤菌丝密度采用网格交叉法测定[26]。称4 g风干土,置于200 mL塑料杯中,加入100 mL水与12 mL 37 g/L六偏磷酸钠,剧烈摇动后静置,而后将悬浮液过双层土壤筛,以250 mL水冲洗下层筛网上的菌丝样品至搅拌器中搅拌,吸取5 mL悬浊液抽滤制作滤膜样片,显微镜下进行观测,根据公式计算土壤菌丝密度。
1.5.2 植物生理生化指标
脯氨酸含量采用酸性茚三酮法测定[27]。在试验收获前取新鲜植物叶片0.1 g,用3%磺基水杨酸研磨提取,匀浆转入离心管后沸水浴浸提10 min。冷却后3000 r/min离心10 min,取上清液2 mL,加入2 mL 3%磺基水杨酸、2 mL冰乙酸和4 mL 2.5%酸性茚三酮溶液置沸水显色60 min,冷却后加入4 mL甲苯萃取红色物质。静置后,取甲苯相测定520 nm波长吸光值。
剩余植物样品置105℃烘箱中杀青,调至70℃烘干至恒重,称干物重,而后用球磨仪粉碎。称取0.5 g左右粉碎样品于消煮管中,加入10 mL浓HNO3进行微波消解,将消煮液转移至50 mL容量瓶并用超纯水定容,过滤,制备待测液。采用ICP-AES(Optima-2000DV)测定磷浓度[17]。
1.5.3 土壤理化指标
土壤基本理化性质参照鲍士旦主编的《土壤农化分析》(第三版)[28]所述方法测定。土壤有机质用重铬酸钾氧化法,pH用电位法,速效N用碱解扩散法,有效磷测定采用钼锑抗比色法,最大田间持水量用环刀法测定。土壤全N和全C由元素分析仪(Vario ELⅢ,Elementar Company,Germany)测定[29]。
球囊霉素相关土壤蛋白(glomalin-related soil protein,GRSP)采用考马斯亮蓝法[21]测定。根据其不同提取方式GRSP可分为总球囊霉素相关土壤蛋白(T-GRSP)和易提取球囊霉素相关土壤蛋白(EE-GRSP)。TGRSP提取方法:称取0.5 g风干土,加入4 mL 50 mmol/L pH 8.0柠檬酸钠浸提剂,在100 kPa 121℃条件下连续提取3次,每次60 min;EE-GRSP提取方法:称取0.5 g风干土,加入8 mL pH 7.0 20 mmol/L的柠檬酸钠浸提剂,在100 kPa 121℃条件下提取30 min。将提取液在10000 r/min下离心5 min,收集上清液。吸取上清液0.5 mL,加入5 mL考马斯亮蓝G-250染色剂,在595 nm波长下比色。用牛血清蛋白标液-考马斯亮蓝法显色绘制标准曲线,计算提取球囊霉素土壤相关蛋白的含量。
1.5.4 土壤水稳定性团聚体
土壤水稳定性团聚体测定采用湿筛法[30]。称取40 g风干土,将土壤样品置于套筛顶层。套筛由2、1、0.5、0.25 mm筛网由上到下组成,将套筛浸泡在水中,使土壤样品浸水10 min后,上下移动套筛,2 min内50次,上下移动幅度3 cm。然后将留在套筛每层筛网上的土壤样品在105℃烘干称重。计算土壤各粒级水稳定性团聚体所占比例。平均重量直径(mean weight diameter,MWD)按照如下公式计算:
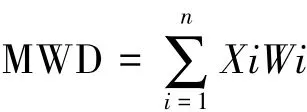
几何平均直径(geometric mean diameter,GMD)按照如下公式计算:
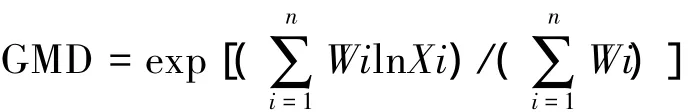
式中,Xi为筛分出来的第i粒级团聚体平均直径;Wi为筛分出来的第i粒级团聚体重量占土壤样品总重百分数。
1.6 数据分析
采用 Excel和SPSS(SPSS 13.0 for Windows,SPSS Inc,Chicago,USA)对数据进行统计分析和作图。双因素方差分析检验接种AM真菌和水分处理二者之间的交互作用。当接种处理与水分处理交互作用显著时,采用Duncan新复极差法将全部处理统一进行多重比较。当接种处理与水分处理交互作用不显著时,在同一水分处理下,不同接种处理数据按Duncan新复极差法进行多重比较;同一接种处理下,采用T检验比较两个水分处理之间的差异显著性。应用Pearson相关系数进行数据相关分析。
2 试验结果
2.1 菌根侵染状况
正常供水条件下,3种AM真菌均对紫花苜蓿形成良好侵染,G.intraradices侵染率接近72%,其次为A.scrobiculata,侵染率接近52%,D.spurcum侵染率最低,仅20%左右。干旱处理显著降低了所有3个菌种的菌根侵染率,但A.scrobiculata和D.spurcum侵染率降低至2%左右,而G.intraradices侵染率维持在20%,显著高于其它菌种(表1)。
在个别未接种处理根段内观测到菌根共生结构,因而有极低的菌根侵染率,推测为培养过程中出现不可控的污染。
相同水分条件下,菌丝室中接菌处理的菌丝密度显著高于未接菌处理。正常水分处理下,接种G.intraradices菌丝室中菌丝密度显著高于其它接种处理。
2.2 植株生物量
干旱处理显著降低了植株地上部、根系及总生物量。在正常水分条件下,3种接种处理植物地上部、根系及总生物量均显著高于未接菌处理。干旱条件下,3种接种处理与未接种处理相比,地上部、根系及总生物量均无显著差异,但接种G.intraradices和D.spurcum趋于提高植物总生物量,而接种A.scrobiculata有降低植物生物量趋势。不同菌种之间,接种G.intraradices处理的植株总生物量显著高于A.scrobiculata接种处理。

表1 干旱胁迫下不同AM真菌对紫花苜蓿侵染状况及植株生物量Table 1 Colonization of different AM fungal species on M.sativa and the mycorrhizal effects on plant growth under drought stresses
2.3 植株磷浓度和吸磷量
由表2可知,干旱胁迫显著降低了植物根系磷浓度,对于未接种和D.spurcum接种处理,干旱胁迫也显著降低了植株地上部磷浓度。无论是地上部、根系吸磷量还是植株总吸磷量,均因干旱处理而显著降低。
正常水分条件下,与未接种相比,3个接种处理对植株地上部磷浓度无显著影响,但均显著提高了植株根系磷浓度。相应地,接种3种AM真菌显著提高了植株地上部和根系吸磷量及植物吸磷总量。在3个不同菌种之间,G.intraradices接种处理植株吸磷总量显著高于其它菌种。干旱胁迫下,总体上只有G.intraradices接种处理能够促进植物对磷的吸收,植株磷浓度和吸磷量均显著高于其它接种处理,而A.scrobiculata和D.spurcum接种处理植株磷浓度和吸磷量和未接种处理基本无异。
2.4 土壤有效磷
无论是菌根室还是菌丝室,干旱处理下土壤有效磷含量普遍显著高于正常水分处理(表2)。
正常水分条件下,相比未接种处理,接种3种AM真菌均显著降低了菌根室和菌丝室中土壤有效磷含量,而以接种G.intraradices处理最低。干旱处理下,仅有G.intraradices处理显著降低了土壤有效磷含量。

表2 干旱胁迫下不同菌种对植物磷浓度、吸磷量及土壤有效磷的影响Table 2 Effects of different AM fungal species on the content of concentration of P and total P in host plants and soil available P under drought stress
2.5 植物叶片脯氨酸含量
干旱胁迫显著提高了植物叶片脯氨酸含量(图1)。无论正常水分或干旱处理,与未接种相比,接种3种AM真菌均使叶片脯氨酸含量下降。正常水分条件下,G.intraradices接种处理叶片脯氨酸含量显著低于未接种处理,而干旱处理下,A.scrobiculata和D.spurcum接种处理与未接种处理之间差异显著。
2.6 土壤GRSP含量
由表3可见,无论是水分还是接种处理对菌根室中GRSP含量均无显著影响。在菌丝室中,水分处理对GRSP含量也没有显著影响,而接种处理对T-GRSP含量表现出显著影响:G.intraradices接种处理T-GRSP含量显著高于其它接种处理,A.scrobiculata和D.spurcum接种处理则与对照无显著差异。
2.7 土壤水稳定性团聚体
在菌根室中,水分处理仅影响到2—1 mm水稳性土壤团聚体和水稳性团聚体总百分含量,正常水分条件下2—1 mm水稳性团聚体百分含量相对高于干旱处理(表4)。
菌根主要影响到 >1 mm大团聚体含量:提高>2 mm团聚体含量,而降低2—1 mm团聚体含量。正常水分条件下,G.intraradices接种处理MWD和GMD相对高于其它接种处理,而干旱情况下,A.scrobiculata接种处理MWD和GMD明显低于其它接种处理(表4)。
在菌丝室中,各级水稳性土壤团聚体百分含量及MWD、GMD等土壤结构指标普遍受到水分处理显著影响:相对于正常水分情况,干旱处理下>2 mm团聚体含量显著升高,2—1 mm团聚体无明显变化,而<1 mm团聚体含量显著下降。水稳性团聚体总百分数、MWD和GMD在干旱情况下均显著升高(表5)。

图1 干旱胁迫下接种不同AM真菌对紫花苜蓿叶片脯氨酸含量的影响Fig.1 Effects of different AM fungal species on the leaf proline contents of M.sativa under drought stress

表3 干旱胁迫下不同AM真菌对土壤GRSP含量的影响Table 3 Effects of different AM fungal species on the GRSP content in soil under drought stress

表4 干旱胁迫下不同AM真菌侵染紫花苜蓿根系对土壤水稳定性团聚体百分含量、MWD和GMD影响Table 4 Effects of M.sativa roots colonized by different AM fungal species on the content,MWD and GMD of water-stable soil aggregates under drought stress
AM真菌主要影响到>2 mm水稳定性团聚体。在正常水分和干旱条件下,相对于未接种处理,接种3种AM真菌均提高了>2 mm水稳定性团聚体百分含量、水稳性团聚体总百分数及MWD。对于GMD,仅有G.intraradices接种处理在正常水分下表现出显著影响(表5)。
2.8 相关性分析
在菌根室中,菌根侵染率与菌丝室中菌丝密度、>2 mm水稳定性团聚百分数及MWD均呈极显著正相关(P<0.01),与GMD显著正相关(P<0.05)。T-GRSP含量分别与 >2 mm水稳定性团聚百分数、MWD及GMD显著正相关(P<0.05)。
菌丝室中,菌丝密度与T-GRSP含量成显著正相关(P<0.05)。T-GRSP含量与>2 mm水稳定性团聚百分数及MWD显著正相关(P<0.05)。
总体上,EE-GRSP与菌根指标无显著相关。
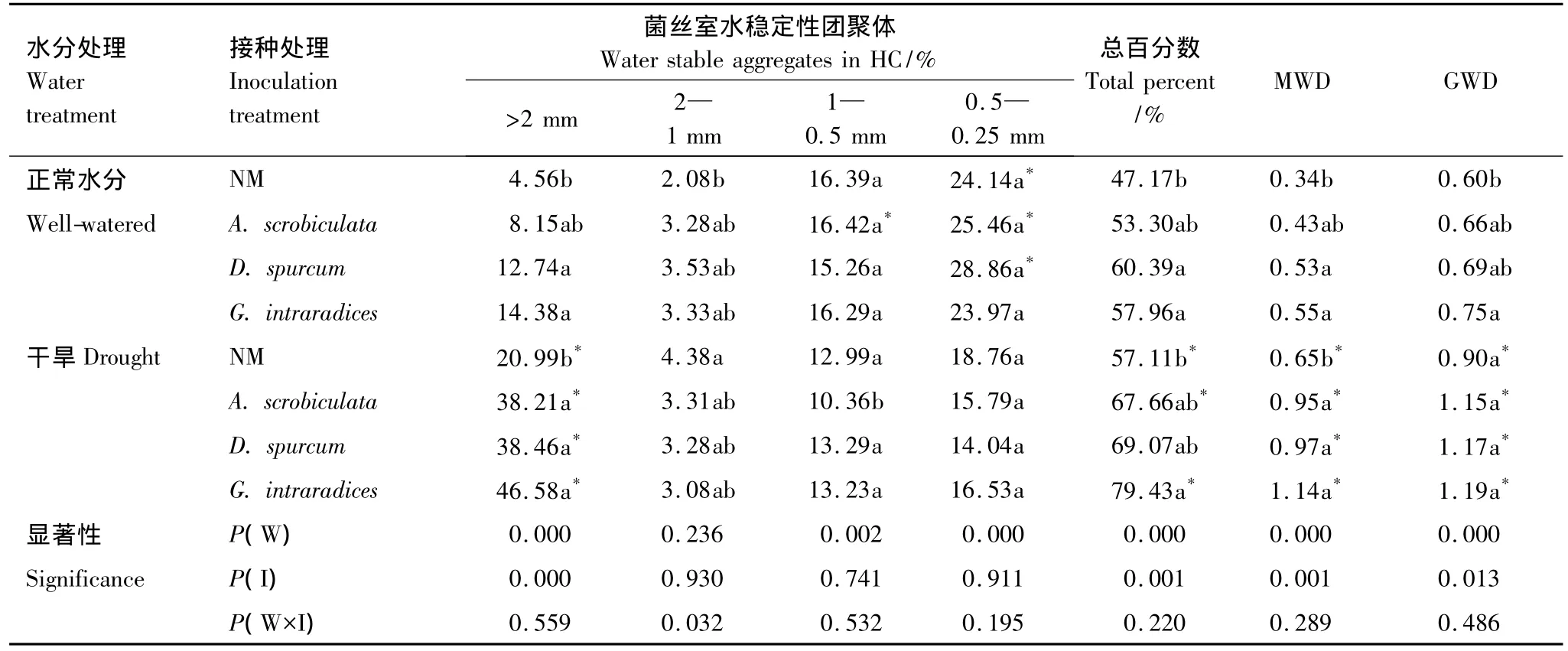
表5 干旱胁迫下不同AM真菌对土壤水稳定性团聚体百分含量、MWD及GMD的影响Table 5 Effects of different AM fungal species on the content MWD and GMD of water-stable soil aggregates under drought stress

表6 各观测指标相关性分析Table 6 Correlation coefficients between variables
3 讨论
本研究在正常水分和模拟干旱条件下探讨了不同AM真菌对植物生长和土壤水稳定性团聚体的影响。正常水分条件下,不同种属AM真菌对紫花苜蓿都体现出明显的促生效应,而在干旱胁迫条件下,仅有G.intraradices依然能够和紫花苜蓿建立良好共生并显著促进植物生长。另一方面,在正常水分和干旱胁迫条件下接种AM真菌对土壤团聚体的形成均有显著积极作用。菌根真菌主要影响到大团聚体(>2 mm)的相对含量,并影响到水稳性团聚体总百分数及平均重量直径(MWD)。
干旱胁迫对菌根共生体的发育具有显著抑制作用,本试验中干旱处理显著降低了菌根侵染率,这与前人研究结果基本一致。贺学礼等在土壤相对含水量为60%条件下接种AM真菌能够显著促进植物生长,而土壤相对含水量为20%时,侵染率显著下降,但接种处理仍有显著促生效应[22]。在王如岩等的研究中,重度干旱(土壤含水量为5%—10%)情况下,根系侵染率均在10%以下,接种AM真菌后滇柏(Cupressus duclouxiana Hichel)幼苗生物量与未接种对照均无显著差异[23]。本试验中尽管干旱胁迫抑制了菌根侵染,发现不同菌种对干旱胁迫的响应存在显著差异。A.scrobiculata和D.spurcum对紫花苜蓿根系侵染率降低至2%左右,已经无益于植物适应逆境胁迫,D.spurcum接种处理甚至趋于降低植物生物量,但G.intraradices侵染率仍高达20%,并表现出显著促生效应。不同菌种抗逆性不同,表明完全有可能筛选出适宜菌种用于提高植物抗逆性,从而促进退化土壤生态恢复。综合分析试验结果,不难发现AM真菌对紫花苜蓿的促生效应与其改善植物磷营养密切相关。正常水分条件下,接种3种菌根真菌均显著提高了植株吸磷量,而在干旱胁迫下,只有接种G.intraradices能够促进植物对磷的吸收。这可能意味着菌根共生体系磷营养效率决定了共生体抗逆能力,而菌根共生体的磷营养效率则很大程度上取决于AM真菌的特定生物学及生理特征。
脯氨酸是植物体内主要渗透调节物质之一。在干旱胁迫下,植物通过合成大量脯氨酸来增强自身渗透调节能力,从而对关键酶、抗逆性蛋白和生物膜起保护作用[31]。已有研究表明,受干旱胁迫的苗木接种AM真菌后根系与叶片中脯氨酸含量显著降低,苗木抗旱性增强[32]。本试验结果也显示,干旱处理下植物叶片脯氨酸含量显著升高,而接种AM真菌后,脯氨酸含量下降,表明菌根共生体系能够缓解干旱胁迫对植物造成的生理伤害。
尽管已有研究证明AM真菌通过促进植物对水分的吸收来增强植物对干旱的适应性[33],但考虑到干旱条件下土壤水分有效性大大降低,土壤水稳定性团聚体作为衡量土壤结构的重要指标,其数量与分布状况会对土壤水分和养分可利用性产生显著影响,故而菌根真菌影响土壤水稳性团聚体数量和分布状况也会潜在影响到植物对土壤水分的利用,或者说改善土壤结构和土壤水分特性也可认为是菌根增强植物抗旱性的一种潜在机制。与以往的研究报道[34-35]相一致,AM真菌主要影响到大团聚体(>2 mm)的形成,并在总体上提高了水稳性团聚体百分含量。另一方面,MWD与GWD作为表征土壤团聚体粒级分布状况的指标,大量研究证明其值越大土壤团聚体水稳定性越高,土壤结构状况越好[36-37]。本试验中,正常水分条件下3种AM真菌均能提高菌根室与菌丝室的MWD值,而在干旱处理中,除菌根室A.scrobiculata处理出现降低,其它接菌处理均呈上升趋势(表5,表6),而G.intraradices接种处理MWD与GMD值在大多数情况下均高于其它处理。这些试验结果一方面表明菌根真菌在土壤团聚体形成的积极作用,另一方面则显示了不同菌种之间的功能差异。干旱情况下G.intraradices在改善土壤结构方面的优异表现也与其增强宿主植物抗旱性的能力相一致。
以往有关菌根真菌与土壤结构的研究中,往往会考虑到球囊霉素相关土壤蛋白(GRSP)的作用。GRSP作为一类稳定的糖蛋白在土壤团聚体形成中起着重要作用[38-39],多数研究认为T-GRSP是AM真菌长期积累的稳定糖蛋白,EE-GRSP则是AM真菌新近产生的[11]。本试验中,菌根室和菌丝室中T-GRSP含量均与 >2 mm水稳定性团聚体及MWD显著正相关,这与前人研究结果基本一致[36,40]。然而,在本试验中并没有发现EE-GRSP与菌根指标及MWD、GMD无相关性,AM菌丝密度与MWD和GMD也无显著相关。这种结果可能与菌丝在土壤中的周转及试验周期有关,但具体原因还需进一步研究。
综上所述,本研究表明干旱胁迫下AM真菌可通过改善植物磷营养、调节植物体内渗透物质含量等多种机制增强植物抗旱性并促进植物生长,同时通过影响土壤大团聚体的形成和水稳性团聚体稳定性调节土壤结构。不同AM真菌与植物形成的共生体有显著不同的逆境适应性,G.intraradices在改善植物矿质营养与促进植物生长方面表现优异,其在提高土壤水稳性团聚体数量与质量方面也明显优于其它菌种,因而可以认为在干旱环境中,G.intraradices具有更强的生态适应性,可能作为干旱地区生态恢复的备选菌种。
[1] Yang L Z,Xu Q.The soil ecosystem.Beijing:Science Press,2005.
[2] Zhong J H,Tang S Y,Tan J.Structure characteristics of red soils and their effective factors.Soil and Environmental Sciences,2002,11(1):61-65.
[3] Díaz-Zorita M,Perfect E,Grove J H.Disruptive methods for assessing soil structure.Soil and Tillage Research,2002,64(1/2):3-22.
[4] Feng G,Zhang Y F,Li X L.Effect of external hyphae of arbuscular mycorrhizal plant on water-stable aggregates in sandy soil.Journal of Soil and Water Conservation,2001,15(4):99-102.
[5] Harley J L.The significance of mycorrhiza.Mycological Research,1989,92(2):129-139.
[6] Rillig M C,Mummey D L.Mycorrhizas and soil structure.New Phytologist,2006,171(1):41-53.
[7] van der Heijden M G A,Klironomos J N,Ursic M,Moutoglis P,Streitwolf-Engel R,Boller T,Wiemken A,Sanders I R.Mycorrhizal fungal diversity determines plant biodiversity,ecosystem variability and productivity.Nature,1998,396(6706):69-72.
[8] Berta G,Fusconi A,Trotta A.VA mycorrhizal infection and the morphology and function of root systems.Environmental and Experimental Botany,1993,33(1):159-173.
[9] Carter M R,Angers D A,Kunelius H T.Soil structural form and stability,and organic matter under cool-season perennial grasses.Soil Science Society of America Journal,1994,58(4):1194-1199.
[10] Miller R M,Jastrow J D.Hierarchy of roots and mycorrhizal fungal interactions with soil aggregation.Soil Biology& Biochemistry,1990,22(5):579-584.
[11] Wright S F,Upadhyaya A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi.Soil Science,1996,161(9):575-586.
[12] Wright S F,Upadhyaya A.A survey of soils for aggregate stability and glomalin,a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi.Plant and Soil,1998,198(1):97-107.
[13] Wessels J G H.Fungi in their own right.Fungal Genetics and Biology,1999,27(2/3):134-145.
[14] Querejeta J I,Egerton-Warburton L M,Allen M F.Direct nocturnal water transfer from oaks to their mycorrhizal symbionts during severe soil drying.Oecologia,2003,134(1):55-64.
[15] Neergaard B B.Influence of arbuscular mycorrhizal fungi on soil structure and soil water characteristics of vertisols.Plant and Soil,2001,229(2):245-258.
[16] Six J,Elliott E T,Paustian K.Soil macroaggregate turnover and microaggregate formation:a mechanism for C sequestration under no-tillage agriculture.Soil Biology and Biochemistry,2000,32(14):2099-2103.
[17] Li T,Zhao Z W.Advance in researches on glomalin produced by arbscular mycorrhizal fungi.Chinese Journal of Ecology,2005,24(9):1080-1084.
[18] Peng S L,Shen H,Zhang Y T,Guo T.Compare different effect of arbuscular mycorrhizal colonization on soil structure.Acta Ecologica Sinica,2012,32(3):863-870.
[19] Yao S H.Soil Biophysical processes involved in decomposition of rice straw incorporated in upland soils under wetting and drying cycles for stabilization of soil carbon pools and soil structure.MD thesis of Nanjing Agricultural University,2005.
[20] Yang K.Effects of organic-inorganic superabsorbent composite on water absorbency and physicochemical properties soils.MD thesis of Gansu Agricultural University,2008.
[21] Yang Y H,Wu J C,Wu P T,Zhao S W,He F,Shi F G.Effect mechanism of straw mulching and water-retaining agent on soil structure,evaporation,and infiltration process.Science of Soil and Water Conservation,2009,7(5):70-75.
[22] He X L,Gao L,Zhao L L.Effects of AM fungi on the growth and drought resistance of Seriphidium minchünense under water stress.Acta Ecologica Sinica,2011,31(4):1029-1037.
[23] Wang R Y,Yu S Q,Zhang JC,Cong R L,Wang Q,Chen L X,Si D Y.Impact of mycorrhizal fungus on the growth and nutrient absorption of Cupressus duclouxiana Hichel seedlings under water stress.Carsologica Sinica,2011,30(3):314-318.
[24] Phillips J M,Hayman D S.Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.Transactions of British Mycological Society,1970,55(1):158-161.
[25] Biermann B J,Linderman R G.Quantifying vesicular-arbuscular mycorrhizae:a proposed method towards standardization.New Phytologist,1981,87(1):63-67.
[26] Jakobsen I,Abbott L K,Robosen A D.External hyphae of vesicular-arbuscular mycorrhizal fungi associated with Trifolium subterraneum L.2.Hyphal transport of P over defined distances.New Phytologist,1992,120(3):514-516.
[27] Tang Z C.Experimental guide of modern plant physiology.Beijing:Science Press.1999.
[28] Bao S D.Agricultural Soil Analysis.Beijing:China Agriculture Press.2000.
[29] Zhen Z,Li Y,Chen H W.Sulphur determination by Vario ELⅢ Elemental Analyzers.Electric Power Science and Engineering,2002,4:43-45.
[30] Kemper W D,Rosenau K.Size distribution of aggregates//Klute A,ed.Methods of Soil Analysis,Part 1.Physical and Mineralogical Methods.2nd ed.Madison,WI:Agron.Monogr.9.ASA and SSSA,1986:425-442.
[31] Verslues P E,Agarwal M,Katiyar-Agarwal S,Zhu J,Zhu J K.Methods and concepts in quantifying resistance to drought,salt and freezing,abiotic stresses that affect plant water status.The Plant Journal,2006,45(4):523-539
[32] Abbaspour H,Saeidi-Sar S,Afshari H.Improving drought tolerance of Pistacia vera L.seedlings by arbuscular mycorrhiza under greenhouse conditions.Journal of Medicinal Plants Research,2011,5(32):7065-7072.
[33] Allen M F.Mycorrhizal fungi:highways for water and nutrients in arid soils.Soil Science Society of America Journal,2007,6(2):291-297.
[34] Miller R M,Jastrow J D.Mycorrhizal fungi influence soil structure//Kapulnik Y,Douds D D,eds.Arbuscular mycorrhizas:molecular biology and physiology.Dordrecht,the Netherlands:Kluwer Academic,2000:3-18.
[35] Rillig M C,Wright S F,Eviner V.The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation:comparing effects of five plant species.Plant and Soil,2002,238(2):325-333.
[36] Bedini S,Pellegrino E,Avio L,Pellegrini S,Bazzoffi P,Argese E,Giovannetti M.Changes in soil aggregation and glomalin-related soil protein content as affected by the arbuscular mycorrhizal fungal species Glomus mosseae and Glomus intraradices.Soil Biology and Biochemistry,2009,41(7):1491-1496.
[37] Márquez C O,Garcia V J,Cambardella C A,Schultz R C,Isenhart T M.Aggregate-size stability distribution and soil stability.Soil Science Society of America Journal,2004,68(3):725-735.
[38] Spohn M,Giani L.Water-stable aggregates,glomalin-related soil protein,and carbohydrates in a chronosequence of sandy hydromorphic soils.Soil Biology and Biochemistry,2010,42(9):1505-1511.
[39] Rillig M C.Arbuscular mycorrhizae,glomalin and soil quality.Canadian Journal of Soil Science,2004,84(4):355-363.
[40] Wu Q S,Xia R X,Zou Y N.Improved soil structure and citrus growth after inoculation with three arbuscular mycorrhizal fungi under drought stress.European journal of soil biology,2007,44(1):122-128.
参考文献:
[1] 杨林章,徐琪.土壤生态系统.北京:科学出版社,2005.
[2] 钟继红,唐淑英,谭军.广东红壤类土壤结构特征及其影响因素.土壤与环境,2002,11(1):61-65.
[4] 冯固,张玉凤,李晓林.丛枝菌根真菌的外生菌丝对土壤水稳性团聚体形成的影响.水土保持学报,2001,15(4):99-102.
[17] 李涛,赵之伟.丛枝菌根真菌产球囊霉素进展.生态学杂志,2005,24(9):1080-1084.
[18] 彭思利,申鸿,张宇亭,郭涛.不同丛枝菌根真菌侵染对土壤结构的影响.生态学报,2012,32(3):863-870.
[19] 尧水红.干湿交替强度对旱地土壤结构形成及水稻秸秆分解过程的相互作用的影响.南京农业大学硕士学位论文,2005.
[20] 杨逵.有机-无机复合保水剂的保水性能和对土壤理化性质的影响.甘肃农业大学硕士学位论文,2008.
[21] 杨永辉,武继承,吴普特,赵世伟,何方,史福刚.秸秆覆盖与保水剂对土壤结构、蒸发及入渗过程的作用机制.中国水土保持科学,2009,7(5):70-75.
[22] 贺学礼,高露,赵丽莉.水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响.生态学报,2011,31(4):1029-1037.
[23] 王如岩,于水强,张金池,丛日亮,王群,陈丽莎,司登宇.水分胁迫下菌根真菌对滇柏(Cupressus duclouxiana Hichel)幼苗生长和养分吸收的影响.中国岩溶,2011,30(3):314-318.
[27] 汤章城.现代植物生理学实验指南.北京:科学出版社,1999:303.
[28] 鲍士旦.土壤农化分析(第三版).北京:中国农业出版社,2000.
[29] 甄志,李宇,陈鸿伟.Vario ELⅢ元素分析仪测硫方法分析.电力科学与工程,2002,4:43-45.

