肺癌组织P-gp、GST-Ⅱ和TOPO-Ⅱ表达及与Ki-67相关性
,,,,,
(青岛大学医学院附属青岛市市立医院病理科,山东 青岛 266071)
肺癌是全球死亡率最高的恶性肿瘤之一,大多数病人确诊时已到中晚期,失去手术机会,化疗是主要的治疗手段[1]。多药耐药(MDR)是导致肺癌治疗失败的主要原因之一,严重影响了病人的化疗效果和生存率。本文采用免疫组织化学方法检测63例肺癌组织中P-糖蛋白(P-gp)、谷胱甘肽-S-转移酶Ⅱ(GST-Ⅱ)及DNA拓扑异构酶(TOPO-Ⅱ)的表达,探讨它们与细胞核增殖抗原(Ki-67)的相关性。
1 材料与方法
1.1 标本
收集我院病理科2011年1月—2012年3月因肺癌行手术切除标本63例,术前均未行放疗及化疗。男41例,女22例;年龄35~83岁,中位年龄58岁;肿瘤直径≤3 cm 者30例,> 3 cm者 33例;组织学类型(WHO分类):鳞癌21例,腺癌24例,小细胞肺癌12例,大细胞癌6例;无淋巴结转移19例,癌转移到附近或远处淋巴结及其他组织器官44例;病理学分级:中、高分化30例,低分化33例;有吸烟史者36例,无吸烟史者27例。所有标本均经40 g/L甲醛固定,石蜡包埋,4 μm厚连续切片,常规苏木精-伊红染色。
1.2 免疫组织化学检测
采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)分别进行检测,P-gp和GST-Ⅱ、TOPO-Ⅱ和Ki-67一抗及SP试剂盒均购自福州迈新生物技术开发公司。严格按照试剂盒说明书步骤进行操作,用已知阳性肝癌切片作阳性对照,以磷酸盐缓冲液(PBS)替代一抗作阴性对照。
1.3 结果判定
光学显微镜下以胞核、胞膜、胞浆中存在棕黄色颗粒为阳性,其中P-gp的阳性颗粒主要分布于胞质和(或)胞膜,GST-Ⅱ的阳性颗粒主要分布于胞核和(或)胞质,TOPO-Ⅱ和Ki-67的阳性颗粒分布于胞核。根据染色程度和染色阳性细胞百分数进行评分[2]。按染色程度:不着色计为0分,淡黄色计为1分,黄色计为2分,棕褐色计为3分。按染色阳性细胞所占百分比: 着色阳性细胞占计数细胞<5%计为0分,5%~25% 计为1分,26%~50%计为2分,>50%计为3分。将二者评分相乘,0~3分者为阴性,≥4分者为阳性。
1.4 统计学处理
采用卡方检验法分析P-gp、GST-Ⅱ、TOPO-Ⅱ、Ki-67表达与其临床病理特征之间的关系,应用Spearman等级相关分析P-gp、GST-Ⅱ、TOPO-Ⅱ与Ki-67的相关性。
2 结 果
2.1 P-gp、GST-Ⅱ、TOPO-Ⅱ和 Ki-67蛋白表达与肺癌临床病理特征的关系
P-gp、GST-Ⅱ、TOPO-Ⅱ和Ki-67在肺癌组织中的阳性表达率分别为61.9%、63.5%、77.8%和39.7%。P-gp、GST-Ⅱ在非小细胞癌组织的阳性表达率明显高于小细胞癌(χ2=8.561、9.475,P<0.01)。中高分化癌组织中GST-Ⅱ的阳性表达率明显高于低分化癌组织(χ2=6.733,P<0.01)。TOPO-Ⅱ在鳞癌和小细胞癌组织中的阳性表达率明显高于腺癌(χ2=8.259、4.189,P<0.01、0.05)。Ki-67在小细胞癌组织中的阳性表达率明显高于非小细胞癌(χ2=22.532,P<0.01),在低分化癌组织的阳性表达率明显高于中高分化组织(χ2=9.270,P<0.01)。P-gp、GST-Ⅱ、TOPO-Ⅱ、Ki-67的阳性表达率与肺癌病人的年龄、性别、是否有吸烟史、肿瘤的大小以及有无淋巴结转移等因素均无相关性(P>0.05)。见表1。
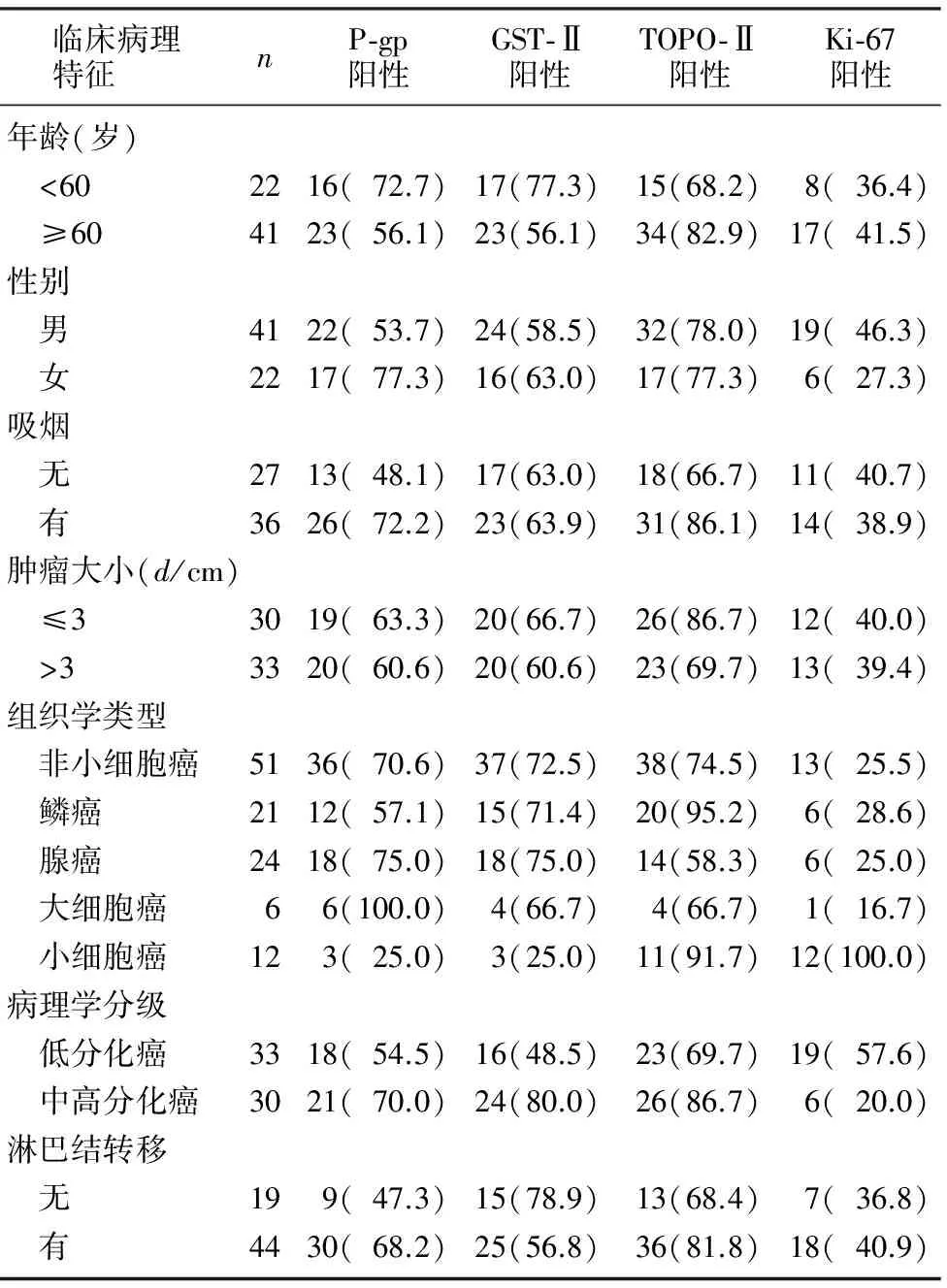
表1 P-gp、GST-Ⅱ、TOPO-Ⅱ、Ki-67蛋白表达与肺癌临床病理特征的关系(例(χ/%))
2.2 肺癌组织中P-gp、GST-Ⅱ和TOPO-Ⅱ的共表达
在63例肺癌组织中,P-gp和TOPO-Ⅱ的单独表达率分别为3.2%(2/63)和19.0%(12/63),没有发现GST-Ⅱ的单独表达。P-gp和GST-Ⅱ的共表达率为49.2%(31/63);GST-Ⅱ和TOPO-Ⅱ的共表达率为9.5%(6/63);P-gp和TOPO-Ⅱ的共表达率为6.3%(4/63);P-gp、GST-Ⅱ及TOPO-Ⅱ的共表达率为25.4%(16/63)。有两个或两个以上MDR基因产物共表达率合计为90.5%,明显高于单独基因产物P-gp和TOPO-Ⅱ的表达率(χ2=59.660,P<0.01)。
2.3 肺癌组织中的P-gp、GST-Ⅱ、TOPO-Ⅱ表达与Ki-67表达的相关性
Ki-67在肺癌组织中的阳性表达与P-gp、GST-Ⅱ的阳性表达之间无显著相关性(P>0.05),而与TOPO-Ⅱ的表达呈明显正相关(r=0.380,P<0.01)。
3 讨 论
MDR是导致肺癌化疗失败最难解决的问题之一[3]。MDR的产生是多基因、多途径共同作用的结果,同时检测多个MDR基因的表达,可为临床提供更多的信息并指导临床化疗药物的选择。Ki-67作为一种核增殖抗原,是目前检测肿瘤细胞增殖活性最可靠的指标之一[4]。
P-gp是相对分子质量为17万的蛋白产物,生理功能相当于一个药物排除泵,将进入癌细胞内的抗癌药物泵出癌细胞,从而使癌细胞内药物浓度降低,也可使药物在细胞内再分布,出现耐药现象[5-6]。因此,P-gp的表达水平与耐药程度呈正相关。本文结果显示,P-gp在非小细胞癌组织中阳性表达率明显高于小细胞癌,腺癌高于磷癌(大细胞癌例数较少,未做统计),此结果与临床上小细胞癌化疗最敏感、鳞癌次之、腺癌最差相符。说明P-gp的高表达是非小细胞肺癌产生耐药性的主要原因。本文结果还显示,P-gp的表达与病人年龄、性别、是否吸烟、肿瘤大小以及有无淋巴结转移无关,与国外相关报道相符[7-8]。
GST-Ⅱ是一种药物代谢酶,一方面可以催化亲电物质与谷胱甘肽结合,另一方面与亲脂性细胞毒药物结合增加药物水溶性,促进其代谢,从而降低抗癌药物的细胞毒作用,GST-Ⅱ的阳性表达与肿瘤耐药相关[9]。本文结果显示,GST-Ⅱ的表达与肺癌病理学分型有关,GST-Ⅱ在非小细胞癌中的阳性表达率明显高于小细胞癌,与临床上小细胞肺癌首次化疗敏感相符。由此可以认为,GST-Ⅱ的高表达是非小细胞癌产生耐药性的原因之一。中高分化癌与低分化癌相比,前者GST-Ⅱ的阳性表达率明显高于后者,说明分化较高的肺癌耐药性较强[10]。本文结果还显示,GST-Ⅱ的表达与病人年龄、性别、是否吸烟、肿瘤大小以及有无淋巴结转移无关。
TOPO-Ⅱ是DNA复制和转录所需要的基本核酶,一方面作为细胞的增殖指数,另一方面作为抗癌药物的靶点指数。化疗药物如VP16、替尼泊苷和阿霉素等通过与TOPO-Ⅱ结合造成DNA复制和转录异常,因此TOPO-Ⅱ是肿瘤治疗的主要靶酶。本文的研究结果显示,TOPO-Ⅱ在鳞癌和小细胞癌中的阳性表达率明显高于腺癌,提示TOPO-Ⅱ的低水平表达使VP16等抑制剂丧失作用靶点,无法抑制TOPO-Ⅱ发挥作用,所以TOPO-Ⅱ可作为一种潜在的预示化疗敏感性的标记物[11]。本文结果还显示,TOPO-Ⅱ的表达与病人年龄、性别、是否吸烟、肿瘤大小以及有无淋巴结转移无关。
有文献报道,Ki-67阳性表达率与肺癌的侵袭力、恶性程度呈正相关[12]。本文结果显示,Ki-67的表达与肺癌组织类型及分化程度有关,在小细胞癌组织表达明显高于非小细胞癌,在低分化癌组织表达明显高于中高分化癌,说明癌组织分化程度越低,Ki-67表达越高,Ki-67表达与肺癌的恶性程度呈正相关。本文结果还显示,Ki-67的表达与P-gp、GST-Ⅱ的表达之间无显著相关性,与TOPO-Ⅱ的表达呈明显正相关。说明TOPO-Ⅱ可作为一种研究肿瘤细胞增殖活性的特异性指标[13],同时检测Ki-67和TOPO-Ⅱ可以更好地判断瘤细胞的增殖状态。
有研究表明,非小细胞肺癌存在多种耐药基因共同表达的现象[14]。本文结果显示,有两个或两个以上MDR基因产物的共表达率明显高于单独基因产物P-gp、GST-Ⅱ的表达率,提示肺癌耐药的单基因作用较弱,其耐药机制是多种基因共同作用的结果。P-gp、GST-Ⅱ、TOPO-Ⅱ三者可能相互依赖,共同作用,具体机制有待于进一步研究。因此,同时检测P-gp、GST-Ⅱ、TOPO-Ⅱ可为临床化疗提供更多的耐药信息,进而指导临床对化疗药物的选择。
综上所述,P-gp、GST-Ⅱ、TOPO-Ⅱ共同参与了肺癌的耐药机制,三者相互依赖,共同作用;Ki-67与肺癌的恶性程度呈正相关。临床上同时检测上述4种基因,对于揭示肺癌耐药的原因,估计化疗效果,判断预后,以及指导合理选择化疗药物,制定有效的化疗方案,延长肺癌病人的生存期意义很大。
[1] 王文苹,季旭明,欧阳兵,等. 逆转肺癌多药耐药的研究进展[J]. 世界中西医结合杂志, 2011,6(9):820-822.
[2] OLAUSSEN K A, DUNANT A, FOURET P, et al. DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J]. N Engl J Med, 2006,355(10):983-991.
[3] 李国仁,戴建华,王燕青,等. 肺癌组织中耐药相关基因的表达水平及其临床意义[J]. 中国肺癌杂志, 2002,5(1):35-37.
[4] ZHENG J N, MAT X, CAOJ Y, et al. Knockdown of Ki-67 by small interfering RNA leads to inhibition of proliferation and induction of apoptosis in human renal carcinoma cells[J]. Life Science, 2006,78(7):724-729.
[5] ENDICOTT J A, LING V. The
biochemistry of P-glycoprotein-mediated multidrug resistance[J]. Ann Rev Biochem, 1989,58:137-171.
[6] ARANCIA G, MOLINARI A, CALCABRINI A, et al. Intracellular P-glycoprotein in multidrug resistant tumor cells[J]. Ital J Anat Embryol, 2001,106:59-68.
[7] GALIMBERTI S, MARCHETTI A, BUTTITTA F, et al. Multidrug resistance related genes and p53 expression in human non small cell lung cancer[J]. Anticancer Research, 1998,18(40):2973-2977.
[8] BEER T W, ROWLANDS D C, CROCKER J, et al. Detection of the multidrug resistance marker P-glycoprotein by immunohistochemistry in malignant lung tumours[J]. Thorax, 1996,15:526-529.
[9] 曲延刚,纪祥瑞,唐爱萍. 多药耐药相关蛋白在乳腺浸润性导管癌中的表达[J]. 青岛大学医学院学报, 2007,43(1):70-71.
[10] 聂坤荣,李春海,诸亚君,等. 肺癌谷胱甘肽转移酶表达的免疫组化研究[J]. 中华结核和呼吸杂志, 1993,16(3):141-143.
[11] 李凡彩,周英琼,侯巧燕,等. P-gp、GST-Ⅱ、TOPO-Ⅱ在肺癌中的表达及意义[J]. 华夏医学, 2005,18(1):1-5.
[12] 杨景伟,魏煜程,沈毅,等. Fas和Ki-67在非小细胞肺癌组织中的表达[J]. 齐鲁医学杂志, 2007,22(3):212-214.
[13] 孙冰生,吴焕明. 非小细胞肺癌拓扑异构酶Ⅱ的表达及其与Ki67、p53的关系[J]. 华中科技大学学报:医学版, 2004,33(2):118-121.
[14] 刘欣燕,张书敏,邢秋月,等. 非小细胞肺癌P-gp、LRP、MRP和GST-Ⅱ表达及其临床意义[J]. 现代肿瘤医学, 2009,17(8):1444-1447.

