香蕉泛素结合酶基因MaUCE2在非生物胁迫下的表达分析
王安邦 金志强 刘菊华 贾彩红 张建斌 苗红霞 徐碧玉,
(1. 海南大学农学院,海口 571101;2. 中国热带农业科学院海口实验站 香蕉研究所,海口 571101;3. 中国热带农业科学院热带生物技术研究所,海口 571101)
植物固着生长的特性使其在生长发育过程中不可避免地与外界环境有着密切的关联[1]。当面临逆境胁迫时,植物必须能够应对这些逆境才能存活[2-4]。逆境胁迫下,细胞产生各种异常的或受损的蛋白质,这些异常蛋白如果在细胞内积累过多,会影响细胞的各种代谢,从而破坏细胞结构和功能的完整性[5]。泛素-蛋白酶体途径(ubiquitin-proteasome pathway,UPP)是目前已知的最重要、有高度选择性的蛋白质降解途径[6],它通过调节功能蛋白质的周转(turnover)或降解不正常蛋白,实现对多种代谢过程的调节[7]。该途径的关键酶主要包括泛素活化酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)和泛素-蛋白连接 酶(ubiquitin-protein ligating enzyme,E3)[8]。其中E2是种类丰富的酶系,更是连接E1和E3的桥梁[9],对泛素化修饰的特异性和精确时空性起关键作用[10]。
植物E2蛋白基因(LeUBC1)首次从番茄cDNA文库中分离,并且受热激和重金属诱导表达增强[11],说明E2蛋白基因在发生胁迫时可能参与细胞异常蛋白的降解过程。徐晨曦等[12]从柽柳中获得E2基因,转入烟草中异源表达发现该基因能明显提高烟草的耐旱性。Cui等[13]发现拟南芥泛素结合酶UBC32定位在内质网上,参与异常蛋白质降解过程,可以提高拟南芥的耐盐性。从马铃薯[14]和大豆中[15]也克隆到E2基因,转入拟南芥后可提高拟南芥的抗盐性和耐旱性。近年来,对E2基因功能研究尽管也取得了一定进展,但相对缓慢[16],而且关于香蕉泛素结合酶基因与植物的抗逆性关系的研究尚未见报道。
香蕉喜高温,怕低温,生长期对水分需求量大,因而温度和水分是香蕉分布的主要限制因子。然而,由于全球异常气候的增多,香蕉处于高温、低温、干旱、盐碱、风害等逆境的时间也增多,这严重影响了香蕉产量并制约着香蕉产业的发展[17],因此香蕉抗逆性研究显得尤为重要。
李羽佳等[18]从香蕉根系均一化全长cDNA 文库中克隆了一个香蕉泛素结合酶基因,命名为MaUCE2,经生物信息学分析发现该基因有典型的保守催化结构域,内含有一个高度保守的半胱氨酸(cysteine)酶活性位点[7,16]。为了进一步研究该基因与非生物胁迫的关系,本研究利用实时定量PCR(qPCR)技术探究MaUCE2基因在干旱、盐、低温等非生物胁迫下的表达特性,旨在为研究E2基因生物学功能及其应用奠定基础。
1 材料与方法
1.1 材料
供试材料为巴西蕉(Musa acuminata L. AAA group,‘Brazilian’),采自中国热带农业科学热带生物技术研究所香蕉种植园。
1.2 方法
1.2.1 香蕉MaUCE2荧光定量表达分析 采用李燕强等[19]改良的CTAB法提取香蕉总RNA。每个样品取1 μL检测RNA质量和浓度后,利用M-MLV逆转录酶(TaKaRa公司)合成cDNA链。
选用NCBI上已登录的香蕉MaActin 片段为内参,引物序列根据已登录序列进行设计,MaActin 1(5'-CGAGGCTCAATCAAAGA-3')和MaActin 2(5'-ACCAGCAAGGTCCAAAC-3')。MaUCE2 引物序列为MaUCE2-1(5'-CAAGACCGACAGAGCCAAGT-3')和MaUCE2-2 (5'-CCTTAGGTGGTTTGAATGG-3')。使用仪器为Mx3000P(Stratagene,USA),PCR反应体系为25 μL,PCR 产物的长度为232 bp。荧光定量PCR 的反应程序如下:95℃预变性30 s;95℃变性7 s,55℃退火15 s,72℃延伸20 s,循环40次。每个反应重复3 次。
1.2.2 MaUCE2在不同外源胁迫下的表达特性分析
1.2.2.1 香蕉植株的干旱胁迫处理 参照张丽丽等[20]香蕉干旱处理的方法,选取长势一致、生长健壮的香蕉组培苗,分为4组,每组3株,测定每组各盆中土壤水分含量并保持一致。第1组不做任何处理,作为对照,使土壤相对含水量保持在75%-80%;第2组低度失水干旱胁迫,使土壤相对含水量保持在55%-60%;第3组中度失水干旱胁迫,使土壤相对含水量保持在45%-50%;第4组高度失水干旱胁迫,使土壤相对含水量保持在30%-35%。每组香蕉组培苗置于人工恒温气候箱中培养,测定各盆中土壤水分含量,当达到胁迫程度后,立即取每株组培苗根部液氮速冻,提取RNA。
1.2.2.2 香蕉植株的盐胁迫处理 选取长势一致、生长健壮的香蕉组培苗进行水培养,在培养液(1/2Hoagland培养液)中加入200 mmol/L NaCl进行盐胁迫处理。分别于0、2、4、6和8 h分别观察和取样,将株苗根部立即用液氮速冻,提取RNA。
1.2.2.3 香蕉植株的低温胁迫处理 选取长势一致、生长健壮的香蕉组培苗,分为5组,每组3株,置于人工恒温气候箱中培养。第1组温度设为28℃,作为对照,第2组到第5组分别置于15℃、10℃、7℃、5℃温度下2 h进行低温胁迫,当达到胁迫时间后,液氮速冻,提取RNA。
2 结果
如图1所示,通过实时定量PCR分析发现,干旱处理可以诱导MaUCE2的表达,其表达量随着干旱程度的加重而逐步上升。在高度干旱胁迫下处理下MaUCE2的表达量最高,为2.32,分别为低度干旱胁迫和中度干旱胁迫时期诱导的表达量的2.11倍和1.25倍。

图1 不同程度水分胁迫下MaUCE2的表达
如图2所示,高盐胁迫处理下的MaUCE2的表达量随NaCl处理时间的增加而略有升高,在胁迫6 h时最高,为1.26。处理2 h、4 h和8 h诱导MaUCE2的表达量分别为1.11、1.13和0.98,与对照差异不大。

图2 NaCl胁迫不同时间下MaUCE2的表达
如图3所示,低温胁迫可以诱导MaUCE2的表达,其表达量随着温度的降低而逐步升高,当温度降低到5℃时,MaUCE2的表达量最高,为4.08。温度为15℃和10℃时诱导MaUCE2的表达量为1.26和1.18,与对照差异不大。
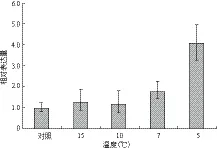
图3 不同程度低温胁迫下MaUCE2的表达
3 讨论
逆境胁迫下,细胞产生各种异常的或受损的蛋白质,这些异常蛋白如果在细胞内积累过多,会影响细胞的各种代谢,从而破坏细胞结构和功能的完整性,而这些异常蛋白绝大部分是通过泛素-蛋白酶体途径被降解,因此,泛素-蛋白酶体途径中关键酶的大量表达与植物抗逆性的获得有着密切的关系,而泛素结合酶E2在E1和E3之间穿梭往返运行,具有结合并转移泛素到靶蛋白的作用,对泛素化修饰的特异性和精确时空性起关键作用。
干旱胁迫是导致导致作物减产的最主要原因[1,21],因此,有关植物应对干旱胁迫反应的研究显得极为迫切和重要。本研究结果显示干旱胁迫后MaUCE2表达量显著提高,说明干旱处理可以诱导MaUCE2的表达。该结果与前人[12,14,15]研究结果相一致,而且本研究发现MaUCE2的表达量在高度干旱胁迫下表达量最高,这可能与高度干旱胁迫下细胞异常蛋白迅速增加有关。
Zhou等[15]克隆了马铃薯泛素结合酶基因GmUBC2,异源表达发现该基因能明显提高拟南芥的耐盐性。在盐胁迫下该基因在拟南芥根中表达与对照差异不明显。本研究结果显示盐胁迫后MaUCE2表达量略有上升,最高时是对照的1.26倍,然后基本恢复到正常水平,与对照差异也不明显。
低温胁迫下,MaUCE2表达量在温度为15℃、10℃时上升不明显,而温度低到7℃和5℃时该基因表达量迅速上升,在5℃时表达量最大,是对照的4.08倍。这可以与植物适宜生长温度的范围有关,有研究表明当温度小于8℃时香蕉苗开始受到寒害[22],因此当温度低于8℃后细胞产生各种异常的或受损的蛋白质增多,导致MaUCE2表达量迅速增高。
目前大多数植物的泛素结合酶蛋白功能的研究还处于起步阶段,因此从不同植物中克隆及研究泛素结合酶功能显得尤为重要。本研究初步验证了香蕉泛素结合酶基因MaUCE2在植物抗逆过程中可能起着重要作用,但MaUCE2在植物抗逆过程中具体的功能和机制尚需深入研究。
4 结论
在盐、低温和干旱胁迫下,香蕉泛素结合酶基因MaUCE2表达量发生明显变化,表明香蕉中的泛素结合酶基因具有响应非生物胁迫能力,可能在香蕉适应逆境中发挥重要作用。
[1] 宁约瑟, 王国梁, 谢旗.泛素连接酶E3介导的植物干旱胁迫反应[J]. 植物学报, 2011, 46 (6):606-616.
[2] Peleg Z, Blumwald E. Hormone balance and abiotic stress tolerance in crop plants[J]. Curr Opin Plant Biol, 2011, 14:290-295.
[3] Ahuja I, de Vos RCH, Bones AM, Hall RD. Plant molecular stress responses face climate change[J]. Trends Plant Sci, 2010, 15:664-674.
[4] Hirayama T, Shinozaki K. Research on plant abiotic stress responses in the post-genome era:past, present and future[J]. Plant J, 2010, 61:1041-1052.
[5] Smalle J, Kurepa J, Yang P et al. The pleiotropic role of the 26S proteasome subunit RPN10 in Arabidopsis growth and development supports a substrate-specific function in abscisic acid signaling[J]. Plant Cell, 2003, 15:965-980.
[6] 郭启芳, 邹琦, 王玮. 植物泛素/26S蛋白酶体通路的生理功能和分子生物学[J]. 植物生理学通讯, 2004, 40(5):533-539.
[7] 黄海杰, 陈雄庭.植物泛素/26S蛋白酶体途径研究进展[J].中国生物工程杂志, 2008, 28(7):127-132.
[8] Mukhopadhyay D, Riezman H. Proteasome-independent functions of ubiquitin in endocytosis and signaling[J]. Science, 2007, 315:201-205.
[9] Pickart CM. Mechanisms underlying ubiquitination[J]. Annu Rev Biochem, 2001, 70:503-533.
[10] 倪晓光, 赵平.泛素-蛋白媒体途径的组成和功能[J]. 生理科学进展, 2006, 37(3):255-258.
[11] Feussner K, Feussner I, Leopold I, et al. Isolation of a cDNA coding for an ubiquitin-conjugating enzyme UBC1 of tomato-the first stressinduced UBC of higher plants[J]. FEBS Lett, 1997, 409(2):211-215.
[12] 徐晨曦, 姜静, 刘甜甜, 等.柽柳泛素结合酶基因(E2s)的序列分析及功能验证[J]. 东北林业大学学报, 2007, 35(11):1-4.
[13] Cui F, Liu LJ, Zhao QZ, et al. Arabidopsis ubiquitin conjugase UBC-32 is an ERAD component that functions in brassinosteroid-mediated salt stress tolerance[J]. Plant Cell, 2012, 24(1):233-244.
[14] Wan X, Mo A, Liu S, et al. Constitutive expression of a peanut ubiquitin-conjugating enzyme gene in Arabidopsis confers improved water-stress tolerance through regulation of stress-responsive gene expression[J]. J Biosci Bioeng, 2011,111(4):478-484.
[15] Zhou GA, Chang RZ, Qiu LJ. Overexpression of soybean ubiquitinconjugating enzyme gene GmUBC2 confers enhanced drought and salt tolerance through modulating abiotic stress-responsive gene expression in Arabidopsis[J]. Plant Mol Biol, 2010, 72(4-5):357-367.
[16] 王金利, 史胜青, 贾利强.植物泛素结合酶E 2功能研究进展[J]. 生物技术通报, 2010(4):7-8.
[17] 刘菊华, 邓成菊, 金志强, 等.香蕉乙二醛酶基因MaGLO14的克隆及在非生物胁迫下的功能鉴定[J]. 中山大学学报:自然科学版, 2011, 50(5):87-92.
[18] 李羽佳, 金志强, 刘菊华, 等. 香蕉泛素结合酶基因的克隆及功能初步分析[J]. 热带作物学报, 2013.
[19] 李燕强, 金志强, 徐碧玉.香蕉果实RNA提取方法的改进和比较[J]. 福建热作科技, 2005, 30(2):37-39.
[20] 张丽丽, 徐碧玉, 金志强, 等.香蕉谷胱甘肽过氧化物酶基因MaCPX的克隆和表达分析[J]. 园艺学报, 2012, 39(8):1471-1481.
[21] Luo LJ. Breeding for water-saving and drought-resistance rice (WDR) in China[J]. J Exp Bot, 2010, 61:3509-3517.
[22] 黄朝荣.南宁市香蕉冷害指标及防御措施探讨[J]. 广西农业科学, 1991(3):106-109.

