Gas2Δ171-313抑制K562细胞生长并增强其对伊马替尼的反应
葛跃,吴洁,赵昀
(苏州大学唐仲英血液学研究中心,江苏苏州 215123)
人类慢性髓细胞白血病(chronic myeloid leukemia,CML)是源自造血干细胞的恶性血液肿瘤。依据疾病的进程可分为慢性期、加速期和急变期3个阶段。伊马替尼(imatinib methylate,IM)可抑制酪氨酸激酶(BCR-ABL)活性,在慢性期慢性粒细胞白血病治疗中有效,但很难达分子学缓解(MR)[1],无法治愈该疾病。因而,寻找新靶点、设计新药物成为CML研究领域的热点[2]。
1988年Schneider等[3]鉴定到一组在 NIH 3T3细胞处于血清饥饿或细胞接触性抑制状态而表达上调的基因,称之为生长抑制特异性基因(growth arrestspecific genes,GAS)。它们编码的蛋白产物包括Gas1、Gas2……Gas8等,但它们不存在序列同源性或共同结构特征,细胞定位和功能也各异[4]。Gas2蛋白产物包含N-端的CH(calponin homology)结构域和C-端的GAR结构域。Gas2是微丝、微管相关蛋白,参与细胞分裂的调控[5],比如,Gas2和N-端缺失的Gas2变体能抑制爪蟾胚胎细胞的生长[6]。Gas2也是Caspase的底物参与细胞凋亡[7]。另外,Gas2还是钙蛋白酶Calpain的内源性抑制剂,可通过抑制Calpain的活性、稳定p53而调控凋亡反应[8]。
Gas2在人类骨髓增生性疾病中异常表达,这类疾病包括 IM(idiopathic myelofibrosis,骨髓纤维化)、PV(polycythemia vera,真性红细胞增多症)、ET(essential thrombocythemia,原发性血小板增多症)和 CML等。Kronenwett等[9]使用 CML患者与正常骨髓及 G-CSF动员的外周血CD34+细胞进行基因表达谱研究,结果提示Gas2在CML患者中较正常细胞表达增高。此外,两项独立研究显示在CML从慢性期到急变期的转化过程中,Gas2的表达随疾病的进程升高[10-11]。Vannucchi等[12]比较IM患者与正常供体CD34+细胞的基因表达谱,发现Gas2高表达;而后使用IM、PV及ET患者与正常供体骨髓的CD34+细胞进行Q-RTPCR验证,证实Gas2在这3种疾病中都显著较正常细胞表达增高。
Gas2Δ171-314和Calpain结合但不抑制其活性,却解除Gas2和内源性抑制剂Calpastatin对Calpain的抑制作用[8],因而被称为 Gas2的显性负性突变体(Gas2DN)。在多种肿瘤细胞中Calpain能独立于GSK3β/蛋白酶体途径调控 β-catenin 的降解[13];Huang等[14]发现 Gas2Δ171-314 能激活细胞内被 Gas2 或Calpastatin抑制的 Calpain活性,促进 β-catenin的降解,从而抑制BCR-ABL+的U937细胞或小鼠骨髓祖细胞响应GM-CSF刺激的细胞增殖,这与Calpain活化、β-catenin降解及其转录活性的降低相关。
本研究使用慢病毒在人慢性髓细胞白血病K562细胞株中过表达 Gas2、Gas2Δ171-313和 Gas2Δ1-170,研究它们能否对K562细胞增殖有抑制作用,这种抑制作用对细胞周期、凋亡和衰老的影响,这种抑制作用能否与IM具有协同性。
1 材料和方法
1.1 材料
1.1.1 细胞 人慢性髓细胞白血病细胞株K562和人胚肾293T细胞购于中国科学院上海细胞生物研究所细胞库。
1.1.2 主要试剂 Ex Taq DNA聚合酶、pMD19-T载体、T4DNA 连接酶、XhoI、EcoRI、BamHI、XbaI、PstI、HindⅢ、BglⅡ限制性内切酶均购于 TaKaRa公司。PCR引物合成及基因序列检测均由上海生工生物工程公司完成。鼠抗人单克隆 α-Tubulin抗体购于Sigma公司,鼠抗人单克隆Gas2抗体(识别N端)和兔抗人单克隆Gas2抗体(识别C端)均购于Abcam公司。甲基纤维素购于 StemCell Technologies公司。Calpain活性检测试剂盒购于Biovision公司。β-半乳糖苷酶染色法检测试剂盒购于碧云天公司。
1.1.3 主要仪器 流式细胞分析及分选仪(Becton Dickinson,美国),高速离心机(Beckman Coulter,美国),紫外凝胶成像仪(Bio-Rad,美国),自动冲片机(Kodak,德国),垂直电泳仪和转印电泳仪(天能,中国),PCR 仪(Biometra,德国),多功能读板机(Molecular Devices,中国),智能图像导航仪(Olympus,日本),倒置显微镜(Olympus,日本)。
1.2 实验方法
1.2.1 Gas2基因及其变体的克隆 利用PCR的方法分别扩增Gas2的编码区及两种Gas2变体(Gas2Δ171-313和Gas2Δ1-170);上下游引物中引入BamHⅠ识别序列,便于克隆入慢病毒表达载体。
1.2.2 慢病毒的制备 将慢病毒表达载体与ΔR、VSV-G、Rev 3种包装质粒通过磷酸钙沉淀方式共转染293T细胞,收集转染后48和72 h的培养上清,过滤分装,-80 ℃保存备用[16]。
1.2.3 蛋白质印迹法检测过表达的蛋白 收集4×106YFP+细胞,PBS清洗2次,加入蛋白裂解液,冰上裂解15 min,4℃14 000×g离心20 min,收集上清并蛋白定量。蛋白样本加入5×SDS加样缓冲液,100℃煮沸5 min,进行SDS-PAGE电泳,转移至PVDF膜上,5%脱脂牛奶室温封闭2 h,2%脱脂牛奶稀释一抗4℃孵育过夜,1×TBST洗膜5次,5 min·次-1,加入辣根过氧化物标记的二抗,室温孵育1 h,最后用ECL显影[17]。
1.2.4 细胞增殖和集落生成实验 细胞增殖实验:24孔板中每孔种植2×104YFP+细胞,培养的第3天和第6天分别进行细胞计数。集落生成(colony-forming cell,CFC)实验:在有双抗和IMDM培养基的甲基纤维素中加入300个YFP+细胞,混匀后接种到直径为3.5 cm小皿中,37 ℃培养,2 周后计数[16]。
1.2.5 检测Calpain活性 收集2×106YFP+细胞,PBS清洗2次,加入100 μl裂解液,冰上裂解20 min,10 000×g离心1 min,收集上清并进行蛋白定量。取50 μg 蛋白,加入 10 μl反应缓冲液,5 μl Calpain 底物,并加入一定量缓冲液至总体积100 μl。37℃避光反应1 h。多功能读板机上检测400 nm和505 nm波长处吸光度值。
其工作原理是:通过旋转盘根压盖来挤压铜压套,铜压套压紧盘根,盘根在密封函内弹簧的作用下被纵向挤压发生横向膨胀,从而密封柱塞与密封函的环形空间,防止高压水刺漏及空气进入工作腔。
1.2.6 细胞周期分析 取1×106YFP+细胞,70%乙醇固定过夜,加入 RNase A(100 μg·ml-1),37 ℃避光孵育30 min,再加入碘化丙啶(40 μg·ml-1),4℃ 避光孵育30 min后流式细胞仪检测[18]。数据使用Flow Jo软件进行分析。
1.2.7 β-半乳糖苷酶染色法检测细胞衰老 离心并收集细胞沉淀至1.5 ml离心管内,1×PBS洗1次,加1 ml β-半乳糖苷酶染色固定液,室温固定15 min。离心,吸取固定液,1×PBS洗3次。离心,弃PBS,加1 ml染色工作液,37℃孵育过夜。取染色后的细胞,观察并计数。
1.3 统计学处理
所有实验均重复3次以上,数据采用Graph Pad Prism 5.0处理。结果以±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 载体构建
我们构建了分别表达 Venus、Gas2、Gas2Δ171-313、Gas2Δ1-170的各类慢病毒载体,目的基因由SFFV(spleen focus forming virus)启动子驱动(图1A)。基因序列由DNA测序验证,Gas2及其变体均能在K562细胞中成功表达(图1B)。
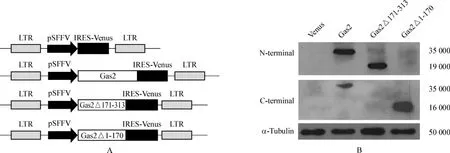
图1 载体构建A.schematic structure of lentiviral vector;B.Western blotting to detect the protein expressionFig 1 Vector construction
2.2 Gas2Δ171-313抑制K562细胞的增殖
为了测定Gas2及其变体对K562细胞生长的影响,对照表达Gas2及其变体的细胞在体外培养6 d,并在第3天和第6天分别进行细胞计数。如图2所示:表达 Gas2和 Gas2Δ1-170的 K562细胞与对照Venus组相比,生长无显著差异;而表达 Gas2Δ171-313的K562细胞与对照组相比,细胞生长受到显著抑制。

图2 Gas2不同变体对K562细胞增殖能力的影响Fig 2 The effect of different Gas2 mutants on K562 cell proliferation
2.3 Gas2Δ171-313抑制K562细胞的集落生成
为了测定Gas2及其变体对K562体外集落形成能力的影响。我们观察培养14 d后的集落,Gas2和Gas2Δ1-170形成的集落数目与对照Venus组无显著差异,而Gas2Δ171-313组形成的集落数目较对照组显著减少(图3)。
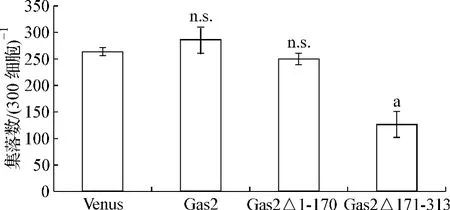
图3 Gas2不同变体对K562细胞集落生成能力的影响Fig 3 The effect of different Gas2 mutants on colony-forming assay on K562
2.4 Gas2Δ171-313增加Calpain活性
已有研究表明,Gas2Δ171-314通过与 Gas2和Calpastatin竞争性抑制Calpain,从而解除Gas2和内源性抑制剂 calpastatin对 Calpain的抑制作用,提高Calpain活性,从而抑制细胞的增殖[14]。我们分别提取对照组和全长及变体Gas2表达细胞的蛋白样本,并进行Calpain活性的检测。结果显示,全长Gas2、Gas2Δ1-170与对照Venus组中Calpain活性无显著差异;而Gas2Δ171-313与对照组相比,其Calpain活性显著提高(图4)。

图4 Gas2及不同变体对Calpain活性影响Fig 4 The impact of different Gas2 mutants on the calpain activity
2.5 Gas2Δ171-313不影响K562细胞周期和凋亡
为研究Gas2Δ171-313通过何种机制抑制K562细胞的生长,我们首先进行了细胞周期和凋亡的检测,结果如图5所示。Gas2、Gas2Δ1-170组与对照Venus组相比,细胞周期的分布没有发生显著变化;Gas2Δ171-313有阻滞细胞在S和G2/M期的趋势,但其作用并不显著(P>0.05)。Gas2及其变体作用后也没有显著增多的亚G0/G1期细胞,表明Gas2Δ171-313抑制细胞生长也不是通过诱发细胞凋亡产生的。
2.6 Gas2Δ171-313诱导K562细胞衰老
为了进一步探索Gas2Δ171-313抑制K562细胞生长的机制,我们进行了β-半乳糖苷酶染色。结果显示,与对照Venus组相比,Gas2Δ171-313组阳性细胞比例明显增多,达到(75.27±0.03)%;而 Gas2和Gas2Δ1-170组与对照组相比差异无统计学意义,分别为(17.41±0.02)%、(14.01±0.02)%和(9.95±0.03)%。见图6。结果提示,Gas2Δ171-313可能通过促进K562细胞衰老而抑制增殖。
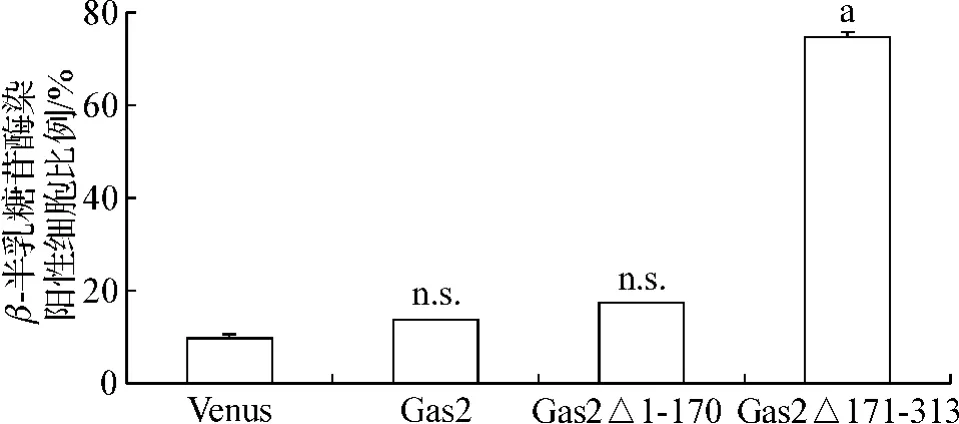
图6 Gas2及不同变体对K562细胞衰老影响Fig 6 The impact of different Gas2 mutants on the senescence on K562
2.7 Gas2Δ171-313与Imatinib协同抑制K562细胞集落生成
为研究Gas2Δ171-313能否与IM协同性地抑制K562生长。我们在IM存在或不存在的条件下进行了集落生成实验。如图7所示,当加入IM(1 μmol·L-1和5 μmol·L-1)后,Gas2Δ171-313 组相对于未加入IM细胞的集落存活能力[分别为(4.65±2.41)%和未检出]较对照Venus组[分别为(40.16±3.73)%和(0.49±0.29)%]有显著下降,表明Gas2Δ171-313可以与IM协同性地抑制K562细胞的生长。
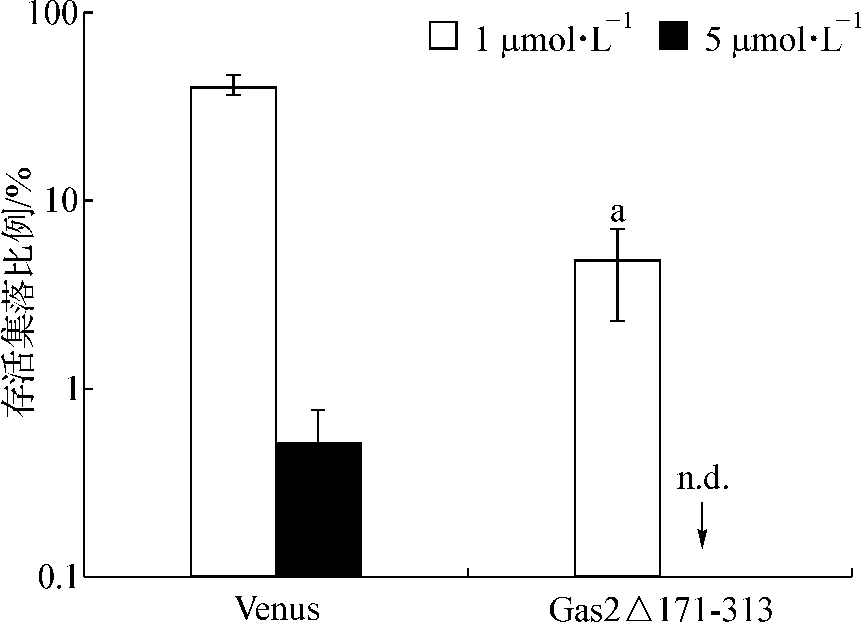
图7 IM与Gas2Δ171-313对K562细胞集落存活的影响Fig 7 Effect of IM and Gas2Δ171-313 on the survival of K562 colonies
3 讨 论
Gas2在CML患者中较正常供体高表达[9-12],然而其生物学意义却并不清楚。我们的研究发现,仅Gas2Δ171-313对K562细胞生长产生明显的抑制作用,而全长Gas2和Gas2Δ1-170相比对照组对K562细胞生长影响没有明显差异。Gas2Δ171-313对细胞生长的抑制与其增强Calpain的活性相关;Gas2Δ1-170并不能抑制K562细胞的生长,表明在K562中Gas2并不与微管系统结合而阻滞细胞周期进程;全长Gas2既不影响细胞的增殖也不抑制Calpain,我们推测细胞内的内源性抑制剂已经饱和地结合了Calpain并有效地抑制了Calpain的活性,因而过表达Gas2不再显现出抑制作用。因此,我们认为,Gas2在CML细胞中主要通过结合并抑制Calpain发挥其生物学功能,而并不通过结合微管阻滞细胞周期进程,这为理解Gas2在CML中异常表达的生物学意义提供了有益的实验证据。
通过细胞周期分析,我们发现,与对照Venus组细胞相比过表达Gas2和它的两个变体并不能显著地影响细胞周期的分布;而Gas2Δ171-313也没有显著地诱发细胞凋亡,说明Gas2Δ171-313也不通过诱导凋亡而抑制细胞增殖。
β-半乳糖苷酶活性增强是细胞衰老的典型分子标志。我们发现,Gas2Δ171-313明显增强K562细胞的β-半乳糖苷酶活性,而全长Gas2和Gas2Δ1-170并不能显著改变其活性,提示Gas2Δ171-313可能通过诱发K562细胞衰老而抑制其增殖。在未来的研究中Gas2Δ171-313如何促进K562细胞衰老值得关注。
在发现Gas2Δ171-313能抑制K562细胞的生长后,我们也研究Gas2Δ171-313能否与酪氨酸激酶抑制剂IM协同性地抑制K562。结果显示,Gas2Δ171-313能够与IM协同抑制K562的集落生成能力,提高K562细胞对IM的反应敏感性。这有望为更有效地治疗CML提供新思路。
[1]史玉叶,李玉峰.慢性粒细胞白血病耐伊马替尼机制及治疗进展[J].现代医学,2011,39(6):751-753.
[2]SHERBENOU D W,DRUKER B J.Applying the discovery of the Philadelphia chromosome[J].J Clin Invest,2007,117:2067-2074.
[3]SCHNEIDER C,KING R M,PHILIPSON L.Genes specifically expressed at growth arrest of mammalian cells[J].Cell,1988,54:787-793.
[4]赵莉霞,周晓巍,黄培堂.生长抑制特异性基因研究进展[J].军事医学科学院院刊,2009,33(1):66-70.
[5] BRANCOLINI C,BOTTEGA S,SCHNEIDER C.Gas2,a growth arrest-specific protein,is a component of the microfilament network system[J].J Cell Biol,1992,117:1251-1261.
[6]ZHANG T,DAYANANDAN B,ROUILLER I,et al.Growth-arrest-specific protein 2 inhibits cell division in Xenopus embryos[J].PLoS One,2011,6(9):e24698.
[7]SGORBISSA A,BENETTI R,MARZINOTTO S,et al.Caspase-3 and caspase-7 but not caspase-6 cleave Gas2 in vitro:implications for microfilament reorganization during apoptosis[J].J Cell Sci,1999,112(Pt 23):4475-4482.
[8]BENETTI R,del SAL G,MONTE M,et al.The death substrate Gas2 binds m-calpain and increases susceptibility to p53-dependent apoptosis[J].EMBO J,2001,20(11):2702-2714.
[9]NEUMANN F,TEUTSCH N,KLISZEWSKI S,et al.Gene expression profiling of Philadelphia chromosome Ph-negative CD34+hematopoietic stem and progenitor cells of patients with Ph-positive CML in major molecular remission during therapy with imatinib[J].Leukemia,2005,19(3):458-460.
[10]JANSSEN J J,KLAVER S M,WAISFISZ Q,et al.Identification of genes potentially involved in disease transformation of CML[J].Leukemia,2005,19(6):998-1004.
[11]RADICH J P,DAI H,MAO M,et al.Gene expression changes associated with progression and response in chronic myeloid leukemia[J].Proc Natl Acad Sci,2006,103(8):2794-2799.
[12]GUGLIELMELLI P,ZINI R,BOGANI C,et al.Molecular profiling of CD34+cells in idiopathic myelofibrosis identifies a set of disease-associated genes and reveals the clinical significance of Wilms'tumor gene 1(WT1)[J].Stem Cells,2007,25(1):165-173.
[13]BENETTI R,COPETTI T,DELL'ORSO S,et al.The calpain system is involved in the constitutive regulation of beta-catenin signaling functions[J].J Biol Chem,2005,280(23):22070-22080.
[14]HUANG W,ZHOU W,SABERWAL G,et al.Interferon consensus sequence binding protein(ICSBP)decreases betacatenin activity in myeloid cells by repressing Gas2 transcription[J].Mol Cell Biol,2010,30(19):4575-4594.
[15]PETROULAKIS E,PARSYAN A,DOWLING R J,et al.p53-dependent translational control of senescence and transformation via 4E-BPs[J].Cancer Cell,2009,16(5):439-446.
[16]姚红,朱晓苏,徐康萍,等.RhoB抑制慢性粒细胞白血病细胞的生长[J].东南大学学报:医学版,2012,31(5):537-542.
[17]曹倪豪,陈明.BTGI在肾透明细胞癌组织中的表达及对786-O细胞株增殖和凋亡的影响[J].东南大学学报:医学版,2011,30(4):583-587.
[18]吴平平,苏昀,金治,等.RohA蛋白通路在DLC-1基因调控人结肠癌HT29细胞周期中的作用及其机制[J].东南大学学报:医学版,2009,28(4):247-251.

