低强度超声联合微泡的声空化效应介导大鼠C6胶质瘤细胞凋亡的研究*
吴晓辉, 陶裕川, 汪 峰, 黄 琴, 邓金木, 王志刚, 程 远△
重庆医科大学1附属第二医院神经外科2超声影像研究所,重庆400010
凋亡及凋亡抵抗是肿瘤形成的基础,同时也成为肿瘤靶点治疗的策略之一。脑胶质瘤是颅内最常见的恶性肿瘤,手术、放化疗治疗均难以达到根除,复发率极高[1]。与其他恶性肿瘤一样,脑胶质瘤的发生与细胞凋亡机制失常有关[2-3]。在适当的超声参数条件下,低强度超声联合微泡的声空化效应能够改变细胞膜的膜质结构、增强其渗透性、促进基因转染和诱导细胞凋亡,显示出其在无创超声外科中潜在的临床应用前景[4-5]。本实验采用低强度(低频、低功率)超声联合微泡作用于体外大鼠C6胶质瘤细胞,重点观察了不同低强度超声联合微泡对大鼠C6胶质瘤细胞的增殖和凋亡的影响,并探讨其可能的机制。
1 材料与方法
1.1 实验材料及主要试剂
大鼠C6胶质瘤细胞株(以下简称C6细胞)由重庆医科大学病理生理学教研室惠赠。四甲基偶氮唑盐(MTT,美国Sigma公司)、二甲基亚砜(DMSO,美国Ameresco公司),吖啶橙/溴化乙啶(AO/EB试剂盒上海百萃),AnnexinⅤ-FITC/PI试剂盒(深圳晶美公司)。SonoVue微泡,意大利BRACCO Imaging B.V.公司生产,上海博莱科信谊药业有限责任公司提供。
1.2 实验仪器
低频超声治疗仪:超声探头直径2.5cm,长度10cm,频率43kHz,功率为0.50~2.75W/cm2,共6档、全自动酶标仪(奥地利TECAN公司)、FACSort流式细胞仪(美国B&D公司)、透射电镜(日本HITACHI公司 H-7500型)、扫描电镜(日本 HITACHI公司S3000N型)、倒置显微镜及成像系统(日本Nikon公司)。
1.3 实验分组
实验分为空白组(加入完全培养液,不加入细胞,不用超声处理)、对照组(加入完全培养液培养细胞,以与辐照组同样的细胞密度、水温和时间予以对照)和不同超声剂量组(0.1、0.3、0.5、0.7、1.0、1.5 W/cm2)。微泡剂量(SonoVue)15μL/mL;观察时间0、6、12、24、48h。
1.4 实验方法
1.4.1 C6胶质瘤细胞的培养 将C6胶质瘤细胞接种于含10%胎牛血清的RPMI 1640完全培养液的培养瓶中,37℃、5%CO2的培养箱培养。待细胞处于对数生长期时,分组实验。
1.4.2 超声辐照C6胶质瘤细胞 探头固定于盛脱气水质容器底部,实验水温37℃,将盛有处于对数生长期C6细胞的96孔板垂直固定于探头正上方,微泡剂量(SonoVue)15μL/mL,距探头1cm,超声频率43kHz,持续辐照时间1min。
1.4.3 MTT比色法检测各功率、各时间段抑瘤率初步确定实验参数 取对数生长期C6细胞,锥虫蓝活细胞拒染法计数活细胞90%以上,用RPMI 1640完全培养液配制成3×104/mL细胞悬液,以200 μL/孔接种于96孔培养板,每块培养板接种20个平行孔,共40块。每组5块培养板。辐照后继续培养0、6、12、24、48h。在上述时间点取出培养板,每孔加入 MTT 20μL(5mg/mL),培养箱中孵育4h,弃去上清,每孔加入200μL DMSO,振荡15min,检测波长570nm的全自动酶标仪检测各组C6细胞的吸光度值(A值)和标准差。抑瘤率公式:抑瘤率(%)=1-实验组A值/空白组A值×100%。
1.4.4 AO/EB双染免疫荧光鉴别凋亡/坏死/活细胞 将细胞悬液以每孔200μL接种于96孔培养板,每块培养板接种20个平行孔。超声处理后细胞继续培养6h,PBS洗涤2次,将100μg/mL的吖啶橙和溴化乙啶荧光染液按1∶1比例混匀,按照1.5×104个细胞/μL的比例与培养细胞混匀。在荧光显微镜下510nm激发波长观察和鉴别凋亡/坏死/活细胞形态、颜色变化。随机计数4个视野,每视野200个细胞,计算细胞平均凋亡率和细胞平均坏死率。细胞平均凋亡率=(凋亡早期细胞数+凋亡晚期细胞数)/细胞总数×100%,细胞平均坏死率=坏死细胞数/细胞总数×100%。
1.4.5 流式细胞仪检测细胞凋亡率及细胞周期分布 取对数生长期C6细胞,消化离心,PBS洗涤2次,70%冰乙醇固定,制成5×106个/mL细胞悬液,加样入流式细胞仪检测细胞凋亡百分率及细胞周期分布,并计算凋亡增殖比(APR):APR=细胞凋亡率/细胞增殖构成比(S+G2/M期百分比)。
1.4.6 透射电镜观察细胞和细胞膜超微结构的改变 超声处理后细胞继续培养6h,消化、离心收集细胞,2.5%戊二醛-1%锇酸双固定、梯度乙醇脱水、包埋、切片及铀-铅双染色、烘干,透射电镜观察、照像。
1.4.7 扫描电镜观察细胞膜超微结构的改变 将C6细胞接种于内铺有2cm×2cm载玻片的6孔培养板,超声处理后细胞继续培养6h,取出有细胞爬片的载玻片,取PBS漂洗3次,然后固定、脱水,扫描电镜观察、照像。
1.5 统计学分析
2 结果
2.1 MTT法检测低频超声对C6胶质瘤细胞增殖的抑制作用
结果见表1,与对照组比较,超声联合微泡辐照各时间段C6细胞生长抑制率均呈明显剂量依赖性;超声辐照6h组细胞生长抑制率最高,其后随时间逐渐下降,在实验6h时间段上,与0.1W/cm2组、0.3W/cm2组、0.5W/cm2组相比,0.7W /cm2组、1.0W/cm2组、1.5W/cm2组对 C6细胞增殖抑制率明显增加,差异有统计学意义(均P<0.05);而0.7W/cm2组、1.0W/cm2组、1.5W/cm2组3组间比较,差异无统计学意义(P>0.05)。
表1 不同参数不同时间低频超声联合微泡对C6细胞增殖的影响(±s)Table 1 Effects of low-frequency ultrasound with different parameters on C6cells growth at different time(±s)

表1 不同参数不同时间低频超声联合微泡对C6细胞增殖的影响(±s)Table 1 Effects of low-frequency ultrasound with different parameters on C6cells growth at different time(±s)
与对照组比较,*P<0.05;与0.1W/cm2组、0.3W/cm2组、0.5W/cm2组比较,均▲P<0.05
抑瘤率(%)组别5±0.32实验组0.1W/cm2 1.71±0.05* 18.43±0.18* 15.99±0.29* 13.16±0.17* 12.07±0.59*0.3W/cm2 1.69±0.17* 16.79±0.16* 17.35±0.15* 11.09±0.20* 10.47±0.33*0.5W/cm2 1.47±0.31* 19.27±0.00* 14.14±0.14* 12.04±0.74* 11.38±0.05*0.7W/cm2 1.02±0.16* 34.19±0.17*▲ 19.11±0.13* 18.27±0.82* 17.43±0.15*1.0W/cm2 1.54±0.01* 37.82±0.16*▲ 24.54±0.75* 18.75±0.51* 16.29±0.31*1.5W/cm2 2.15±0.71* 39.19±0.22*▲ 28.41±0.84* 19.55±0.19* 18.45±0.33 0h 6h 12h 24h 48h对照组 0.01±0.10 0.07±0.11 0.04±0.16 0.02±0.10 0.0*
2.2 低频超声联合微泡对C6胶质瘤细胞凋亡和坏死的影响
AO/EB荧光染色鉴别坏死/凋亡/活C6细胞,并计算细胞凋亡率和细胞坏死率。结果表明:0.7 W/cm2组联合微泡细胞凋亡率高于对照组和其它实验组,而细胞坏死率明显低于1.0W/cm2组、1.5 W/cm2组。0.7W/cm2辐照组 C6细胞凋亡指数为(17.03±1.94)%,而对照组为(2.31±1.57)%,提示0.7W/cm2为最佳参数(图1、2)。
2.3 低频超声联合微泡对C6细胞凋亡和细胞周期的影响
流式细胞仪检查结果表明:与对照组比较,辐照组细胞凋亡率明显升高(P<0.01);并在正常二倍体细胞周期G0/G1峰前出现一个特征性的凋亡峰(AP)(图3、4)。与对照组比较,辐照组细胞 G0/G1期百分比明显升高,而S期、G2/M期、S+G2/M期百分比(细胞增殖构成比)降低,差异均有统计学意义(均P<0.05);辐照组APR与对照组相比,差异有统计学意义(P<0.05)。见表2。
上述结果显示低频超声联合微泡辐照后,①C6细胞生长阻滞于G1/S期,处于DNA复制和活动的细胞数目减少,细胞增殖受到抑制;②细胞凋亡率增加,细胞增殖率降低,提示低频超声可抑制C6胶质瘤细胞生长。
2.4 TUNEL法实验结果
对照组正常细胞呈蓝色、梭形排列,可见极少量的TUNEL染色阳性的棕黄色凋亡细胞呈单个散在分布(图5A、5C)。辐照组正常细胞呈蓝色、梭形排列,有少量的TUNEL染色阳性的棕黄色凋亡细胞(图5B、5D)。
2.5 低频超声联合微泡对C6细胞超微结构的影响
透射电镜下,对照组C6细胞边界清楚、细胞核染色质分布均匀,胞质丰富,线粒体外形正常,内膜嵴清晰可见,细胞器未见明显损伤(图6A);凋亡组C6细胞可见到凋亡各阶段的改变,早期核染色质浓集形成半月形环贴近核膜,染色质边集(图6B),继而,细胞体积缩小、胞质浓缩、细胞核浓聚缩小,染色质进一步固缩聚集于核膜下(图6C),最后,细胞核表现为核固缩、核碎裂,可见胞膜包绕核碎片形成的凋亡小体(图6D)。
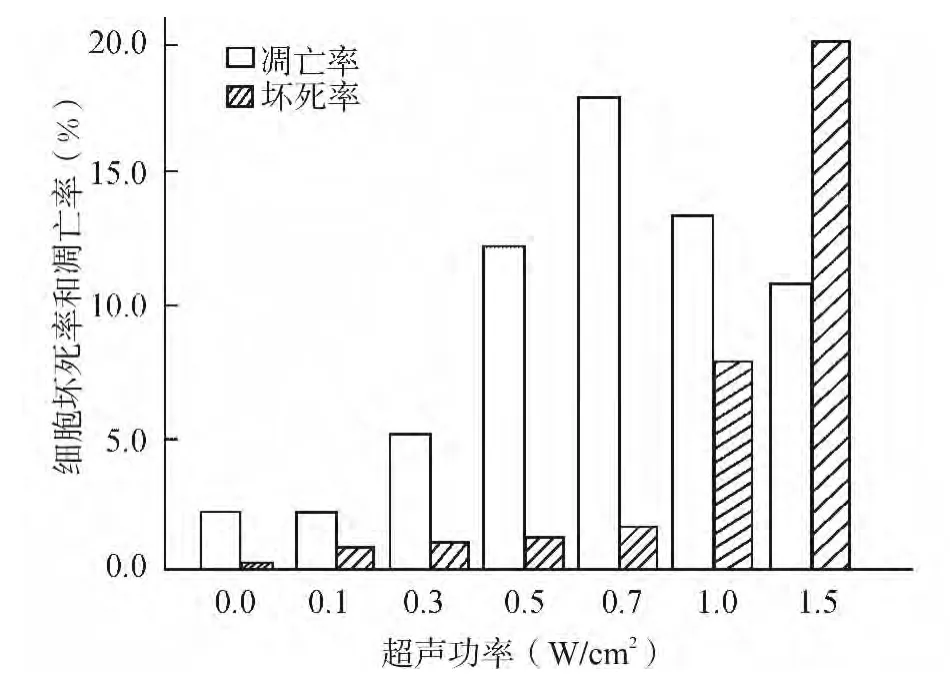
图1 低频超声对C6胶质瘤细胞凋亡和坏死的影响Fig.1 Effect of LIUS on the apoptosis and necrosis of C6glioma cells
表2 超声联合微泡治疗后细胞周期相关参数(n=10,±s)Table 2 Changes of cell cycle-related parameters after treatment with LIUS plus microbubbles(n=10,±s)

表2 超声联合微泡治疗后细胞周期相关参数(n=10,±s)Table 2 Changes of cell cycle-related parameters after treatment with LIUS plus microbubbles(n=10,±s)
与对照组比较,*P<0.05
组别 G0G1期 S期 G2M期 S+G2M期APR对照组 56.48±1.23 29.83±2.67 23.69±1.48 41.33±3.17 0.03±1.51辐照组 78.73±2.34* 17.47±2.19* 3.80±2.76* 20.31±3.49* 0.64±3.14*///

图2 荧光显微镜观察和鉴别凋亡/坏死/活C6细胞形态(×400)Fig.2 Morphological changes of apoptotic,necrotic and viable C6cells observed and identified by fluorescent microscopy(×400)

图3 对照组G0/G1峰前未出现凋亡峰Fig.3 No appearance of the apoptosis peak before the G0/G1peak in control group
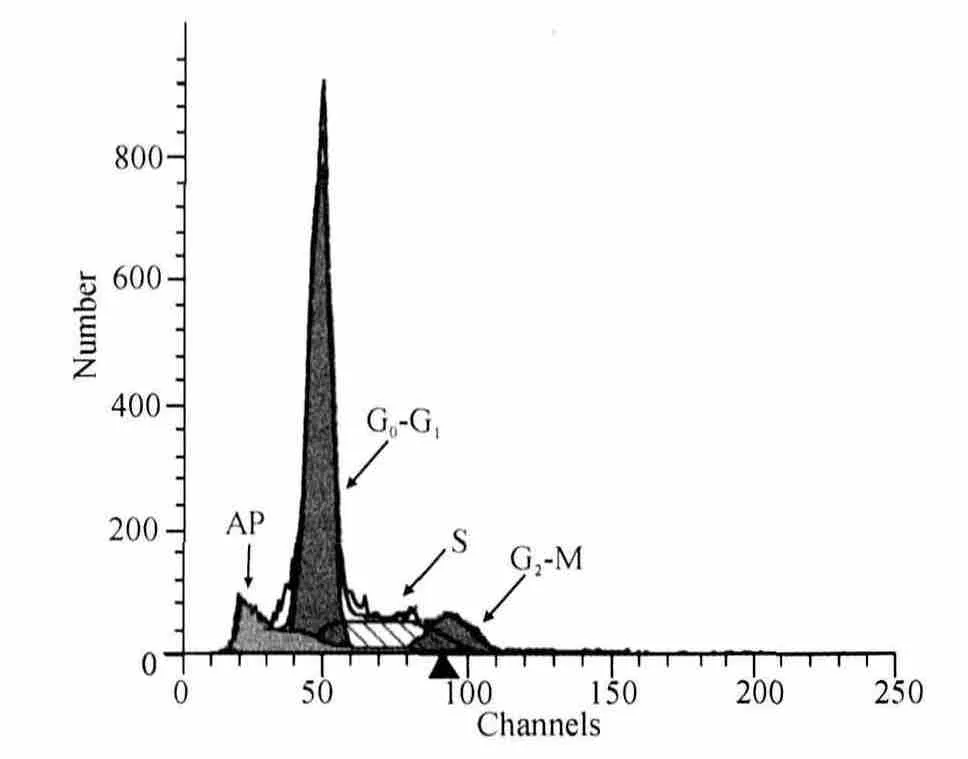
图4 辐照组G0/G1峰前出现1个凋亡峰Fig.4 Appearance of the apoptosis peak before the G0/G1peak in irradiation group

图5 TUNEL法观察细胞凋亡情况Fig.5 Observation of cell apoptosis by TUNEL assay
2.6 扫描电镜观察
观察到对照组细胞形态结构正常,细胞膜表面有一些皱褶和微绒毛,细胞边界清楚(图7A)。辐照组细胞形态结构正常,细胞膜有穿孔(图7B),多孔融合等现象(图7C)。
3 讨论
低强度超声波具有无创、靶向、聚焦和穿透性强等特点,越来越引起人们的重视与期待。近年研究表明低强度超声联合微泡所产生的声空化效应不仅可以增强对离体活体细胞或肿瘤细胞的药物导入、基因转染,还可诱导肿瘤细胞凋亡,增强化疗药物对肿瘤细胞的杀伤作用,以及逆转肿瘤对化疗药物的耐药性[6-7],但上述研究主要见于非神经肿瘤细胞,如 HL-60、K562、U937、HeLa和 M/2等多种种类的肿瘤细胞,而针对神经肿瘤的研究甚少。
本研究在前期研究的基础上,重点讨论不同强度低频超声联合微泡对C6胶质瘤细胞生长、增殖和凋亡的影响。其结果表明:不同剂量低强度超声联合微泡对C6胶质瘤细胞增殖均有抑制作用,且呈明显的剂量依赖性,辐照后6h和12h增殖抑制作用最明显。采用超声频率43kHz、辐照物距离探头1 cm、微泡剂量为10μL/mL,辐照功率0.7W/cm2、持续辐照1min,处理后6h,C6胶质瘤细胞的凋亡率高,而坏死率较低,此条件为本研究提供的低强度超声联合微泡诱导C6细胞凋亡的最佳参数。当辐照功率继续增加时,虽然细胞凋亡率仍继续增加,而细胞坏死率也明显增加。其结果提示低强度超声联合微泡干预后C6胶质瘤细胞凋亡率增加,细胞增殖指数下降,APR上调,这为肿瘤的治疗提供了一种新的策略。最后,通过流式细胞仪和电镜观察发现其典型凋亡变化过程和特征性电镜改变,即染色质边集,细胞体积缩小、细胞核浓聚缩小,染色质进一步固缩聚集于核膜下,以及核固缩、核碎裂和凋亡小体等,以及在细胞周期G0/G1峰前出现一个特征性的凋亡峰,其平均凋亡率为(17.03±1.94)%,APR显著增加,C6细胞生长受阻于G1/S期。

图6 透射电镜观察(×10 000)Fig.6 Observation under the transmission electron microscope(×10 000)
既往研究业已证实改变低强度超声的各种物理参数,如频率、脉冲重复频率、脉冲持续时间、声辐射时间会直接影响受辐射细胞的结果,适当的声能量条件下,能获得不同的肿瘤治疗效果,过强的超声声能量则导致细胞坏死,而适当的声能量可引起细胞凋亡。同时微泡的加入通过其声空化效应不仅能增强超声介导肿瘤细胞的凋亡率,更重要的是能降低超声诱导细胞凋亡的阈值,减轻声空化效应的副损伤。本研究结果进一步通过大鼠C6胶质瘤细胞验证了低强度超声联合微泡能改变神经胶质瘤细胞的命运、诱导细胞凋亡;为胶质瘤的治疗提供了一种可能的策略。
超声联合微泡是通过超声的声空化效应而实现的。声空化效应包括微泡的线性或非线性振动的稳态空化和瞬间空化,前者产生微波流(micro-streaming),后者产生冲击波、辐射力、剪切力、自由基等复杂的物理效应。冲击波、辐射力等声空化效应能短暂改变细胞膜结构,增强其通透性,正像本研究扫描电镜观察到的细胞膜表面出现大小不同的小孔,部分小孔融合,该现象为超声直接通过细胞膜提高穿透性提供了直接证据,与Ogawa等[8]观察到的一样,从形态学证实了低强度超声能引起细胞膜结构损伤。而自由基和微波流导致的粘滞应力,对细胞器、细胞骨架损伤、DNA单链断裂,尤其是线粒体产生影响,通过对细胞凋亡信号传导,引起细胞凋亡[8-11],本研究通过组织学、免疫组化和透射电镜观察到细胞内重要细胞器线粒体变化,其细胞皱褶、胞膜成泡、膜上磷脂酰丝氨酸反转和DNA断裂、染色体浓缩以及线粒体肿胀、嵴减少、甚至空泡化等线粒体结构改变等典型的凋亡特征[12-14]。
有学者研究证实超声联合微泡介导的肿瘤细胞凋亡是通过线粒体细胞色素C等激活Caspase家族蛋白,包括Caspase-3、-6、-9等内源性线粒体途径实现的,最终破坏瘤细胞线粒体或核糖体[15],或引起瘤细胞骨架成份(如微管、微丝)解体,从而引起肿瘤细胞增殖抑制和肿瘤细胞凋亡。本实验采用低强度超声联合微泡诱导C6胶质瘤细胞凋亡的研究,进一步证实了低强度超声联合微泡能引起C6胶质瘤细胞增殖抑制和肿瘤细胞凋亡。其机制可能是通过声空化效应促使肿瘤细胞膜通透性增加,激活内源性线粒体Caspase途径,启动凋亡程序,最终达到细胞凋亡的目的。但上述发现仅仅是初步研究,超声联合微泡所形成声空化效应,包括声孔效应、启动凋亡、提高基因转染等机制还有待进一步深入研究[16-17]。
[1] Lefranc F,Rynkowski M,DeWitte O,et al.Present and potential future adjuvant issues in high-grade astrocytic glioma treatment[J].Adv Tech Stand Neurosurg,2009,34(1):3-35.
[2] Stewart L A.Chemotherapy in adult high-grade glioma:a systematic review and meta-analysis of individual patient data from 12randomised trials [J].Lancet,2002,359(9311):1011-1018.
[3] Steinbach J P,Wetler M.Mechanisms of apoptosis in central nervous system tumors:application to theory[J].Curt Neural Neurosci Rep,2002,2(3):246-253.
[4] Yu T,Li S,Zhao J,et al.Ultrasound:a chemotherapy sensitizer[J].Technol Cancer Res Treat,2006,5(1):51-60.
[5] Pan H,Ma X,Li M,et al.Ultrasound assistant chemotherapy may be a novel modality for solid tumors[J].Med Hypotheses,2009,73(4):526-527.
[6] Feril L B Jr,Kondo T,Cui Z G,et al.Apoptosis induced by the sonomechanical effects of low intensity pulsed ultrasound in a human leukemia cell line[J].Cancer Lett,2005,221(2):145-152.
[7] Kedar U,Phutane P,Shidhaye S,et al.Advances in polymeric micelles for drug delivery and tumor targeting[J].Nanomedicine,2010,6(6):714-729.
[8] Ogawa K,Tachibana K,Uchida T.High-resolution scanning electron microscopic evaluation of cell-membrane porosity by ultrasound[J].Med Electron Microsc,2001,34(4):249-253.
[9] Lagneaux L,de Meulenaer E C,Delforge A,et al.Ultrasonic low-energy treatment:a novel approach to induce apoptosis in human leukemic cells[J].Exp Hematol,2002,30(11):1298-1301.
[10] O’Brien W D Jr.Ultrasound-biophysics mechanisms[J].Prog Biophys Mol Biol,2007,93(1-3):212-255.
[11] Feng Y,Tian Z,Wan M.Bioeffects of low-intensity ultrasound in vitro:apoptosis,protein profile alteration,and potential molecular mechanism[J].J Ultrasound Med,2010,29(6):963-974.
[12] 肖群根,张涛,毛峰,等.LRIG1过表达对顺铂诱导的胶质瘤细胞凋亡的影响及其机制[J].华中科技大学学报:医学版,2012,41(6):656-659,664.
[13] 曾令成,万锋,叶飞,等 .生理氧环境下CD133分子在脑胶质瘤干细胞的表达[J].华中科技大学学报:医学版,2012,41(4):423-426,430.
[14] Feril L B Jr,Kondo T,Tabuchi,Y,et al.Biomolecular effects of low intensity ultrasound:apoptosis and sonotransfection and gene expression[J].Jpn J Appl Phys,2008,46(7):4435-4440.
[15] Hassan M A,Campbell P,Kondo T.The role of Ca2+in ultrasound-elicited bioeffects:progress,perspectives and prospects[J].Drug Discov Today,2010,15(21/22):892-906.
[16] McDannold N,Vykhodtseva N,Hynynen K.Blood-brain barrier disruption induced by focused ultrasound appears to be characterized by the mechanical index[J].Ultrasound Med Biol,2008,34(5):834-840.
[17] Choi J J,Pernot M,Small S A,et al.Noninvasive,transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice[J].Ultrasound Med Biol,2007,33(1):95-104.

