地中海贫血的分子机制及其相关microRNA表达调控的研究进展
孙士鹏 吴志奎 刘贵建
地中海贫血(thalassemia)是一种由珠蛋白基因的缺失或点突变所致的典型的单基因遗传病[1]。此病最早发现于地中海区域,因而命名为地中海贫血,希腊语为thalassemia(thalassa翻译为海,haima翻译为血)。由于此病为遗传性的珠蛋白合成障碍,我国自然科学名词审定委员会建议地中海贫血的名称为珠蛋白生成障碍性贫血。习惯上仍称为地中海贫血,在东南亚和地中海区域此病的发病率和病死率很高。据估计全球每年至少有30万名新生儿罹患镰状细胞贫血或地中海贫血[2],在我国广东、广西、云南、四川等省份发病率较高。
一、地中海贫血的分类及分子机制
正常血红蛋白为四聚体,由2个α链(α、ξ、θ)和2个非α链(β、δ、γ、ε)组成。成人体内的血红蛋白(HbA)有以下 3 种:HbA(α2β2)、HbF(α2γ2)和HbA2(α2δ2)。健康成人个体 HbF<1%,HbA2为2.5% ~3.5%,胎儿血红蛋白 (HbF)则主要由α链和γ链(HbF,α2γ2)构成。珠蛋白编码基因缺失或功能缺乏,使珠蛋白肽链合成减少,比例失调而导致的早期造血障碍即为地中海贫血。地中海贫血根据生成减少的珠蛋白肽链种类的进行分类:如果α链合成减少称为α地中海贫血,β链生成减少的称为β地中海贫血[3]。由于过剩的珠蛋白链聚合、沉积于红细胞膜,出现免疫损伤,诱发氧自由基反应,引起继发性酶和代谢异常,导致红细胞变形能力和机械稳定性下降,最终导致溶血和无效造血。α和β地中海贫血较为常见,在我国广西、广东地区ɑ-地中海贫血的发生率达到8%以上,此外还有δβ型及δ型地中海贫血等类型。
1.α-地中海贫血的分子机制:α珠蛋白基因位于第16号染色体短臂上(16p13.33),以5'-ζ-ψζ-ψα1-α2-α1-θ-3'顺序排列,全长约30kb(图1B)[4]。每条同源染色体上有两个结构基因,因此每对染色体上共有4个 α 基因,书写为 αα/αα[4]。根据同一条染色体上的相邻的两个α珠蛋白基因中的缺失情况,可以把α-地中海贫血分为α+和α°两种类型。相邻的两个α珠蛋白基因中1个发生缺失(基因型为-α/αα)或者点突变而丧失功能(基因型为αTα/αα)即为α+地中海贫血。两个α珠蛋白基因均发生部分或完全缺失(基因型为--/αα)称为α°地中海贫血。根据1对(即两条)染色体的α基因缺失状态的不同组合,α地中海贫血又可分为以下几类:①4基因均缺损的称为重型地中海贫血(又称Bart's水肿胎)。临床表现是胎儿宫内死亡,胎儿呈重度地中海贫血和水肿。通常这种类型的婴儿的母亲怀孕和产后易患毒血症;②3个α基因缺损(基因型为--/-α),仅剩一个正常的α基因,称为血红蛋白H病。患者仅能合成少量α链,多余的β链则合成HbH(β4),临床表现是中度或贫血和脾大;③两基因缺损(又称为轻型地中海贫血),病理生理改变轻微。患者临床常上表现为轻度贫血;④单个基因缺损(又称为静止型地中海贫血)。患者一般不表现出临床症状,血红蛋白病理生理改变非常轻微,很难诊断到贫血所以称为“静止型”。静止型α-地中海贫血往往是因为其子代罹患轻型地中海贫血或血红蛋白H病而被推断出来,当然也可以通过特定DNA检测进行诊断。
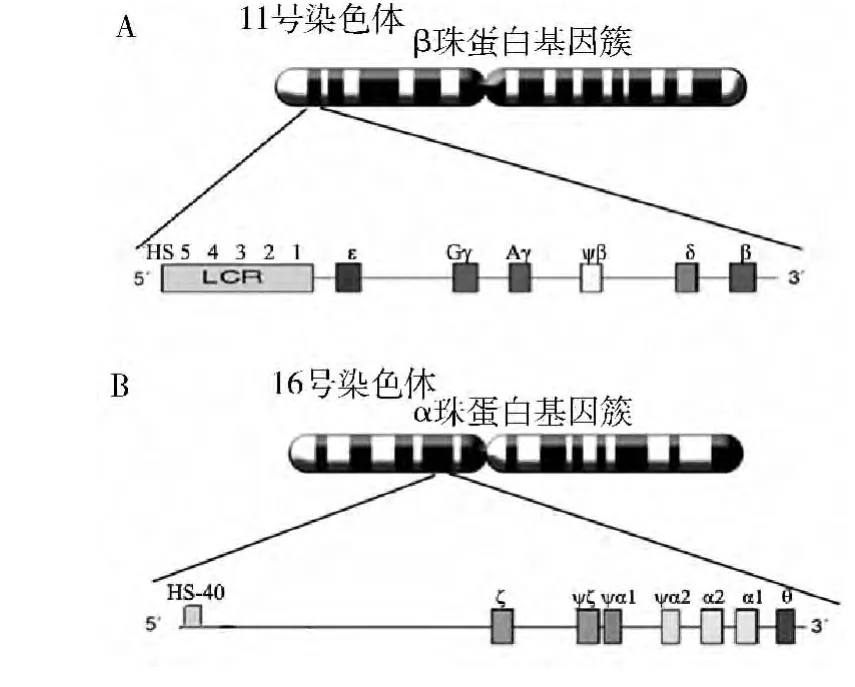
图1 珠蛋白编码基因簇的染色体定位
2.β-地中海贫血的分子机制及分类:β-珠蛋白基因簇位于第11号染色体短臂上(11p15.5),以5'-ε-Gγ-Aγ-ψβ-δ-β-3''顺序排列,全长约40kb(图1A)。临床上,根据β珠蛋白肽链合成情况β-地中海贫血分为β+地中海贫血(β珠蛋白肽链合成减少)和β°地中海贫血(β珠蛋白肽链合成完全缺失)[5]。大多数情况下这种临床分型分别同β珠蛋白编码基因的纯合子和杂合子状态对应,即1个β蛋白基因均发生缺损为β+地中海贫血,又称为轻型β-地中海贫血;两个β珠蛋白基因均发生缺损为重型β-地中海贫血。此外,小部分患者临床症状介于两者之间,临床上称之为中间型地中海贫血。
二、地中海贫血相关microRNA表达调控的研究
microRNA(miRNA)是一类长约19~24nt的非编码单链小RNA分子,人类miRNA基因在RNA聚合酶Ⅱ或Ⅲ的作用下,转录成初级miRNA(pri-miRNA),在细胞核内被切割成~70nt的miRNA前体(pre-miRNA)。随后,pre-miRNA通过 RanGTP/Exportin 5的转运机制被运送至细胞质,进一步被切割加工称为成熟的miRNA。在动物中,miRNA可以通过与靶基因3'UTR区互补结合,抑制靶基因翻译成蛋白质,进而在细胞、组织或个体水平上影响生物体的生长发育,并参与免疫反应和多种疾病过程。据预测,miRNA能够靶向30%的人类基因,调控50%的蛋白编码基因。每个miRNA可能有200个以上的靶标并直接影响数百个基因的翻译。2008年,在人血清等体液中检测到稳定性良好的循环miRNA,可作为肿瘤等疾病诊断和治疗的靶标。进一步资料表明,大部分循环miRNA以不同程度的与Argonaute 2(Ago 2)结合形成复合物的形式存在于微泡(microvesicles)和外体(exosomes)内,作为细胞间通讯的传送工具,通过微泡输送给靶细胞并在靶细胞内执行功能[6]。红系细胞分化过程不同阶段受到精确转录水平的调控,miRNA无疑也参与了相关的调控。人粒细胞、单核细胞、淋巴细胞、血小板、红细胞生成过程中的细胞以及红细胞内均可以检测到miRNA。miR-144,miR-320和miR-451表达上调后能够抑制红细胞生成负调节蛋白的表达,抑制miR-15a、miR -24、miR -103、miR -150、miR -221、miR -222、miR-223和miR-224的表达则能增强红细胞生成相关转录因子的表达水平[7]。近年来,miRNA在地中海贫血等疾病过程中的表达情况和发挥的作用也逐渐揭示。一些研究通过对地中海贫血红系分化过程中microRNA表达谱的分析可以确定筛选并鉴定出地中海贫血相关功能性miRNA。
Svasti等[8]发现β-地中海贫血患者早期红系祖细胞的分化过程中miRNA-451表达失调。通过对地中海贫血患者分离培养的红细胞前体细胞中miRNA-451表达水平进行检测,发现和正常人分离的细胞相比,地中海贫血患者培养中miRNA-451的表达水平分别是在第3天出现中度上调和在第12~14天显著上调。然而研究者仅发现miRNA-451在地中海贫血患者红系祖细胞分化中出现双阶段上调,其具体功能和作用机制还需要后续研究进行解释。
Bianchi等[9]使用miRNA芯片对地中海贫血患者(其中1例为缺失型遗传持续性胎儿血红蛋白综合征(HPFH))胎儿红细胞前体内miRNA表达谱进行筛选,发现HPFH患者红细胞前体内miR-210高表达。进一步通过对普卡霉素诱导K562细胞和红细胞前体细胞内miR-210的表达进行荧光定量PCR分析发现其表达水平对普卡霉素诱导时间和剂量具有依赖性。此外,研究者还发现miR-210表达水平的增加同胎儿γ珠蛋白基因的表达增加一致,这说明miR-210很可能参与了红系细胞分化过程中γ珠蛋白的表达调控,但这还需要进一步实验证实。最近,Sarakul等[10]发现,缺氧条件下,K562细胞分化过程中miR-210表达显著上调。在缺氧条件下K562细胞培养72h,细胞内 miR-210表达水平为正常含氧量培养条件下K562细胞内表达水平的7.03±2.40倍。正常含氧量条件下培养的正常红系细胞和β-地中海贫血红系祖细胞在第9天时miR-210的表达量均为最高,互相比较发现地中海贫血红系祖细胞内miR-210的表达量为正常红系祖细胞的5倍;在缺氧条件下,β-地中海贫血红系祖细胞内miR-210的表达量则为正常红系祖细胞表达量的7倍。缺氧环境还能够诱导体外培养的地中海贫血患者的成熟红细胞(CD71-/CD235a+)增加,转染anti-miR-210至红系祖细胞抑制miR-210的功能后这种现象被抑制,而且细胞内的α-、β-和γ-珠蛋白表达量也明显下降。不过,研究者通过生物信息学分析没有发现miR-210直接调控珠蛋白表达的证据,因而miR-210调控珠蛋白表达的机制究竟通过何种机制还需要进一步的研究来揭示。
红细胞生成过程中miR-503参与调控细胞周期阻滞和凋亡[11,12]。Roy 等[13]对 CD34+造血干细胞体外分化得到的CD235a+红细胞内miR-503进行检测,发现同正常样本相比,β-地中海贫血患者细胞内miR-503表达的水平显著下调(重型β-地中海贫血患者P=0.000,E-β重型地中海贫血P=0.003,E-β中间型地中海贫血P=0.003)。病情越重则miR-503表达水平越低。研究者认为正常情况下miR-503能通过抑制细胞增殖基因CDC25A的表达使红细胞的细胞周期静止。由于地中海贫血患者红细胞分化过程中miR-503表达量很低,则不能够有效抑制CDC25A的功能进而导致无效红细胞的生成和过度增殖。
BCL11A是一种高度保守的锌指蛋白,为B细胞和T淋巴细胞正常发育所必需。近期遗传学研究发现BCL11A是人体发育过程中血红蛋白的转换开关和成人γ珠蛋白表达抑制因子。miR-486-3p能够负性调控 BCL11A的表达,Lulli等[14]发现 β -地中海贫血患者外周血中分离获得的定向诱导红细胞内miR-486-3p表达量上调,其靶标BCL11A的mRNA和蛋白质含量则对应下调。此外,还发现地中海贫血患者红细胞内γ珠蛋白表达水平也显著高于正常对照组。此结果说明miR-486-3p的表达能够通过抑制BCL11A的功能,进而促进地中海贫血患者γ珠蛋白的表达。研究者认为miR-486-3p的表达水平还可能与β-地中海贫血的严重程度相关。
笔者课题组吴志奎教授首次提出“先天禀赋不足,肾虚髓损,精血化生无源”是地中海贫血的中医核心病机,“肾生髓、髓生血”是治疗的理论基础,应从肾论治采用补肾益髓法:以滋肾养肝、益精生血、健脾补气、逍痞退黄为治疗原则,用补肾益髓法代表方——益髓生血颗粒在广西高发区治疗β-地中海贫血取得可重复的肯定疗效[15]。课题组从整体效应、基因突变与疗效关系、骨髓有效造血、红细胞结构与功能、调控珠蛋白mRNA表达等不同层面,探讨了中药治疗地中海贫血疗效特点和作用靶点的分子机制,首次提出中药治疗地中海贫血不改变基因突变型,而是修饰、调控功能基因表达,改善珠蛋白链比,减低红细胞包涵体,诱导红系分化,促进骨髓有效造血[16]。研究结果使中药治疗地中海贫血整体水平达到新的高度。最近,张俊武等[17]对益髓生血颗粒一些纯化的组分进行分析,发现大黄素能够促进K562细胞内CD235a和CD71以及α-、ε-和 γ-珠蛋白的表达,并能通过下调miR-221和miR-222的表达水平来调控红细胞分化。此结果说明地中海贫血相关miRNA的研究能从一个侧面揭示中医药治疗相关疾病的分子机制。
三、展 望
地中海贫血是一种由珠蛋白基因缺失或点突变所致的典型的单基因遗传病,在地中海区域及我国南方危害很大,目前国内外治疗方法有限。通过高通量二代测序技术和miRNA芯片分析技术筛选出疾病相关异常表达miRNA,再通过大样本量实时荧光定量PCR验证和后续靶基因预测分析及靶蛋白表达的检测等分子生物学技术,将能够更深入地揭示地中海贫血相关miRNA的表达情况和相关机制,很有可能给地中海贫血的治疗带来新的靶点,也能为祖国传统医药科学内涵的研究提供新的研究思路。
1 Rachmilewitz EA,Giardina PJ.How I treat thalassemia[J].Blood,2011,118(13):3479-3488
2 Modell B,Darlison M.Global epidemiology of haemoglobin disorders and derived service indicators[J].Bull World Health Organ,2008,86(6):480-487
3 Forget BG.Preface thalassemia[J].Hematol Oncol Clin North Am,2010(6),24:xiii-xv
4 Denic S,Frampton C,Nagelkerke N,et al.Consanguinity affects selection of alpha-thalassemia genotypes and the size of populations under selection pressure from malaria[J].Ann Hum Biol,2007,34:620-631
5 Estevao IF,Peitl Junior P,Bonini-Domingos CR.Serum ferritin and transferrin saturation levels in β0 and β (+)thalassemia patients[J].Genet Mol Res,2011,10(6):632-639
6 Li L,Zhu D,Huang L,et al.Argonaute 2 complexes selectively protect the circulating microRNAs in cell- secreted microvesicles[J].PLoS One,2012,7(10):e46957
7 Lawrie CH.microRNA expression in erythropoiesis and erythroid disorders[J].Br J.Haematol.2010,150(2):144 - 151
8 Svasti S,Masaki S,Penglong T,et al.Expression of microRNA -451 in normal and thalassemic erythropoiesis[J].Ann Hematol,2010,89(10):953-958
9 Bianchi N,Zuccato C,Lampronti I,et al.Expression of miR -210 during erythroid differentiation and induction of gamma-globin gene expression[J].BMB Rep,2009,42(8):493 -499
10 Sarakul O,Vattanaviboon P,Tanaka Y,et al.Enhanced erythroid cell differentiation in hypoxic condition is in part contributed by miR-210 [J].Blood Cells Mol Dis,2013,51(2):98 -103
11 Forrest AR,Kanamori-Katayama M,Tomaru Y,et al.Induction of microRNAs,mir-155,mir-222,mir-424 and mir-503,promotes onocytic differentiation through ombinatorial regulation[J].Leukemia,2010,24(6):460 -466
12 Nie Y,Han BM,Liu XB,et al.Identification of Micro- RNAs involved in hypoxia-and serum deprivation-induced apoptosis in mesenchymal tem cells[J].Int J Biol Sci,2011,7(6):762 -768
13 Roy P,Bhattacharya G,Lahiri A,et al.hsa-miR -503 is downregulated in β thalassemia major[J].Acta Haematol,2012,128(3):187-189
14 Lulli V,Romania P,Morsilli O,et al.MicroRNA -486-3p regulates γ-globin expression in human erythroid cells by directly modulating BCL11A[J].PLoS One,2013,8(4):e60436
15 吴志奎.地中海贫血症的中医病机与治则治法[J].中医杂志,2009,50(1):73 -75
16 Wang WJ,Wu ZK,Zhang XH,et al.Effect of Yisuishengxue granule on the oxidative damage of erythrocytes with hemoglobin H disease[J].Chin J Integr,2012,18(9):670 - 675
17 Ma YN,Chen MT,Wu ZK,et al.Emodin can induce K562 cells to erythroid differentiation and improve the expression of globin genes[J].Mol Cell Biochem,2013,382(1 -2):127 -136

