北亚热带区红三叶自毒效应潜势初探
蔡 明,牟 兰,张美艳,王宗礼,黄必志*
(1.云南农业大学 动 物科技学院,云南 昆 明650201;2.兰州大学 草 地农业科技学院,甘肃 兰 州730020;3.云南省草地动物科学研究院,云南 昆 明650212)
红三叶(Trifolium pratense L.)是世界上重要的豆科牧草之一,不但群落适应性强、产量高而且茎叶柔软,适口性好,蛋白质含量占干物质的25%以上,各类家畜都喜采食,对改善家畜肉品质具有重要作用[1-3]。化感作用主要是指植物通过茎叶挥发、淋溶、根系分泌等途径向环境中释放化学物质并对其他植物或者自身产生促进和抑制的作用[4-8],是一种极其复杂的自然生态现象。红三叶具有极强的化感作用,其会分泌出多种异黄酮类物质,这些物质会从植物的不同部位释放到环境当中,对植物的生长发育起抑制作用,因此红三叶常形成较强的群落,不但排挤其他牧草,而且对自身也有影响[5,7]。当受体和供体属于同一种植物时,所产生的抑制作用现象,称为植物的自毒作用,它是植物种内相互影响的方式之一,是一种特殊的化感作用。近年来,国内有关水稻[9-10]、小麦[11-13]、甘蔗[14]、烟草[15]等植物化感作用的研究报道较多,而对红三叶自毒作用的研究鲜有报道。
本试验以北亚热带区昆明小哨牧场广泛栽培利用的小哨红三叶(茎、叶、花)三个部位浸提液为处理,研究了其对自身种子发育的影响,通过生物检测方法对红三叶的自毒作用进行了初步研究,确定其是否对自身种子发育具有自毒影响以及影响强度大小,以期为北亚热带地区建立优化的红三叶间作、混作、套种模式及优质高产提供理论依据。
1 材料与方法
1.1 试验材料
供体植物为小哨红三叶(Triflium pretense L.),于2013年8月初采集于云南省草地动物科学研究院小哨示范草场,此时红三叶处于开花初期。受体种子为小哨红三叶种子,于2012年采于小哨试验基地。
1.2 试验方法
1.2.1 红三叶茎、叶、花收集及浸提液的制备 挖取营养生长期生长健壮的红三叶新鲜植株,迅速分开植株茎、叶、花,刷干净灰土,剔除枯黄叶和老枝干,剪切5 mm左右小段;处理好的茎、叶、花称重后分别放入锥形瓶,按1 g鲜重材料:4 m L水的比例用无菌蒸馏水在18~20℃室温下震荡浸泡48 h,然后用3层灭菌纱布和双层滤纸过滤,再用0.45 μm微孔滤膜过滤得到浓度为0.25 g/m L的浸提液母液。将母液分别用无菌蒸馏水稀释为0.025 g/m L、0.05 g/m L、0.075 g/m L、0.1 g/m L、0.15 g/m L、0.20 g/m L浓度后保存于4℃冰箱。培养皿(Φ9 cm)和滤纸灭菌,每个培养皿铺2层滤纸,分别加入5 m L各浓度浸提液,无菌蒸馏水为对照。
1.2.2 种子萌发进行生物检测 选择颗粒饱满、大小均匀的红三叶种子用10%的 H2O2消毒5 min,再用无菌蒸馏水冲洗干净,均匀排列于培养皿内,每皿50粒,上盖,封口膜封好边缘,置于25℃恒温培养箱发芽。每日固定补充适量红三叶水浸提液或无菌蒸馏水1次,每个处理3次重复,并统计下胚轴长、幼根长和幼苗长。
1.3 数据统计
化感指数 RI=1-C/T(当T≧C时);RI=T/C-1(当T<C时),上式中:C指对照值,T指处理值,RI>0表示促进作用,RI<0表示抑制作用,RI绝对值的大小与化感作用强度一致。
用SPSS20.0进行单因子方差分析(One-way ANOVA)和Duncan描述法分析数据。
2 结果与分析
2.1 红三叶茎浸提液对下胚轴长、幼根长和幼苗长的影响
试验结果(表1)表明,不同浓度的茎浸提液处理红三叶种子,种子的下胚轴长、幼根长和幼苗长受到不同程度的促进和抑制作用。其中:下胚轴在不同浓度处理下均表现为促进作用,0.15 g/m L浓度的茎浸提液促进作用较大,化感指数为0.20,与对照差异极显著(P<0.01),且与0.10 g/m L浓度处理下的下胚轴长差异显著(P<0.05)。不同浓度的茎浸提液对幼根和幼苗均产生不同程度的抑制作用,(0.025~0.20 g/m L)浓度下,随着浓度增加,抑制作用不断增强;最高浓度0.20 g/m L的对幼根的抑制作用最强,化感指数为-0.60,与对照差异极显著,与0.15 g/m L差异不显著(P>0.05),而与其余浓度差异极显著(P<0.01);最高浓度0.20 g/m L对幼苗的抑制作用最强,化感指数为-0.34,与对照差异极显著(P<0.01),且与低浓度0.025 g/m L、0.050 g/m L差异极显著(P<0.01)。说明茎浸提液对幼根长的化感影响强度大于幼苗长。

表1 红三叶茎浸提液对下胚轴长、幼根长和幼苗长的影响Table 1 The effect of red clover stem extracts on hypocotyl,radicle and seedling length
2.2 红三叶叶浸提液对下胚轴长、幼根长和幼苗长的影响
从表2可以看出,不同浓度的叶浸提液对红三叶种子下胚轴长、幼根长和幼苗长产生了不同的影响,对下胚轴长均产生了促进作用,而对幼根长和苗长产生了抑制作用。其中:0.10 g/m L对下胚轴长的促进作用最大,化感指数是0.29,与对照差异极显著,且与0.025 g/m L、0.050 g/m L差异极显著(P<0.01)。不同浓度的叶浸提液对幼根长均产生了抑制作用,(0.075~0.20 g/m L)浓度区间,抑制作用随浓度的加大,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最大,化感指数为-0.69,与对照差异极显著(P<0.01),且与除0.050 g/m L浓度的其余处理差异极显著(P<0.01)。不同浓度的叶浸提液对幼苗长均表现为不同程度的抑制作用,(0.10~0.20 g/m L)浓度区间,抑制作用随着浓度的加大,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最大,化感指数为-0.39,与对照差异极显著(P<0.01),且与0.025 g/m L、0.075 g/m L、0.10 g/m L、0.15g/m L浓度的幼苗影响差异极显著(P<0.01)。说明叶浸提液对幼根长的化感影响大于幼苗长。
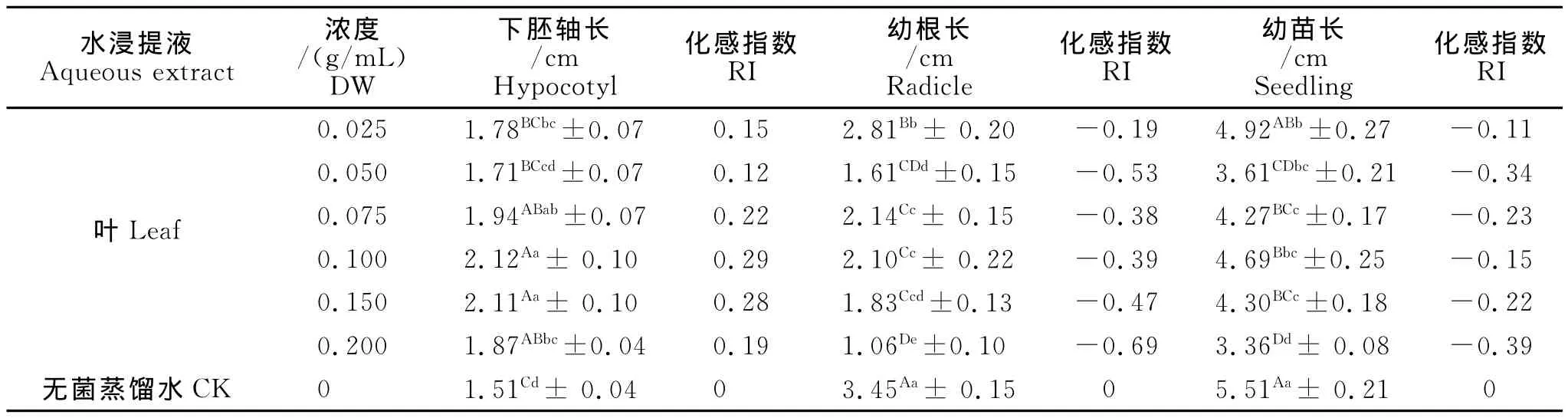
表2 红三叶叶浸提液对下胚轴长、幼根长和幼苗长的影响Table 2 The effect of red clover leaf extracts on hypocotyl,radicle and seedling length
2.3 花浸提液对红三叶下胚轴长、幼根长和幼苗长的影响
试验(表3)表明,不同浓度的花浸提液对红三叶下胚轴长、幼根长和幼苗长产生了不同影响,既有促进作用又有抑制作用。其中:花浸提液对下胚轴长表现为促进作用,最大浓度0.20 g/m L的促进作用最明显,化感指数为0.21,与对照差异极显著(P<0.01),且与 0.15 g/m L 浓度差异显著 (P<0.05);在(0.025~0.10 g/m L)浓度区间,随着浓度的增加,促进作用不断加强。不同浓度的花浸提液对幼根长表现出不同程度的抑制作用,(0.10~0.20 g/m L)区间,表现为随着浓度的增加,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最强,化感指数为-0.63,与对照差异极显著(P<0.01),且与0.025 g/m L、0.050 g/m L、0.075 g/m L、0.10 g/m L浓度下的幼根长差异极显著(P<0.01)。不同浓度的花浸提液对红三叶幼苗长均产生了抑制影响,(0.10~0.20 g/m L)区间,表现为随着浓度的增加,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最强,化感指数为-0.31,与对照差异极显著(P<0.01),且与0.025、0.050 g/m L浓度下的幼苗差异极显著(P<0.01)。花浸提液对幼根长的化感影响大于幼苗长。

表3 红三叶花浸提液对下胚轴长、幼根长和幼苗长的影响Table 3 The effect of red clover flower extracts on hypocotyl,radicle and seedling length
试验(表3)表明,不同浓度的花浸提液对红三叶下胚轴长、幼根长和幼苗长产生了不同影响,既有促进作用又有抑制作用。其中:花浸提液对下胚轴长表现为促进作用,最大浓度0.20 g/m L的促进作用最明显,化感指数为0.21,与对照差异极显著(P<0.01),且与 0.15 g/m L 浓度差异显著 (P<0.05);在(0.025~0.10 g/m L)浓度区间,随着浓度的增加,促进作用不断加强。不同浓度的花浸提液对幼根长表现出不同程度的抑制作用,(0.10~0.20 g/m L)区间,表现为随着浓度的增加,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最强,化感指数为-0.63,与对照差异极显著(P<0.01),且与0.025 g/m L、0.050 g/m L、0.075 g/m L、0.10 g/m L浓度下的幼根长差异极显著(P<0.01)。不同浓度的花浸提液对红三叶幼苗长均产生了抑制影响,(0.10~0.20 g/m L)区间,表现为随着浓度的增加,抑制作用不断增强,最高浓度0.20 g/m L的抑制作用最强,化感指数为-0.31,与对照差异极显著(P<0.01),且与0.025、0.050 g/m L浓度下的幼苗差异极显著(P<0.01)。花浸提液对幼根长的化感影响大于幼苗长。
3 讨 论
本试验以红三叶为供体材料,通过对其种子的科学生物检测,统计分析不同部位浸提液对其种子下胚轴长、幼根长和幼苗长这三个指标的化感作用,证实了红三叶不同部位能够产生多种自毒物质影响自身种子生长发育。本研究表明,红三叶具有自毒作用,与对照相比,不同浓度的红三叶各部位(茎、叶、花)浸提液对其种子生长发育产生了不同程度的影响,既有促进作用,又有抑制作用,与前人的研究结果一致[16-18]。关于植物不同部位浸提液不同浓度处理间的化感效应差异的问题,本试验显示只有当浸提液处理浓度达到某一临界点时,才会产生明显的化感抑制作用,低于这一浓度时红三叶不受损坏,且部分化感物质会对其生长产生一定的促进作用,李志华等[17,19-20]的研究也得出了类似的结果。此外,试验结果还揭示了不同部位的浸提液对种子幼根和幼苗的化感作用表现出一定的浓度效应,茎浸提液在(0.025~0.20 g/m L)浓度下,随着浓度增加,对幼根和幼苗抑制作用不断增强,叶、花浸提液在(0.10~0.20 g/m L)浓度下均表现出此种浓度效应现象。
红三叶不同部位浸提液对下胚轴长产生了促进作用,说明部分自毒物质在一定浓度下会产生促进植物生长的效应。本研究显示,不同部位的浸提液的促进作用强度不同,如茎浸提液0.15 g/m L对下胚轴长的促进作用最大,而叶、花浸提液对下胚轴长的促进作用最大的分别是0.10和0.20g/m L浸提液。这些差异显然不单单是化感物质浓度高低引起的,可能还与红三叶不同部位分泌的自毒物质种类差异有关。与下胚轴长所受浸提液促进作用不同的是,幼根长和幼苗长均受到了不同程度的抑制作用,且幼根受抑作用较幼苗大。试验过程中,受抑作用大的种子不仅根毛减少,而且根部出现上翻的败育现象,说明红三叶浸提液中的自毒物质是通过抑制根的发育,影响根部对营养和水分的吸收,从而抑制幼苗的生长,最终导致地上生物量下降。
植物种子萌发的过程是一个极其复杂的过程,室内试验条件和自然条件状态是不同的,红三叶在自然状况下由于受到热量、水分、土壤等因素的影响[21-22],红三叶的自毒作用强度也会有所不同,大部分化感物质是要通过枯枝败叶腐烂分解并经过复杂的土壤转化过程才逐步释放的,故今后还需加强砂培试验,做进一步研究。
[1] 杜占池,樊江文,钟华平.营养元素在红三叶叶片分解过程中的释放动态[J].草业科学,2003,20(7):12-15.
[2] 王元素,洪绂曾,蒋文兰,等.喀斯特地区红三叶混播草地群落对长期适度放牧的响应[J].生态环境,2007,16(1):117-124.
[3] Brown H,Moot D,Pollock K.Herbage production,persistence,nutritive characteristics and water use of perennial forages grown over 6 years on a Wakanui silt loam[J].New Zealand Journal of Agricultural Research,2005,48(4):423-439.
[4] 王大力,马瑞霞.水稻化感种质资源的初步研究[J].中国农业科学,2000,33(3):94-96.
[5] 孔垂华,徐 涛,胡 飞,等.环境胁迫下植物的化感作用及其诱导机制[J].生态学报,2000,20(5):849-854.
[6] Rice.Allelopathy[M].New York:Academic Press,1974:166-179.
[7] 李 博.生态学[M].北京:高等教育出版社,2000:97-99.
[8] 阎 飞,杨振明,韩丽梅.植物化感作用(Allelopathy)及其作用物的研究方法[J].生态学报,2000,20(4):692-696.
[9] 朱红莲,孔垂华,胡 飞,等.水稻种质资源的化感潜力评价方法[J].中国农业科学,2003,36(7):788-792.
[10] 孔垂华,徐效华,胡 飞,等.以特征次生物质为标记评价水稻品种及单植株的化感潜力[J].科学通报,2002,47(3):203-206.
[11] 林瑞余.小麦化感作用及其根际生态学研究[D].福州:福建农林大学,2008.
[12] 李振高,李良谟,潘映华,等.小麦苗期根系分泌物对根际反硝化细菌的影响[J].土壤学报,1995,32(4):408-413.
[13] 孙红艳.小麦化感种质资源评价及其遗传多样性研究[D].福州:福建农林大学,2008.
[14] 张爱加,袁照年,陈冬梅,等.甘蔗根际土壤化感潜力评价及其化感物质分析[J].中国生态农业学报,2010,18(5):1 013-1 017.
[15] 陈冬梅,黄锦文,柯文辉,等.连作烟草根际土壤化感潜力评价及化感物质鉴定[J].中国烟草学报,2012,18(1):46-52.
[16] 李志华,沈益新.红三叶茎叶对几种牧草种子及幼苗的化感作用[J].中国草地,2005,27(3):41-43,48.
[17] 郭晓霞,沈益新,李志华.几种豆科牧草地上部水浸提液对稗草种子和幼苗的化感效应[J].草地学报,2006,14(4):356-359.
[18] 李志华,沈益新,倪建华,等.豆科牧草化感作用初探[J].草业科学,2002,19(8):28-31.
[19] 王 慧,周淑清,黄祖洁.狼毒对草木犀、多年生黑麦草的化感作用[J].草地学报,2009,17(6):826-829.
[20] 朱旺生,沈益新.白三叶和高羊茅不同品种对萝卜幼苗的化感作用[J].南京农业大学学报,2004,27(1):28-31.
[21] 肖辉林,彭少麟,郑煜基,等.植物化感物质及化感潜力与土壤养分的相互影响[J].应用生态学报,2006,17(9):1 747-1 750.
[22] 李玉占,粱文举,姜 勇.苜蓿根际土壤化感潜力的初步研究[J].土壤通报,2004,35(6):776-779.

