蛇足石杉离体培养产生有效成分的研究
吉枝单,涂艺声,丁明华,陈 雄,蒋秀芳
江西师范大学 功能有机小分子教育部重点实验室,南昌 330022
蛇足石杉(Huperzia serrata (Thunb)Trev)又名千层塔、蛇足石松、蛇足草等,为石杉科石杉属蕨类植物,全草具有解毒、止痛、散瘀消肿功效[1]。自1972 年中国科学院上海药物研究所首次报道蛇足石杉植物中的生物碱石杉碱甲(Huperzine A,HupA)在动物实验上有松弛横纹肌的作用之后,已从中分得十几个生物碱单体[2],研究证明其中的HupA 是一种强效、可逆和高选择性乙酰胆碱酯酶抑制剂。低剂量HupA 对乙酰胆碱酯酶(Ach E)有强大的抑制作用,并对阿尔茨海默症(Alzheimer’s disease,AD)和重症肌无力有良好的治疗效果及有提高学习记忆力的功效[3]。随着老龄化社会的到来,阿尔茨海默症暨老年痴呆症已成为人类的第四大病魔。据临床试验,石杉碱甲Hup-A)制剂是目前国内外成功治疗老年性痴呆症的候选药物。因化学合成的相应成分取替天然石杉碱甲还有一定距离[4,5],而野生蛇足石杉生长缓慢,8 年左右的成熟株高仅20~30 cm,人工大面积栽培尚难实现,加上因利益驱动所致的对野生资源的肆意采挖,致使蛇足石杉自然资源严重匮乏。利用现代生物工程生产天然石杉碱甲是解决该稀缺资源的新途径[6,7]。国内胡之璧先生实验室报道,从蛇足石杉内生真菌中筛选到2 株内生真菌2F09P03B 和LQ2F01 具有能够累积结构不同而都具有抗乙酰胆碱酯酶活性的表现,取得了令人兴奋的成果。目前,蛇足石杉茎段离体培养再生叶状体产生石杉碱甲成分的研究报道鲜见,本研究为解决天然石杉碱甲资源匮乏找到了一条从叶状体离体培养获得之路,系植物器官工程生产植物源石杉碱甲的突破。
1 材料
1.1 植物材料
取自庐山多年生的野生蛇足石杉植株,由中国科学院庐山植物园詹远怀研究员鉴定提供。
1.2 主要试剂和仪器
石杉碱甲(Huperzine A,HupA)标准品购自上海源叶生物科技有限公司(批号:20110111),KQ3200DE 型数控超声波清洗仪;TLC 板为青岛海洋化工有限公司生产的硅胶G 板;Waters 2996 高效液相色谱仪。
2 方法
2.1 叶状体的诱导
实验采用上述蛇足石杉植株秋季的半木质嫩茎。仔细将嫩茎清洗干净、表面消毒,在无菌条件下,将叶片切割成5 mm×5 mm 或茎切割成5 mm 左右长,接种到准备好的的诱导培养基中:①MS[8];②MS+IAA0.5 mg/L;③1/2 MS+IAA0.5 mg/L;④1/4 MS+IAA0.5 mg/L;⑤6,7-V[9]+IAA0.5 mg/L。每瓶接种5 块,每个处理重复4 次。
2.2 叶状体的增殖培养
取诱导产生的叶状体分割成小块进行增殖培养条件优化。增殖培养基以MS 或1/2MS 或6,7-V 为基本培养基,添加不同浓度生长素IAA(0.1 mg/L~1.5 mg/L)、NAA、2,4-D 或IAA 与ZT 配合、不加任何激素的基本培养基(MS、1/2MS、B5、6,7-V)、蔗糖用量处理(g/L):10、15、20、25、30。每瓶接种约1 g,各种处理重复4 次,各培养基的pH 调至约5.8~6.2;培养在温度(24 ±2)℃,每日光照14 h,光照强度1500 lx 左右。
2.3 培养物增殖量的测定计算
采取相对增长百分率进行对比,这样可以消除因接种量的多少而产生的误差。
相对增长百分率=(收获量-接种量)/接种量×100%,每代生长期55 d。
2.4 培养物中生物碱的提取
参考王峻等[10]的方法作适当修改。叶状体收获后在60 ℃下烘干至恒重,用研钵研成粉末后,精确称取粉末1.0 g 于试管中,加入10 mL 2%酒石酸溶液,密封,浸提10~15 h,然后在70 MHz 下55 ℃超声1.5 h,滤出上清液;滤液加氨水调pH 至9~10,加入等体积氯仿,充分摇匀萃取,静置30 min 待分层,重复3 次,合并氯仿层蒸发至干,加入适量甲醇溶解得生物碱提取液,用作TLC 点样及高效液相检测。
2.5 培养物中石杉碱甲定性检测
薄层层析(TLC)检测:参照周汉华等[11]方法有所改进,展开剂3 个:氯仿/丙酮/异丙醇(4∶4∶2,v/v/v)、氯仿/丙酮/异丙醇/氨水(4∶4∶2∶0.1,v/v/v/v)、氯仿-甲醇-氨水(6 ∶1 ∶0.1,v/v/v);显色剂:0.2%高锰酸钾溶液。将点样的硅胶板置于预先饱和的展开剂中,待展开液离层析板另一端1 cm 处取出层析板,显色后测其Rf 值。
2.6 培养物中石杉碱甲HPLC 检测
参照王珊等[12]检测方法。色谱柱:Waters C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-醋酸铵(0.08 mol/L;pH=6)=3∶7;流速:0.8 mL/min;检测波长:308 nm;柱温:25 ℃;进样量:15 μL。
3 结果与分析
3.1 不同培养基组分对蛇足石杉外植体启动叶状体发生的差异
为了建立蛇足石杉组织培养繁殖系,笔者选择了不同的基本培养基、不同的养分浓度及添加生长素诱导处理外植体。实验结果表现,60 d 后有的培养基上分化出簇生叶状体见图1,70 d 统计结果见表1。外植体在较低养分浓度的培养基③、④、⑤上应答启动诱导率较高,蛇足石杉叶状体诱导率在40%~50%,而培养基①、②诱导率低;对比培养基⑤与②、③、④,有明显差异;说明蛇足石杉离体培养的启动要求适宜的基质配方,添加生长素能提高叶状体的诱导率。
3.2 外源激素对叶状体继代增殖的影响
在已建立的无菌离体叶状体基础上,为了探索叶状体继代增殖培养基中激素的作用,设计了多因素随机对比试验,结果见表2。

表1 不同培养基配方诱导蛇足石杉试管叶状体的启动Table 1 Thallus induction of Huperzia serrata (Thunb.)Trev.in different culture medium
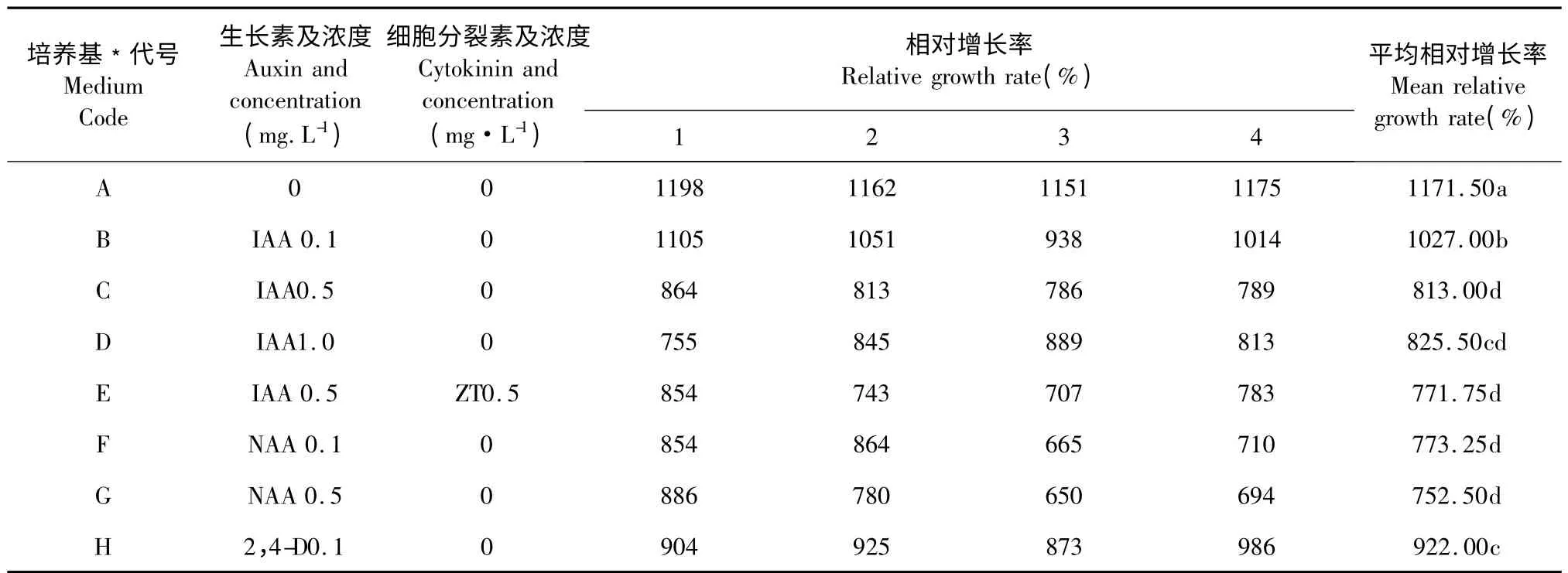
表2 激素对蛇足石杉试管叶状体继代增殖的效果Table 2 The effects of different media homen on growth of H.serrata thallus
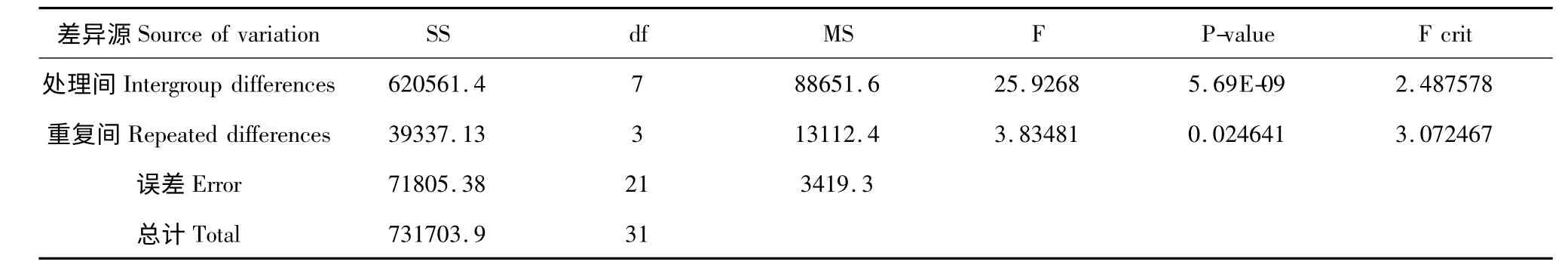
表3 方差分析Table 3 Analysis of variance
由表3 不同激素不同浓度诱导叶状体的增殖的方差分析中P <0.01,可以看出不同的培养基配方的作用极显著。从表2 Duncan 各处理间平均数看出,不加任何激素的培养基A,平均相对增长率最高,增长率达到了10 倍左右。叶状体在添加生长素2,4-D、NAA、IAA(0.1~1.0)mg/L 的不同浓度培养基上相对增长率均低于未添加激素的培养基A,说明外源激素对蛇足石杉离体叶状体增殖具有明显的抑制作用。
3.3 蔗糖用量对叶状体继代增殖的作用
在诱导外植体发生叶状体阶段,发现完全MS培养基的效果比1/2MS、1/4MS 以及6,7-V[10]诱导率低。但叶状体的继代增殖是脱离了外植体的组织器官增殖,为了探索其中主要碳源蔗糖的使用量,笔者设计了不同培养基质及蔗糖用量的多因素随机试验,培养55d 统计各处理生物量鲜重,换算相对增殖率以消除接种差异。结果见表4,叶状体在原始配方6,7-V、1/2MS、MS 培养基中培养,最适的培养基是6,7-V。

表4 不同基质与蔗糖用量对蛇足石杉试管叶状体继代增殖的差异Table 4 The effects of different media and used on growth of H.serrata thallus
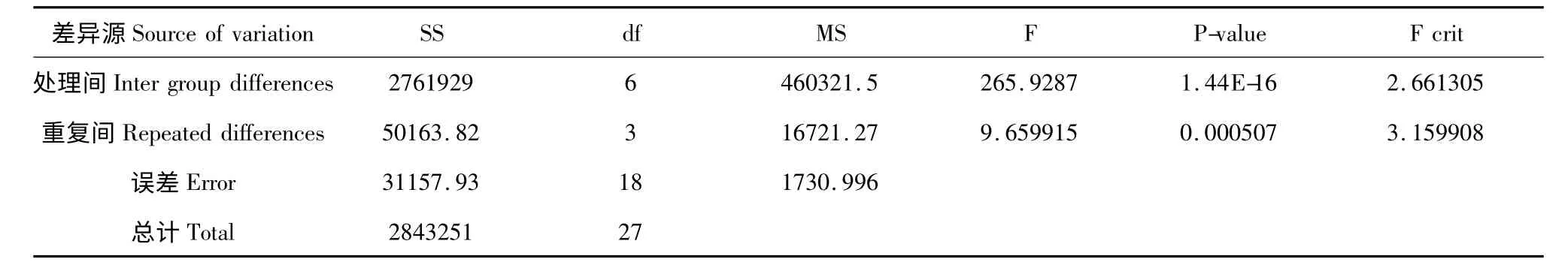
表5 方差分析Table 5 Analysis of variance
由表5 叶状体相对增殖率的方差分析中P <0.01,可以看出不同培养基种类的方差达到极显著。由表4 Duncan 法分析各处理平均数可以看出,在MS 基本培养基里加入20 g/L 蔗糖时,叶状体相对增殖率最高,平均为1362.6%。当培养基中蔗糖用量30 g/L 时,明显不利于叶状体的生长增殖。对比各处理,蔗糖用量以20 g/L 的MS 显著优于其他处理,表现更适宜叶状体的生长增殖,同时也说明养分浓度与碳源的合适搭配能获得更好的生物量。
3.4 叶状体培养物中累积石杉碱甲的TLC
采取TLC 检测不同培养基中培养的叶状体抽提物,以石杉碱甲标准品和接种的母株干粉抽提物为对照TLC 检测,试验了不同的展开剂效果,筛选出氯仿/丙酮/异丙醇/氨水(4∶4∶2∶0.1,v/v/v/v)层析效果好,测得石杉碱甲标准品Rf=0.39,接种的母株和不同培养基中培养的叶状体的抽提物中均出现与标准品相同的显色斑点Rf=0.39,见图2。证明培养物中能产生与接种母株含有的相同石杉碱甲成分,即存在与石杉碱甲标准品相同的成分。说明本研究获得的叶状体具有产生蛇足石杉有效成分石杉碱甲的能力。

图1 蛇足石杉原植物及其离体培养诱导培养叶状体过程Fig.1 H.serrata in wild and the progress of the thallus induction in vitro culture

图2 蛇足石杉离体叶状体提取物与石杉碱甲标准品、原植株提取物对照的TLCFig.2 The TLC test of extract of the wild H.serrata and thallus in vitro culture,Huperzine A standard
3.5 叶状体培养物中累积石杉碱甲的HPLC
在色谱条件下检测的图3,其中D 石杉碱甲标准品的出峰时间为10 min 左右,最大吸收波长为308 nm。以1、2、3 μg/mL 标准品的浓度为横坐标,面积为纵坐标,测得的线性关系为y=149987x-87338,r=0.9957;E 为培养物样品HPLC 色谱图,相同条件下10 min 左右有一个吸收峰,亦说明了石杉碱甲在培养物中累积,E 和D 说明样品中异型结构分子复杂多样,可预知Huperzine A 的培养调控具较大的潜力。
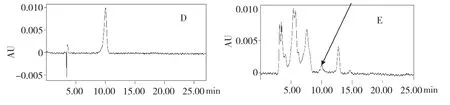
图3 蛇足石杉离体叶状体培养物提取物及石杉碱甲标品的HPLCFig.3 The HPLC test of extract of thallus in vitro culture and Huperzine A standard
4 讨论
国内有多个实验室开展了蛇足石杉的组织培养,但蛇足石杉组织培养再生叶状体仅笔者实验室成功。沈晓霞等人对千层塔茎尖组织培养灭菌方法的研究,经过多种灭菌方法的摸索和比较,发现千层塔茎尖外植体的灭菌十分困难,并且外植体在光照培养4~5 d 后都发白死亡,无法继续培养。只有在暗培养的条件下,茎外植体才保持嫩绿,在含有5 mg/L 2,4-D 和1 mg/L KT 的MS 基本培养基上培养诱导,2 个月后长出褐色的愈伤组织,以后停止生长[13]。周颖等人报道蛇足石杉茎尖组织培养过程中,虽然已经采取多种灭菌措施,仍然会被污染[14]。杨雪飞等采用表面灭菌和内生菌杀灭相结合的方法使外植体的无菌率达到52%,但分化率较低[15]。孙玉强等离体培养千层塔外植体建立了愈伤组织,但生长速度慢[16]。总结蛇足石杉茎外植体的组织培养的突出问题是:①外植体消毒困难;②再分化率低;③培养物生长慢,组织培养体系较难建立。
本研究解决了外植体的表面消毒问题,建立了再分化器官叶状体的无性繁殖系。在植物次生代谢工程中,利用快速增殖的分化器官培养物生产天然有效成分,具有较稳定的表达特征,例如以培养毛状根生产中草药有效成分的策略。因此本研究建立的叶状体器官用于大规模培养生产石杉碱甲也可能表达较稳定,尤其该叶状体增殖率高,或可成为次生代谢工程最好的体系之一。本研究将进一步筛选高产石杉碱甲的叶状体培养系,为大规模蛇足石杉次生代谢工程生产石杉碱甲迈上更高台阶,具有重要的科学意义和应用价值。
1 Wang YE(王月娥),Yue DX(岳冬贤),Tang XC(唐希灿).Inhibition of Huperzine A on Acetylcholine Esterase.Acta Pharm Sin(中国药理学报),1986,7:110-113.
2 Yuan SQ(袁珊琴),Feng R(冯锐),Gu GM(顾国明).Study on the alkaloids of Huperzia Serrata(Thunb.).Bull Acad Mil Med Sci(军事医学科学院院刊),2001,25(1):57-58.
3 Liu XL(刘小林),Cheng CR(程春荣),Cao W(曹威),et al.Advances in studies on pharmacological effecta of Huperzia serrata and clinical application.Her Med(医学导报),2006,2(25):90-95.
4 Zeng FX(曾繁星),Jiang HL(蒋华良),Yang YS(杨玉社),et al.Progress in synthesis and structural modification of Huperzine A.Proc Chem(化学进展),2000,12:63-76.
5 Chen WP(陈卫平),Yang FQ(杨福秋).Asymmetric total synthesis of optically active Huperzine A.China J Med Chem(中国药物化学杂志),1995,5:10-17.
6 Yu HY(余红英),Sun YM(孙远明),Yang YJ(杨跃进).Advances in studies on Huperzia Serrata.Chin Tradit Herb Drugs(中草药)2001,32:279-281.
7 Ma XQ,Gang DR.In vitro production of Huperzine A,a promising drug candidate for Alzheimers’s disease.Phytochemistry,2008,69:2022-2028.
8 Tu YS(涂艺声).Rapid Mass Propagation Techniques of Economic Plants(经济植物大规模快速繁殖技术).Beijing:Chemical Industry Press,2009.281-282.
9 Tu YS(涂艺声),Jiang HR(江洪如),Wang BQ(王碧琴).Cultures of callus and cell suspension of Sarcandra Glabra for the production of medicinal component.Nat Prod Res Dev(天然产物研究与开发),1995,7:35-41.
10 Wang J(王峻),Wu W(吴伟),Pan SL(潘胜利).Determination of huperzine A in six plants of Huperziaceae.Chin Tradit Herb Drugs(中草药),2003,34:607-608.
11 Zhou HH(周汉华),Jia XS(贾宪生),Gao YM(高言明),et al.Determination of Huperzine A in Huperzia crispate Ching by TLC scanning.J Chin Med Mat(中药材),2008,31(2):235-237.
12 Wang S(王姗),Wang M(王沫).Determination of Huperzine A in three species of Huperzia Berm.by HPLC.J Shangluo Univ(商洛学院学报),2012,26(2):38-41.
13 Shen XX(沈晓霞),Yu XP(俞旭平),Sheng SJ(盛束军).Research on tissue culture technology for Huperzia Serrata.China J Chin Mater Med(中国中药杂志),2002,27:458-459.
14 Zhou Y(周颖),Liu X(刘星),Li KG(李克刚),et al.Tissue culture of Huperzia Serrata.J Jishou Univ,Nat Sci(吉首大学学报,自科版),2009,30(2):90-93.
15 Yang XF(杨雪飞),Luo JP(罗建平),Wang Y(王瑛).Studies on culture and sterilization method of Huperzia Serrata.J Anhui Agri Sci(安徽农业科学),2008,36:4947-4948.
16 Sun YQ(孙玉强),Tong JX(童建新),Ruan SL(阮松林),et al.Research on explants of Huperzia Serrata in culture.J Hangzhou Agri Sci Tech(杭州农业科技),2008(4):10-12.

