ISSR和SSR体系优化及在分析不同核桃品种遗传多样性上的应用
翟梅枝,肖志娟,许静,孙宇栋
(西北农林科技大学林学院,陕西 杨凌 712100)
ISSR和SSR体系优化及在分析不同核桃品种遗传多样性上的应用
翟梅枝,肖志娟,许静,孙宇栋
(西北农林科技大学林学院,陕西 杨凌 712100)
对核桃叶总DNA进行提取,筛选出多态性强重复性好的15条ISSR引物和12对SSR引物。利用ISSR和SSR分子标记技术对不同核桃品种遗传多样性进行研究。结果表明,15条ISSR引物共检测到187个条带,其中132个呈多态性,多态性百分比为70.59%,平均每条引物扩增出多态性位点8.8个;不同品种间相似系数变化范围为0.2500~0.7639,多态信息含量(PIC)变化范围在0.7105~0.9151,其值均大于0.5;12对SSR共检测到174个条带,其中118条呈现态性,多态性百分比为67.82%,平均每条引物扩增出多态性位点9.8个,遗传相似系数变化范围为0.1594~0.8036,多态信息含量(PIC)变化范围在0.7422~0.8962,平均值为0.8150,其值均大于0.5。用Mantel检测对两种标记结果进行相关性分析(r=0.6257,P=1),表明本研究中ISSR标记和SSR标记的相关性显著。基于ISSR和SSR综合后数据遗传相似性系数的UPGMA聚类结果表明,在遗传相似系数阈值0.39,可将供试材料分成四大类。研究结果显示,供试材料遗传资源丰富,可作为育种来源。
核桃;ISSR;SSR;体系优化;遗传多样性
核桃属(Juglans)植物约有20多种,分4个组,包括核桃组(Sect.Juglans)、核桃楸组(Sect.Cardiocaryon)、黑核桃组(Sect.Rhysocayon)和灰核桃组(Sect.Trachycaryon)。核桃在中国栽培范围最广,种质资源丰富。由于其在地形、气候等不同生态环境条件下,经长期异花授粉、自然选择和人工杂交,导致其遗传背景复杂多样,不同种质在抗性、丰产性及果实品质和形态特征等方面都存在显著差异。
对核桃种质资源的研究多依靠形态学、细胞学、酶学等手段。近年来,DNA分子标记由于具有多态性高、不受组织类别、发育时期和环境条件影响的优点,越来越多地应用于核桃种质资源研究。吴燕民等用RAPD标记研究核桃属各种之间的亲缘关系[1]。徐郑利用AFLP技术和RAPD技术分析秦巴山区及四川西部高原核桃遗传多样性,认为核桃类群遗传多样性丰富,遗传结构复杂。王正加等用RAPD技术对90个来自3个大别山山核桃单株的种群间和种群内的遗传变异及遗传多样性进行研究,认为山核桃种群内有较丰富的遗传资源[2]。国外学者利用形态学、等位酶及RFLP标记对欧洲及亚洲的核桃居群分析比较[3-5]。ISSR和SSR是近年发展起来的分子标记技术。Daniel等用ISSR标记技术,通过计算遗传距离用Neighborjoining方法绘制美国南部黑核桃组48个品种的树状遗传关系图并分析其亲缘关系[6]。Pollegioni等利用ISSR、SSR和RAPD技术分析意大利维琴察市的天然杂交种、黑核桃和核桃的遗传多样性[7]。王滑等利用SSR标记揭示我国核桃和铁核桃天然居群的遗传多样性及遗传结构,为其遗传资源保护、可持续利用和遗传改良提供科学依据[8]。本研究运用ISSR和SSR分子标记对西北农林科技大学核桃资源圃内的18份核桃材料进行遗传多样性和亲缘关系分析,以期为杂交育种中亲本选择及种质创制提供理论依据。
1 材料与方法
1.1 材料的采集和处理
2012年4 月初,采集西北农林科技大学核桃资源圃内18个核桃材料的嫩叶(见表1),低温冷藏带回实验室,放入-80℃冰箱中保存待用。
1.2 试验方法
1.2.1 DNA提取与检测
采用改良的CTAB法提取DNA,并用RNA酶对其纯化。用分光光度计和1%琼脂糖凝胶电泳法检测DNA浓度与质量。获得浓度和纯度符合要求的DNA,将其稀释至100 ng·μL-1,存于-20℃备用。
DNA质量浓度(ng·μL-1)=A260×50×稀释倍数
1.2.2 引物的筛选和退火温度的确定
通过查阅文献得到31条ISSR引物,27对SSR引物[9],皆由上海英潍捷基生物技术有限公司合成。选用西洛3号、绿香和艺核1号3个品种对合成的31条ISSR引物和27对SSR引物进行扩增,分别筛选出扩增条带稳定、清晰且多态性好的ISSR引物和SSR引物,确定各引物退火温度。
1.2.3 PCR扩增反应和电泳检测
ISSR-PCR反应扩增程序为:94℃预变性5 min;94℃变性30 s,40~56℃退火30 s,72℃延伸60 s,32个循环;72℃后延伸10 min,最后4℃保存。SSR-PCR反应扩增程序为:94℃预变性3 min;94℃变性30 s,45°C退火30 s,72℃延伸45 s,30个循环;72℃后延伸5 min,最后4℃保存。
ISSR引物扩增的产物采用2%琼脂糖凝胶电泳检测:取5 μL PCR扩增产物与1 μL 6×Loading buffer混匀后上样,用1×TBE电泳缓冲液,在恒定120 v电压下电泳2 h,放入EB中染色10 min后,用凝胶成像系统进行照相。SSR引物扩增产物采用8%聚丙烯酰胺凝胶电泳检测:250 v预电泳30 min后,在5 μL PCR扩增产物中加入1μL 6× Loading buffer,混匀后上样,用1×TBE电泳缓冲液,在恒定250 v电压下电泳3 h,用1%硝酸银染色后,再经过15%NaOH显色拍照。
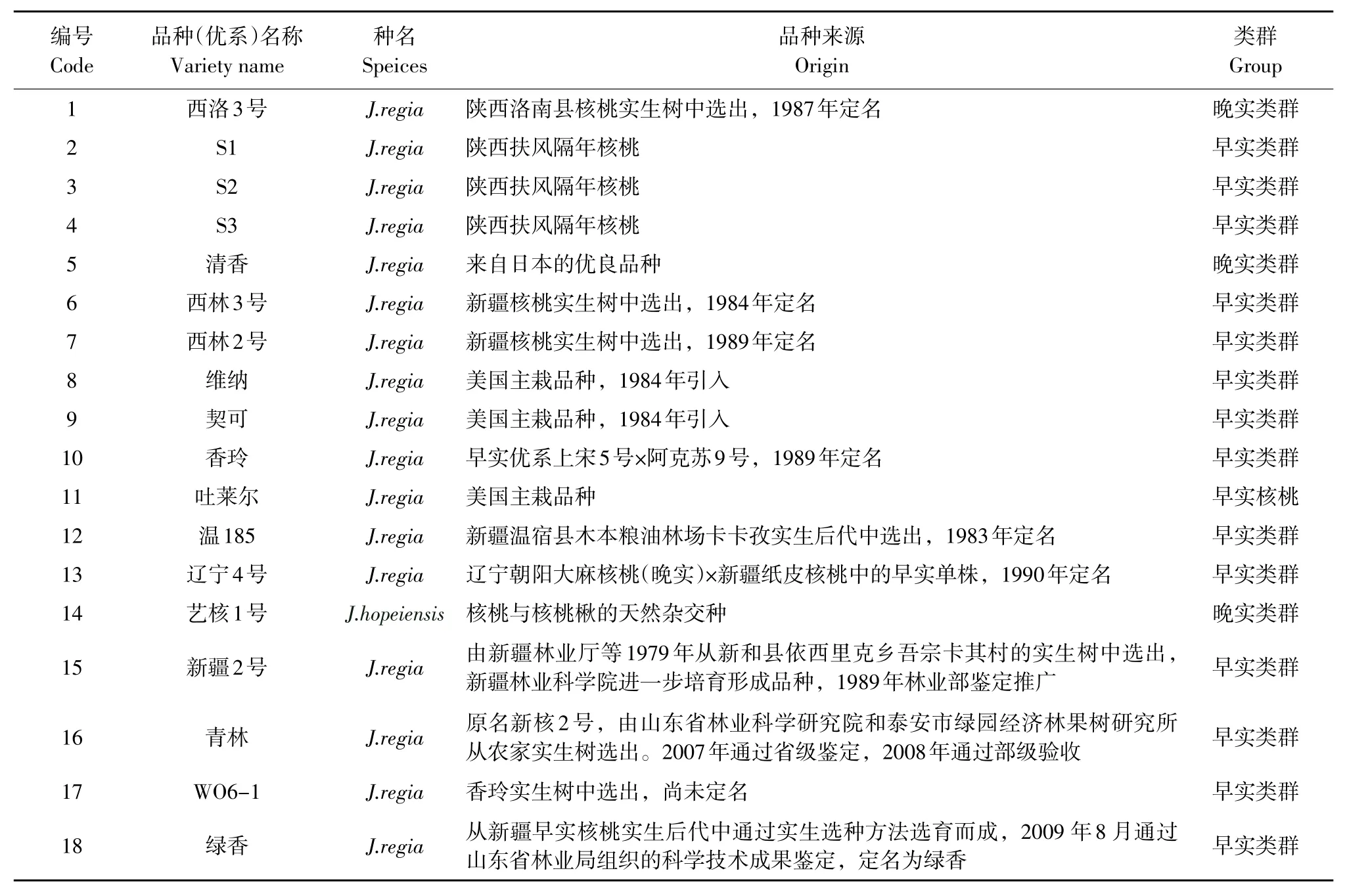
表1 供试核桃品种名称及来源Table 1 Name and origin of walnuts variety collected in this study
1.2.4 PCR反应体系的正交试验
体系优化采用L16(45)正交设计,5个因素为Mg2+、dNTP、Taq酶、引物浓度、模板DNA,共16个反应体系。试验设计见表2。由于PCR反应体系中各个因素,如Mg2+、Taq酶、dNTP、模板DNA和引物浓度直接影响到扩增效率,进而影响试验结果,因此有必要对反应体系进行优化。用20 μL的反应体系,Buffer均为2 μL,不足20 μL ddH2O补足,重复3次。ISSR和SSR反应体系见表3、4。
1.2.5 数据分析
以DM2000为标准,同一个引物扩增后,经过电泳,凝胶上同一位置上的条带可认为属于同一位点且具有同源性,每个条带视为一个标记[10]。故根据条带的有无记录数据,有条带的记录1,无条带的记录0,经NT-SYSpc2.1[11]软件分析得出遗传相似系数(GS)和树状图。
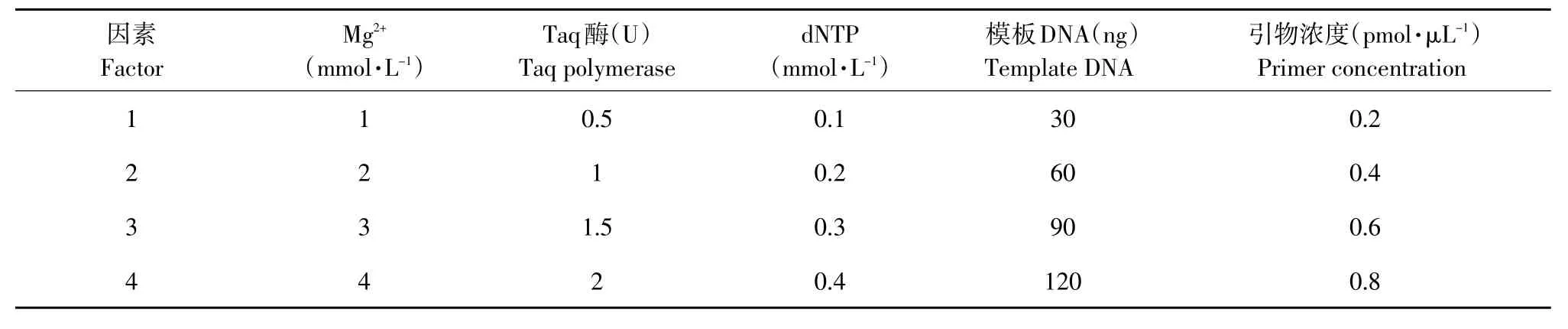
表2 PCR反应体系中处理因素和水平Table 2 Levels and factors of PCR reaction system treatments

表3 ISSR最佳反应体系(20 μL)Table 3 Optimum system of ISSR(20 μL)

表4 SSR最佳反应体系(20 μL)Table 4 Optimum system of SSR(20 μL)
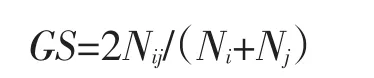
式中,Ni为供试样品i中出现的扩增片段个数,Nj为供试材料j中出现的扩增片段个数,Nij为供试材料i和j共有的扩增片段个数。用SAHN程序中的UPGMA方法进行聚类分析。
多态信息含量(Polymorphism information content,PIC)[12]是表示DNA变异程度的指标,反应DNA多态高低,位点的PIC值均大于0.50,表明具有较高的多态信息量,在核桃组内遗传分析中有广泛的应用价值。当PIC值>0.5时,标记具有高度可供信息性;0.50>PIC>0.25时,标记能够较合理的提供信息;PIC值<0.25时,标记可供信息性差。其计算公式如下:
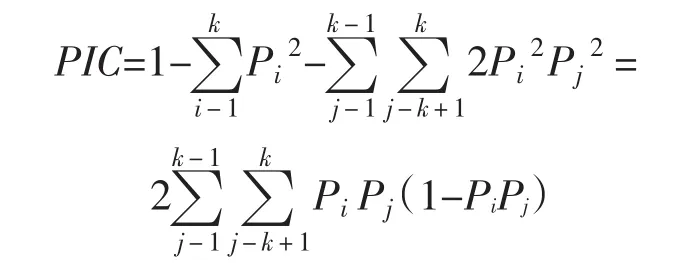
式中,Pi、Pj分别为群体中第i、j个等位基因频率,n为等位基因数。
用TFPGA软件里的Mantel-test对ISSR和SSR两种分子标记的遗传相似系数进行相关性检测。
2 结果与分析
2.1 ISSR优化体系的建立及应用
用筛选出来的15条引物对18个供试材料进行扩增,把在凝胶上有同一迁移率的条带作为一个同源位点,ISSR共检测到187个条带,其中132个条带呈现多态性,多态百分比为70.59%,其中扩增多态性位点数最少的是ISSR812和ISSR844引物,均为6条;最多的是ISSR14引物,为17条。平均每条引物扩增出多态性位点8.8个,分子质量100~2 000 bp。不同供试材料间相似系数变化范围0.2500~0.7639,多态信息含量(PIC)变化范围在0.7105~0.9151,其值均大于0.5,说明ISSR的15条引物扩增位点均表现出高度多态,15条ISSR引物特征及扩增结果见表5。由表5可知,所筛选的15条ISSR引物退火温度除ISSR12和ISSR844,其他引物退火温度都在50~55℃。较高的退火温度,增强了试验的可重复性[13]。
引物ISSR841扩增后电泳图谱见图1。
2.2 SSR优化体系的建立及应用
用筛选出的12对SSR引物对18个供试材料进行扩增,扩增产物的片段大小大多在100~500 bp之间。SSR共检测到174个条带,其中118条呈现多态性,多态百分比为67.82%,引物WGA33扩增的条带数最多,为17条;引物ZMZ44次之,为15条。引物WGA82、ZMZ31和ZMZ45扩增谱带数最少,均为6条。平均每条引物扩增出多态性位点9.8个,遗传相似系数0.1594~0.8036,多态信息含量(PIC)变化在0.7422~0.8962,平均值为0.8150,其值均大于0.5,说明SSR的12对引物扩增位点均表现出高度多态性(见表6)。
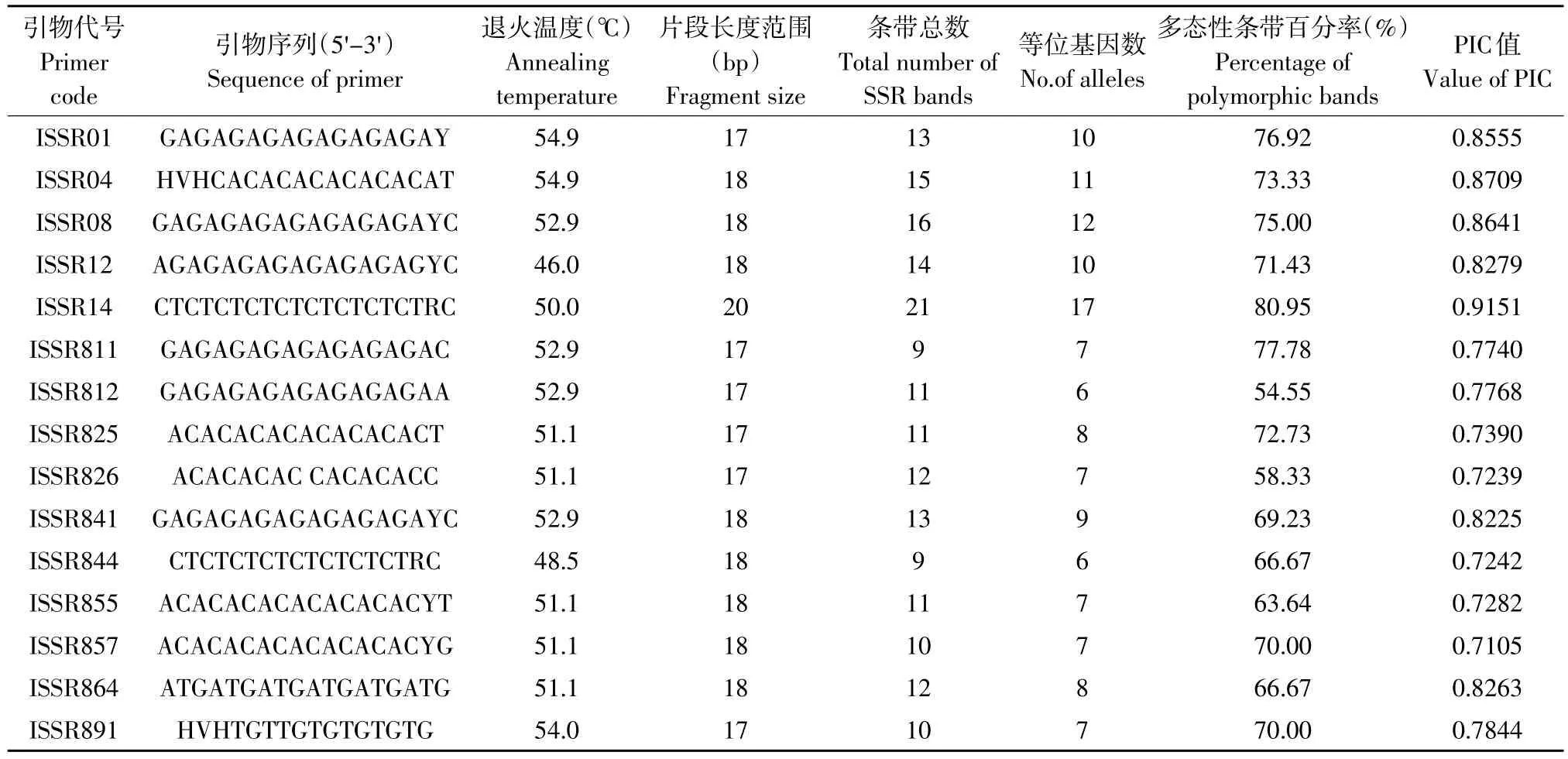
表5 15条ISSR引物的特征及扩增结果Table 5 Characteristics of 15 pairs of ISSR primers and PCR results
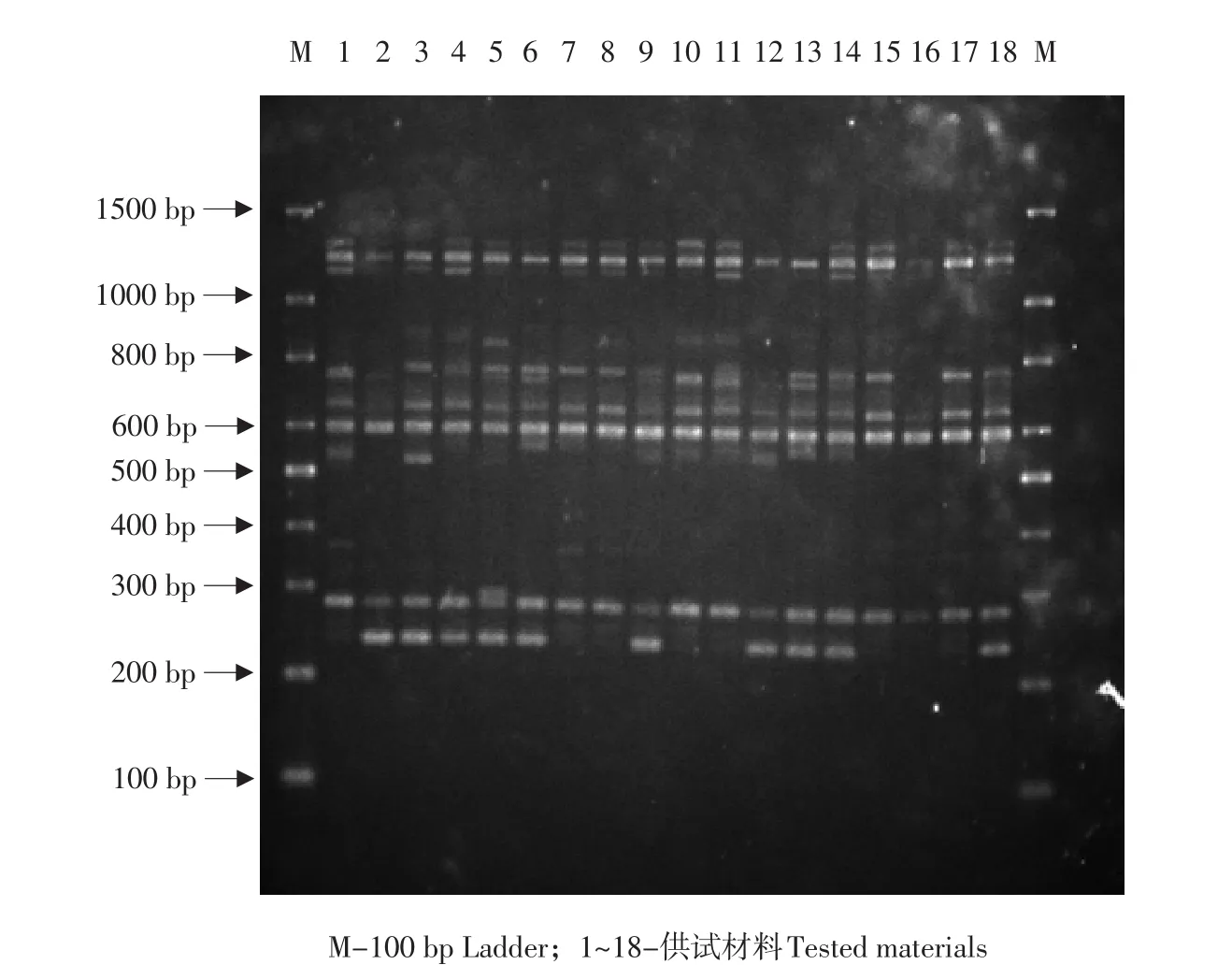
图1 ISSR引物841对18份供试材料的扩增电泳Fig.1 Electrophoresis pattern amplified from 18 tested materials with ISSR primer 841
对SSR的27对引物进行退火温度的探索,用PCR仪的梯度功能,在40~56℃内8个梯度进行扩增,各个引物的Tm均包含在其中。选用形态差异大的西洛3号,艺核1号和绿香3个核桃品种进行扩增试验(见表6)。由表6可知,基于SSR的引物采用不同的退火温度进行扩增后,结果表明差异不明显,因此均采用45℃进行后续试验。
引物ZMZ31扩增后的电泳图谱见图2。
2.3 ISSR和SSR数据综合后的遗传相似系数分析
18个供试材料间的遗传相似系数见表7。由表
7可以看出,18个供试品种(优系)中,实生类型的优良株系间相似系数最大。实生优系2和3的相似系数达0.8889,实生优系1和2、3的相似系数分别达0.7789、0.8454。在供试的15个优良品种中,吐莱尔与实生优系的相似程度最大。吐莱尔与实生优系1、2、3的相似系数分别为0.7237、0.7802、0.7917,故推断吐莱尔与3个实生优系亲缘关系较近。品种间西林3号和清香之间的遗传相似系数最大,为0.7698;W06-1和艺核1号之间的遗传相似系数最小,为0.2642。综上可知,18个供试核桃品种(优系)遗传多样性丰富,可作为育种材料进行杂交育种和新种质创制。
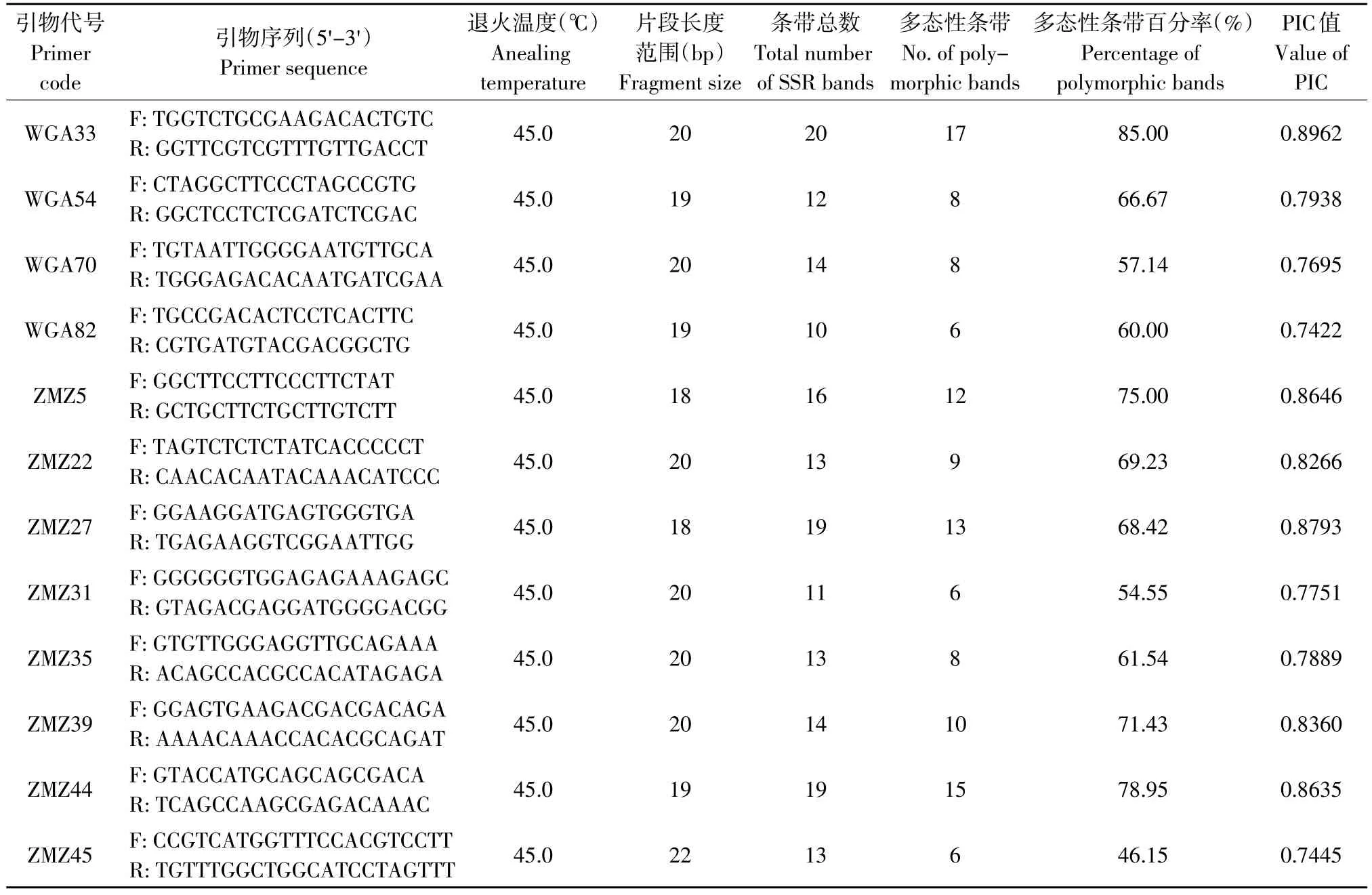
表6 参试12对SSR引物的特征及扩增结果Table 6 Characteristics of 12 pairs of SSR primers and PCR results

图2 引物ZMZ31对18份供试材料的ISSR扩增电泳Fig.2 Electrophoresis pattern amplified from 18 tested materials with primer ZMZ31

表7 基于ISSR和SSR的供试样品的相似系数Table 7 Genetic similarity of 18 walnuts aeeessions based on ISSR and SSR
2.4 ISSR和SSR综合聚类分析
用软件NSTYS-PC进行数据分析,计算出18个供试材料的遗传相似系数,利用不加权成对算术平均法(UPGMA)对供试材料进行聚类分析得到树状图(见图3)。NSTYS-PC数据分析显示,树状图的r值为0.8332,在0.8~0.9之间,说明此进化树符合较好。在遗传相似系数阈值0.39可将供试材料分成4大类。第1类:12个,分别为西林2号、西林3号、辽宁4号、新疆2号、香玲、S1、S2、S3、吐莱尔、温185、西洛3号和清香;第2类:2个,分别为维纳、契可,均来自美国;第3类:3个,W06-1,青林和绿香,均来自山东;第4类:1个,艺核1号,为文玩核桃,与普通栽培品种差异较大,故单独列为一组。
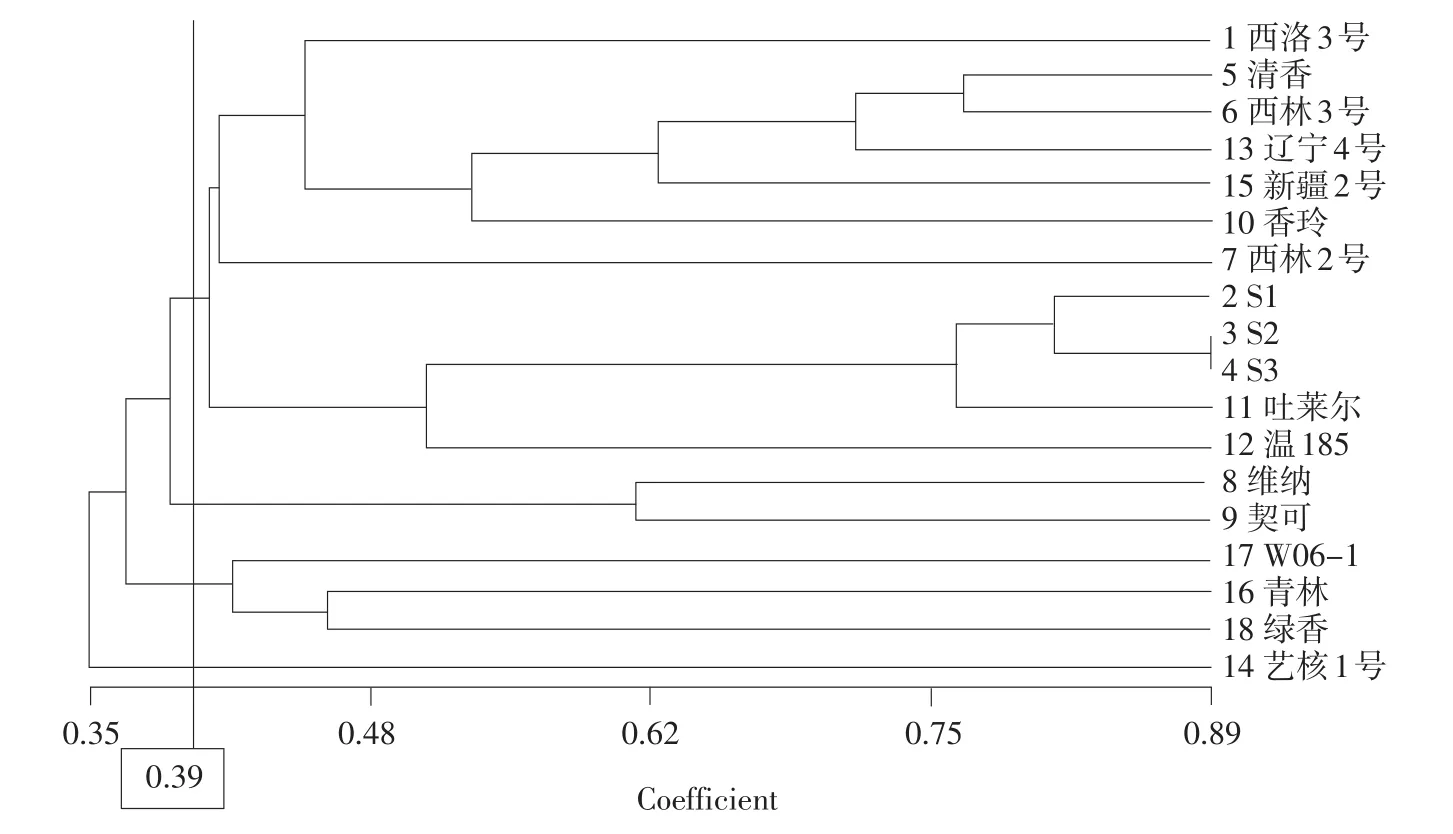
图3 18个核桃品种(优系)的遗传多样性树状图Fig.3 Dendrogram of 18 walnut varieties based on ISSR genetic similarity
3 讨论与结论
3.1 ISSR和SSR标记PCR比较
比较优化的ISSR和SSR标记扩增程序,其中扩增的循环数和退火温度是影响PCR的主要因素。ISSR和SSR引物长度相当,但ISSR退火温度一般在46.0~54.9℃,而SSR退火温度一般在45℃。退火温度ISSR比SSR高很多,错配较少。ISSR和SSR分子标记的循环数相近,分别是32个循环和30个循环,均可扩增出清晰明亮的条带,循环数多将增加错误掺入的几率。
3.2 ISSR和SSR标记结果一致性分析
对两者相似系数矩阵的相关性进行Mantel检验(r=0.6257,P=1)。结果表明,两种标记方法相关性显著,但并不完全一致,造成ISSR和SSR标记结果差异的原因多种多样,与两种标记方法的多态性检测位点未能覆盖全基因组有关,ISSR和SSR两种分子标记的原理不同,揭示的基因组范围不同,不同标记得出不同的遗传相似系数。以多种分子标记及形态学标记相结合的手段,对目标植物进行遗传多样性研究,可得到更为准确的结果。
[1]吴燕民,裴东,奚声珂.运用RAPD对核桃属种间亲缘关系的研究[J].园艺学报,2000,27(1):17-22.
[2]王正加,黄有军,郭传友.大别山山核桃种群遗传多样性研究[J].植物生态学报,2006,30(3):534-538.
[3]Malvolti M E,Fineschi S,Pigliucci M.Morphological integration and genetic variability inJuglansregia L.[J].J Hered,1994,85: 389-394.
[4]Malvolti M E,Paciucci M,Cannata F,et al.Genetic variation in Italian populations ofJuglansregia L[J].Acta Hortic,1993,311: 86-94.
[5]Fjellstrom R G,Parfitt D E.Walnut(Juglansspp.)genetic diversity determined by restriction fragment length polymorphisms[J]. Genome,1994,37:690-700.
[6]Daniel,Fangyou-Gao,Bagget,et al.Defining the sources of Paradox:DNA sequence markers for North American walnut (Juglans.regia L.),species and hybrids[J].Scientia Horticulturae, 2002(12):157-170.
[7]Pollegioni P,Major A,Bartoli S,et al.Application of microsatellite and dominant molecular markers for the discrimination of species and interspecific hybridsingenusJuglans[J].Acta Horticulturae Sinica,2005,705:191-199.
[8]王滑,郝俊民,王宝庆.中国核桃8个天然居群遗传多样性分析[J].林业科学,2007,43(7):120-124.
[9]Woeste K,Rhodes R B O,Michler C.Thirty polymrophicnuclear microsatellite loci from black Walunt[J].The Journal of Heredity, 2002.93:58-60.
[10]AiC X,Li G T,Zhang L S,et al.Study on the Genetic Diversity of Natural Chestnut Population sin Shandong Chinaby SSR Markers [J].Acta Hort,2009,844:257-266.
[11]RohlF F J.NTSYS-pc numerical taxonomy and multivariate analysis system,version 2.1[M].New York:Exeter Pub,2000.
[12]Bostein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].Am J Hum Genet,1980,32:314-331.
[13]杜娟,南宫自艳,周国娜.美国白蛾SSR反应体系的优化与初步应用[J].林业科学,2010,46(3):173-177,29.
[14]刘晓丽,何天明,张美勇.核桃SSR反应体系的优化[J].果树学报,2007(2):140-145.
ISSR and SSR system optimization and application on genetic diversity analyzing of walnut
ZHAI Meizhi,XIAO Zhijuan,XU Jing,SUN Yudong
(School of Forestry,Northwest Agriculture and Forestry University,Yangling Shaanxi 712100,China)
In this study,ISSR and SSR molecular marker technologies were selected to analyze the genetic diversity of different walnut varieties to provide a theoretical basis for the future development of new varieties and germplasm innovation.Total 15 ISSR primers and 12 SSR primers with good repeatability and strong polymorphism were screened and the PCR optimum system was set up.ISSR molecular mark detected 187 bands,of which 132 were polymorphism bands,accounting for 70.59%, and the number of the polymorphic loci of each primer averaged 8.8.The similarity coefficient ranged from 0.2500 to 0.7639.Polymorphic information content(PIC)ranged from 0.7105 to 0.9151,and each value was greater than 0.5.SSR molecular mark detected 174 bands,of which 118 were polymorphism bands,accounting for 67.82%,and the number of the polymorphic loci of each primer averaged 9.8.The similarity coefficient ranged from 0.1594 to 0.8036.Polymorphic information content(PIC)ranged from 0.7422 to 0.8962,and each value was greater than 0.5.Mantel test was used to analyse correlation of ISSR and SSR(r=0.6257,P=1),indicated that ISSR markers and SSR markers in this study was consistent.Cluster analysis with UPGMA method showed that the samples could be divided into four groups.It showed that the genetic resources of these samples were very rich,and could be used as breeding source.
walnut;ISSR;SSR;system optimization;genetic diversity
S664.1
A
1005-9369(2014)01-0090-08
2013-07-18
公益性行业科研专项(201004027);陕西省科技统筹创新工程计划(2012KTZB02-01)
翟梅枝(1963-),女,教授,博士,硕士生导师,研究方向为经济林及其资源利用。E-mail:plum-zhai@163.com
时间2014-1-10 6:28:40[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140110.0628.005.html
翟梅枝,肖志娟,许静,等.ISSR和SSR体系优化及在分析不同核桃品种遗传多样性上的应用[J].东北农业大学学报,2014,45 (1):90-97.
Zhai Meizhi,Xiao Zhijuan,Xu Jing,et al.ISSR and SSR system optimization and application on genetic diversity analyzing of walnut[J].Journal of Northeast Agricultural University,2014,45(1):90-97.(in Chinese with English abstract)

