响应面法优化酶-超声波辅助同步提取紫薯花青素工艺
张 慢,潘丽军,2,,姜绍通,2,莫玉稳
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
响应面法优化酶-超声波辅助同步提取紫薯花青素工艺
张 慢1,潘丽军1,2,*,姜绍通1,2,莫玉稳1
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
为提高紫薯花青素得率,采用酶-超声波辅助同步对紫薯花青素的提取效果进行研究。通过Box-Behnken试验设计和响应面分析确定酶-超声波辅助提取最佳工艺条件:体积分数0.1%的HCl-C2H5OH为溶剂(酸醇比为50:50),纤维素酶提取温度51 ℃、料液比1∶20、酶添加量54 U/mL、超声功率100 W、时间33 min,此条件下花青素得率可达到(3.581±0.016)‰。酶-超声波辅助提取法与传统的有机溶剂浸提法相比,缩短了提取时间,花青素得率提高了2.73 倍;与微波法、超声波法相比,花青素得率分别提高了32.4%和17.8%。
紫薯;花青素;纤维素酶;超声波;响应面法
目前,随着全球范围内消费者对饮食与健康之间关系关注的日益加剧及对人工合成色素危害性的认识,天然色素的研发与使用成为世界食品工业发展的新趋势。与合成色素相比,天然色素一般从植物中提取出来,其优势在于:对人体无毒害,安全性高;能更好地模仿天然物颜色,色调比较自然;部分天然色素具有生理活性及保健作用。而紫薯中所含有的花青素是一种天然食用水溶性红色素。
花青素是一类广泛存在于自然界植物中的水溶性天然色素,因其食用安全、色泽鲜亮自然、无特殊气味,且兼具抗氧化[1]、保护肝脏[2-3]、抗突变[4]、降血脂[5]等保健功能[6],受到广泛关注。紫薯花青素是从紫薯的茎叶或块根中提取出来的一种水溶性的天然花青素类红色素。有研究表明,紫薯花青素较其他同类花青素,如葡萄花青素、李花青素和黑米花青素的理化性质稳定,且具有显著的生物学活性[7]。
紫薯花青素主要提取方法包括溶剂浸提法、酶水解法、树脂法、超声波萃取法、微波萃取法、超滤法、吸附精制法等[8-11]。目前,国内对紫薯花青素的提取主要采用传统的有机溶剂浸提法,但该方法存在提取时间长、产率低、产品稳定性差等缺陷。研究[12-14]表明,将超声波技术应用于天然活性成分的提取具有明显的优势。超声波技术是利用超声辐射压强产生的强烈空化、扰动效应,高加速度的击碎和搅拌等综合作用,增大物质分子运动频率和速度,增强溶剂穿透力,从而加速活性成分渗出,有效缩短提取时间,提高提取得率[15]。酶解法[16]主要是利用纤维素酶、果胶酶等对植物细胞进行破壁,以利于有效成分最大限度的溶出。本实验采用酶-超声波法对紫薯花青素的提取效果进行研究,通过Box-Behnken试验设计和响应面分析,获得最佳提取工艺条件,为紫薯花青素的生产以及紫薯资源的综合利用提供参考依据。
1 材料与方法
1.1 材料与试剂
新鲜无霉变的块状紫薯 市购;乙醇、浓盐酸、正丁醇、硫酸铁铵(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FZ102型植物组织粉碎机 天津市泰斯特仪器有限公司;202-1型电热恒温干燥箱 上海浦东荣丰科学仪器有限公司;AR1140/C型电子天平 上海奥豪斯公司;Hei-VAP Value型旋转蒸发器 上海申胜生物技术有限公司;JK-300DUB型三频数控超声波清洗器 合肥金尼克机械制造有限公司;721分光光度计 上海精密科学仪器有限公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;TU-1901型双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 紫薯花青素的提取及工艺优化
新鲜的紫薯洗净,去除病虫害部分,切成条状,置于50 ℃烘箱中烘制12 h,粉碎后过100 目筛,将筛出的紫薯粉放置到干燥器中避光保存,备用。
以紫薯为原料,体积分数为0.1%的HCl-C2H5OH为溶剂(酸醇比为50:50),在料液比为1:10(g/mL)时,按照100 U/mL用量加入不同的酶(α-淀粉酶、纤维素酶、果胶酶、中性蛋白酶),于200 W、40 ℃的超声波清洗机中提取30 min,提取过后以5 000 r/min的转速离心15 min,取上清液浓缩,55 ℃条件下旋转蒸发除去乙醇,定容后测定紫薯花青素粗提液的吸光度,计算紫薯花青素的得率。
在单因素试验的基础上,以紫薯花青素得率为响应值,确定Box-Behnken响应面设计的因素为提取温度、提取时间、液料比、酶添加量。根据Box-Behnken试验设计原理,采用响应面分析法对酶-超声波辅助同步提取的工艺参数进行优化,获得最优提取条件。每组试验重复3 次,结果取其平均值。设计的四因素三水平组合试验的各因素水平编码见表1。

表1 Box-Behnken试验设计因素水平编码表Table1 Experimental variables and levels for Box-Behnken design
1.3.2 紫薯花青素最大吸收波长的确定
准确移取提取液稀释适当倍数,以体积分数为0.1%的HCl作参比液,于双光束紫外-可见分光光度计在波长200~600 nm范围内进行全波长光谱扫描,确定其最大吸收峰。
1.3.3 花青素含量的测定
1.3.3.1 标准曲线的绘制
准确配制0.50 mg/mL的原花青素标准溶液(称取原花青素标准品5.00 mg溶于CH3OH中,定容至10 mL),吸取0、0.1、0.2、0.3、0.4、0.5 mL分别置于6支10 mL具塞试管中,各加入甲醇溶液至1.0 mL,加入9.0 mL反应混合液(反应混合液:取C4H10O、浓HCl、质量分数为10%的 NH4Fe(SO4)2•12H2O体积比为83:6:1混合均匀。质量分数为10%的NH4Fe(SO4)2•12H2O:称取10.0 g NH4Fe(SO4)2•12H2O,用2 mol/L HCl溶解定容至100 mL),塞紧塞子,摇匀,置于沸水浴中加热40 min后,立即取出用冰水冷却4~5 min,取出,恢复至室温后(约15 min),于最大吸收波长处以试剂空白调零,测定其吸光度[17]。
1.3.3.2 样品中花青素得率的测定
取1.0 mL定容后的紫薯花青素的浓缩液,按标准曲线绘制方法测定其吸光度值,根据回归方程计算样品中紫薯花青素的浓度,按照下式获得样品中紫薯花青素的得率。
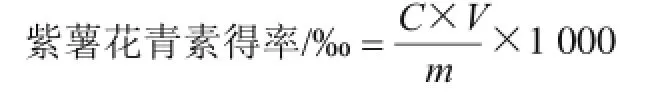
式中:C为紫薯花青素质量浓度/(mg/mL);V为溶液体积/mL;m为样品质量/g。
1.3.4 单因素试验
以紫薯为原料,体积分数为0.1%的HCl-C2H5OH为溶剂(酸醇比为50:50),在料液比1:10(g/mL)、40℃时,按照100 U/mL的用量加入纤维素酶,于100 W超声波清洗器中提取30 min,固定其他因素,考察单一因素对紫薯花青素得率的影响。
1.4 数据处理
单因素试验结果采用Excel中单因素方差分析,Box-Behnken响应面试验设计采用Design-Expert 8.0软件分析。
2 结果与分析
2.1 紫薯花青素提取液的吸收光谱
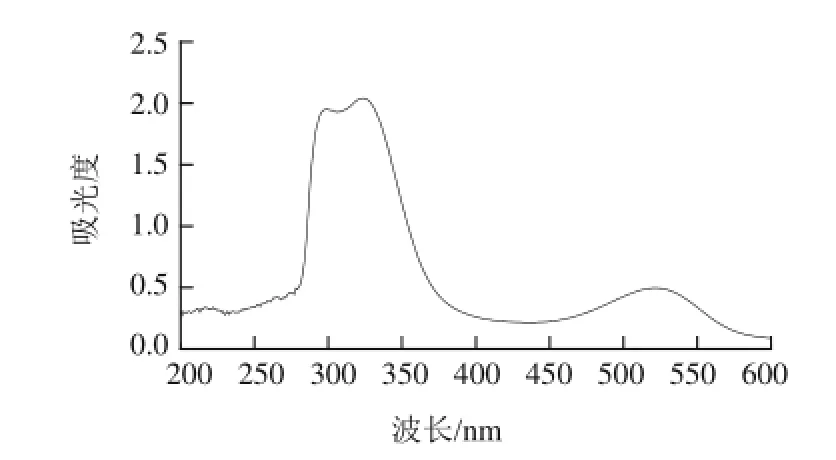
图1 紫薯花青素光谱扫描图Fig.1 UV spectrum of anthocyanins from purple sweet potato
由图1可知,紫薯花青素有3 个峰,分别在300、325、520 nm左右。其中300 nm为多酚类物质羟基的特征吸收峰,325 nm为有机酸类物质羧基的特征吸收峰,520 nm为花色苷类物质的特征吸收峰[18]。由于花青素具有特征性很强的C6—C3—C6碳骨架和相同的生化合成来源,因此人们也将花青素视为黄酮类化合物。但花青素因强烈吸收可见光而区别于其他天然黄酮类化合物[19],故可以选择520 nm作为花青素的最大吸收波长。在此波长下的吸光度可视为花青素的吸光度。
2.2 标准曲线制作
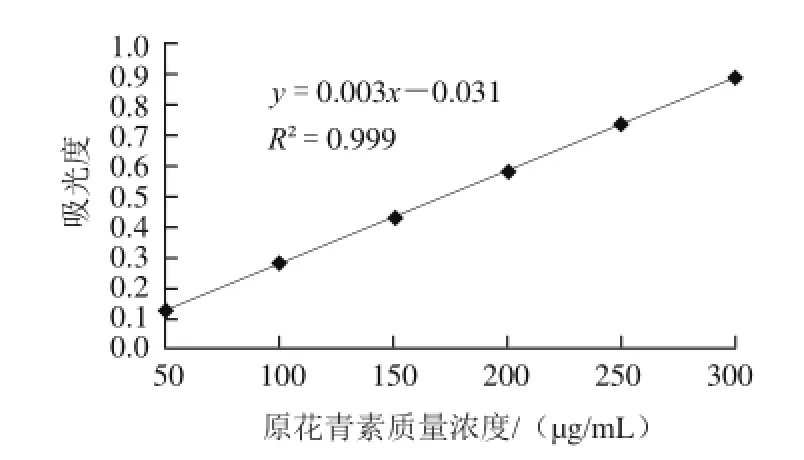
图2 原花青素标准曲线Fig.2 Standard curve of proanthocyanidins
线性回归分析吸光度(Y)与原花青素质量浓度X/(μg/mL)的回归方程为:Y=0.003X-0.031,相关系数R2=0.999,线性范围50~300 μg/mL。
2.3 单因素试验
2.3.1 酶的选择试验
由图3可知,加入酶后,紫薯中花青素的提取得率增加。其中,纤维素酶使花青素的得率增加显著,果胶酶和中性蛋白酶作用较弱,花青素提取得率提高不明显。紫薯植物的细胞壁是由纤维素构成的,植物的有效成分往往包裹在细胞壁内,纤维素酶是复合酶,能够水解纤维使植物细胞壁破坏,充分释放细胞内含物,加速花青素的释放。紫薯中淀粉的含量很多,但α-淀粉酶对紫薯花青素的提取效果低于纤维素酶;紫薯中果胶和蛋白质的含量相对很少,使果胶酶和中性蛋白酶的作用不明显。因此,选择纤维素酶进行紫薯花青素的提取试验。

图3 不同种类的酶对花青素得率的影响Fig.3 Effect of enzyme type on the yield of anthocyanins

图4 提取温度对花青素得率的影响Fig.4 Effect of extraction temperature on the yield of anthocyanins
2.3.2 提取温度对花青素得率的影响
由图4可知,花青素的得率随温度的升高而增加,当温度达到50 ℃时,紫薯中花青素的得率达到最大,当温度继续升高时,花青素的得率反而减少。因为在最适合的温度条件下酶促反应速度最快,在较低温度下,底物的分子热能较低,酶促反应速度慢,当温度过高时,酶易变性失活。因此,纤维素酶的提取温度选取50 ℃较为适宜。
2.3.3 提取时间对花青素得率的影响

图5 提取时间对花青素得率的影响Fig.5 Effect of extraction time on the yield of anthocyanins
由图5可知,花青素的提取得率随着提取时间的延长而增加,并在30 min时达到最大,之后基本上保持不变。因为纤维素酶与底物的作用需要一定的时间,当酶促反应充分发生后,酶的效率得到充分利用,继续增加时间,花青素的提取不再增加。因此,纤维素酶的提取时间选取30 min较为适宜。
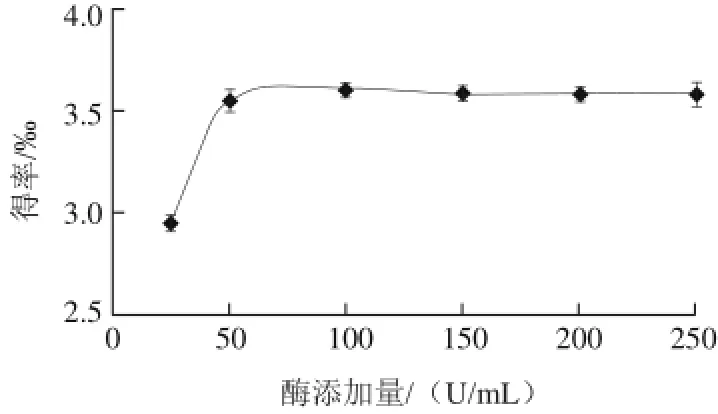
图6 酶添加量对花青素得率的影响Fig.6 Effect of enzyme concentration on the yield of anthocyanins
2.3.4 酶添加量对花青素得率的影响
由图6可知,当纤维素酶用量达到50 U/mL后,继续增加酶用量,花青素的得率不再增加。因为酶作用的底物量是一定的,当底物被酶充分作用后,继续增加酶的用量不会导致花青素释放量的增加。因此,纤维素酶的加入量选取50 U/mL较为适宜。
2.3.5 料液比对花青素得率的影响
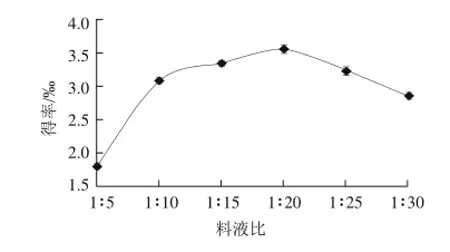
图7 料液比对花青素得率的影响Fig.7 Effect of solid-to-liquid ratio on the yield of anthocyanins
由图7可知,花青素的提取得率随着料液比的增加先上升后下降,在料液比1:20时达到最大值,再增大料液比得率反而下降。过量溶剂的使用使酶的浓度降低,从而降低了酶与底物的接触,因而使花青素的提取得率下降。因此,料液比选择1:20较为适宜。
2.4 响应面试验
2.4.1 响应面试验设计与结果
结合单因素的试验结果,采用Box-Behnken响应面试验设计,考察提取温度、提取时间、液料比、酶添加量对花青素得率的影响,试验结果见表2。

表2 Box-Behnken试验设计及相应结果Table2 Box-Behnken design and experimental results

续表1
2.4.2 回归模型的建立及显著性检验
利用Design-Expert 8.0软件,通过对多项式回归分析,得到的拟合全变量二次回归方程模型为:
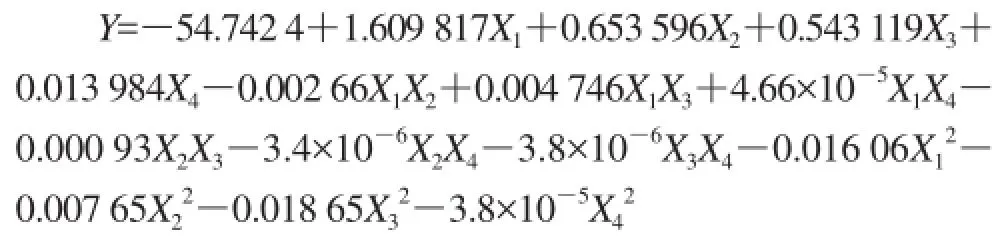
回归方程及偏回归系数方差分析结果见表3。

表3 回归模型方差与分析Table3 Analysis of variance for the fitted regression model
由表3可知,模型P<0.000 1,表明回归模型高度显著;失拟项P=0.305 7>0.05,即模型失拟项不显著,表明模型合适,即试验数据有意义。决定系数R2是参数变量和总变量的比值,也是检测数据合理性的指标。当R2接近1时,表明模型与真实数据拟合度好[20]。本试验的R2=0.995 1,因此该回归方程拟合度较好。回归方程系数的显著性分析结果表明:X1、X2、X4、X1X2、X1X3、、、、对花青素得率影响高度显著;X3、X2X3对得率影响显著。各试验因素对紫薯花青素得率大小的影响依次是酶添加量(X4)>提取温度(X1)>提取时间(X2)>液料比(X3)。
2.4.3 响应面交互作用分析
根据上述回归方程绘出响应曲面图及等高线图,见图8~10,分析提取温度、提取时间、液料比、酶添加量4个因素对紫薯花青素提取得率的交互作用。
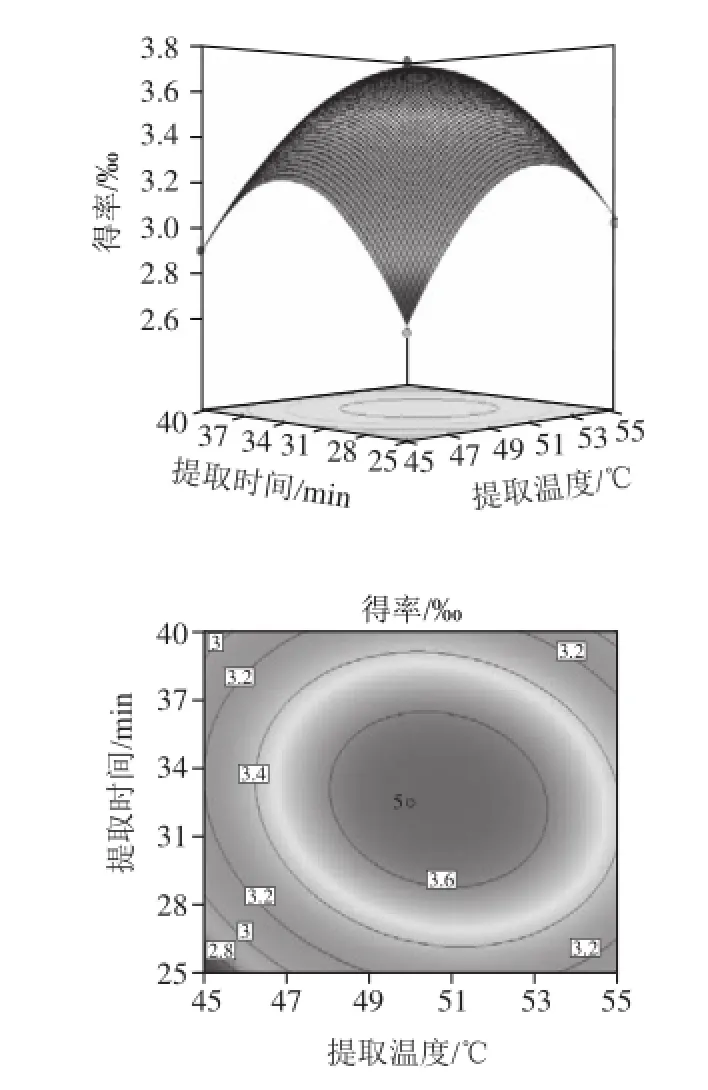
图8 提取温度(X1)和提取时间(X2)对花青素得率影响的响应面及等高线图Fig.8 Response surface and contour plots for the effects of temperature X1and time X2on the yield of anthocyanins


图9 提取温度(X1)和液料比(X3)对花青素得率影响的响应面及等高线图Fig.9 Response surface and contour plots for the effect of temperature X1and solid-to-liquid ratio X3on the yield of anthocyanins
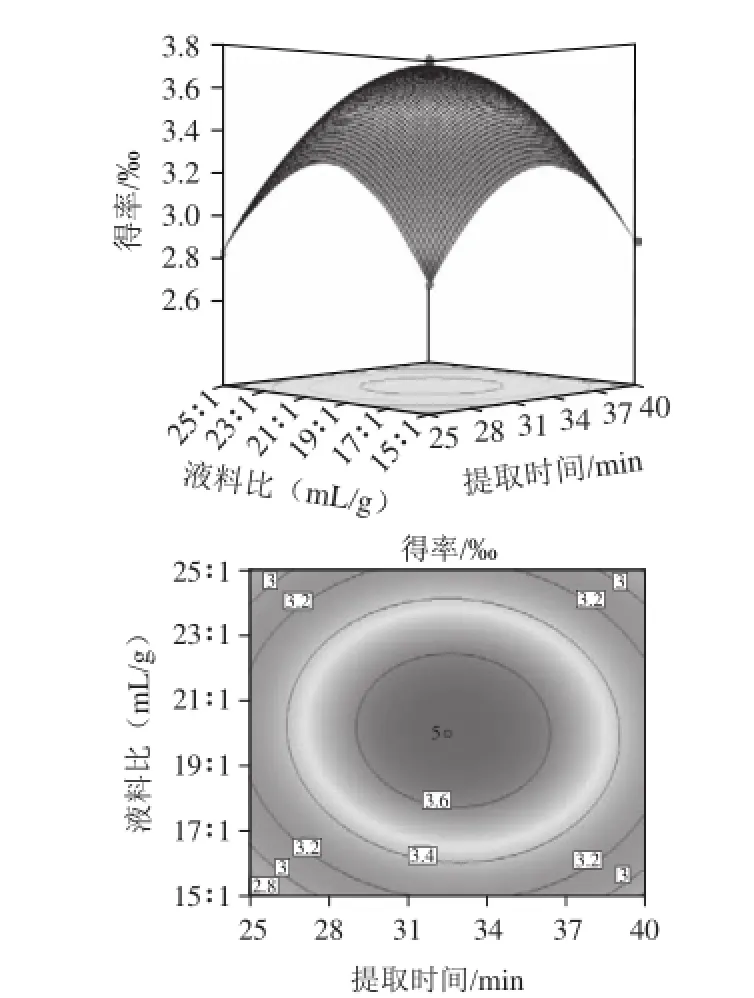
图10 提取时间(X2)和液料比(X3)对花青素得率影响的响应面及等高线图Fig.10 Response surface and contour plots for the effect of extraction time X2and solid-to-liquid ratio X3on the yield of anthocyanins
由图8提取温度和提取时间的交互作用可知,随着提取时间和提取温度的增加,花青素的得率先增加后降低,响应曲面的坡度陡峭,表明这两个因素的交互效应显著,当提取时间在32 min左右、提取温度为50 ℃左右时花青素得率较高;由图9可知,随着提取温度和液料比的增加,花青素的得率呈先增加后减小的趋势,响应曲面的坡度陡峭,表明这两个因素的交互效应显著,当液料比在20:1(mL/g)左右时,花青素的得率较高;由图10可知,随着提取时间和液料比的增加,花青素得率增加到最大值后下降,等高线呈椭圆形,说明两因素的交互作用较强。比较以上各图可以看出,提取温度(X1)和提取时间(X2)对花青素得率的影响高度显著,表现为曲线相对较陡;其次液料比(X3)曲线较平滑,对花青素得率的影响较显著。
2.4.4 响应面因素水平优化结果及模型验证
对回归模型进行响应面分析,得到花青素得率预测最大值时各因素水平为提取温度50.72 ℃、提取时间32.61 min、液料比20.17:1、酶添加量53.75 U/mL,预测得率可达到3.719‰。
为检测响应面法所得结果的可靠性,将上述最优条件调整为:提取温度51 ℃,提取时间33 min,液料比20:1,酶添加量54 U/mL,进行3 次重复试验,其得率的实测值为(3.581±0.016)‰,该值落在响应值的95%预测区间[3.532 9‰,3.904 8‰]内,表明所建回归模型具有良好的预测效果。
2.5 不同提取方法的比较
称取紫薯粉2.0 g,分别用盐酸-乙醇浸提法、微波法、超声波法、酶-超声波辅助提取方法提取花青素,不同方法的提取时间和花青素得率结果见表4。

表4 不同提取方法的比较Table4 Comparison of different extraction methods
由表4可知,酶-超声波辅助同步提取法较单纯盐酸-乙醇浸提法,花青素得率提高了2.73 倍,而提取时间缩短了75%;在相同的条件下,酶-超声波辅助同步提取法较单纯微波法和超声波法,花青素得率分别提高了32.4%和17.8%;酶-超声波辅助法提取花青素得率较高。
3 结 论
紫薯花青素经双光束紫外-可见分光光度计光谱扫描分析,得到其最大吸收波长为520 nm。在单因素的基础上,采用Box-Behnken试验设计和响应面分析法,得到酶-超声波辅助法提取紫薯花青素的最佳工艺条件为提取温度51 ℃、提取时间33 min、液料比20:1、酶添加量54 U/mL,此条件下,花青素得率可达到3.581‰。传统的有机溶剂浸提法花青素得率为0.96‰,酶-超声波辅助法与传统方法相比,花青素得率提高了2.73倍;与微波法、超声波法相比,花青素得率分别提高了32.4%和17.8%。
[1] SUDA I, OKI T, MASUDA M, et al. Direct absorption of acylated anthocyanin in purple-fleshed sweet potato into rats[J]. Journal of Agriculture and Food Chemistry, 2002, 50(6): 1672-1676.
[2] ZHANG Z F, FAN S H, ZHANG Y L, et al. Purple sweet potato color attenuates oxidative stress and inflammatory response induced by D-galactose in mouse liver[J]. Food and Chemical Toxicology, 2009, 47(2): 496-501.
[3] YONG P H, JAE H C, JUN M C, et al. Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxide-induced hepatotoxicity[J]. Food and Chemical Toxicology, 2011, 49(9): 2081-2089.
[4] YOSHIMOTO M, OKUNO S, YAMAGUCHI M, et al. Antimutagenicity of decylated anthocyanins in purple-fleshed sweet potato[J]. Bioscience-Biotechnology and Biochemistry, 2001, 65(7): 1652-1655.
[5] MATSUI T, EBUCHI S, KOBAYASHI M, et al. Anti-hyperglycemic effect of diacylated anthocyanin derived from Ipomoea batatas cultivar ayamurasaki can be achieved through the alpha-glucosidase inhibitory action[J]. Journal of Agricutural and Food Chemistry, 2002, 50(25): 7244-7248.
[6] 陈杰, 李进伟, 张连富. 紫甘薯色素提取及其稳定性研究[J]. 食品科学, 2011, 32(18): 154-158.
[7] MITSUYOSHI K, TOMOMI T, KATSUHISA H, et al. Antioxidative activity of anthocyanins from purple sweet potato, ipomoea batatas cultivar ayamurasaki[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(5): 979-988.
[8] 尹晴红, 刘邮洲, 谢一芝, 等. 紫甘薯花色甙的提取条件[J]. 江苏农业学报, 2002, 18(4): 236-240.
[9] 陆国权, 邱永军, 楼晓波. 紫心甘薯红色素提取技术研究[J]. 浙江农业大学学报, 1997 , 23(1): 105-107.
[10] 王和才, 蔡健, 胡秋辉, 等. 超声波辅助提取紫红薯色素的工艺研究[J].江苏农业科学, 2009, 36(2): 236-238.
[11] 谢一芝, 郭小丁, 贾赵东, 等. 紫心甘薯品种宁紫薯1号的特性鉴定与利用价值[J]. 江苏农业学报, 2010, 26(6): 1435-1437.
[12] 李大婧, 宋江峰, 刘春泉, 等. 超声波辅助提取黑豆皮色素工艺优化[J].农业工程学报, 2009, 25(2): 273-279.
[13] 孙雪花. 超声波辅助提取紫甘蓝天然色素工艺优化[J]. 食品研究与开发, 2009, 30(12): 106-108.
[14] 徐怀德, 闫宁环, 陈伟, 等. 黑莓原花青素超声波辅助提取优化及抗氧化性研究[J]. 农业工程学报, 2008, 24(2): 264-269.
[15] 赵旭博, 董文宾, 于琴, 等. 超声波技术在食品工业应用新进展[J].食品研究与开发, 2005, 26(1): 3-7.
[16] 田丽君, 刘志伟, 张艳等. 酶法辅助提取紫薯花青素研究[J]. 武汉工业学院学报, 2012, 31(6): 1-4.
[17] 李华, 肖付才. 铁盐催化比色法测定葡萄籽超微粉中的原花青素[J].食品研究与开发, 2007, 28(9): 114-117.
[18] 韩永斌. 紫甘薯花色苷提取工艺与组分分析及其稳定性和氧化性研究[D]. 南京: 南京农业大学, 2007: 35.
[19] 张宏宝. 茶树红紫色牙叶中花青素组分的分离及鉴定[D]. 泰安: 山东农业大学, 2009: 28.
[20] SIN H N, YUSOF S, HAMID N S A, et al. Optimization of enzymatic clarification of sapodilla juice using response surface methodology[J]. Journal of Food Engineering, 2006, 73(4): 313-319.
Optimization of Ultrasonic-Assisted Enzymatic Extraction of Anthocyanins from Purple Sweet Potato by Response Surface Methodology
ZHANG Man1, PAN Li-jun1,2,*, JIANG Shao-tong1,2, MO Yu-wen1
(1. College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2. Anhui Key Laboratory of Intensive Processing of Agricultural Products, Hefei 230009, China)
The ultrasonic-assisted enzymatic extraction of anthocyanins from purple sweet potato was optimized by Box-Behnken experimental design and response surface methodology to increase the yield of anthocyanins. The optimum extraction conditions were obtained as follows: in a solvent made up of 0.1% hydrochloride and ethanol (50:50, V/V) at 51 ℃, hydrolysis with 54 U/mL cellulase for 33 min at a ultrasonic power of 100 W. The yield of anthocyanins was up to (3.581 ± 0.016)‰ under these conditions. Compared with the traditional solvent extraction method, the extraction duration was shortened and the yield of anthocyanins was increased by 2.73 folds using this method, and by 32.4% and 17.8%, respectively, compared with microwave-assisted method and ultrasonic-assisted method.
purple sweet potato; anthocyanins; cellulose; ultrasonic; response surface methodology
TS202.3
A
1002-6630(2014)10-0023-06
10.7506/spkx1002-6630-201410005
2013-08-07
“十二五”国家科技支撑计划项目(2011BAD02B04)
张慢(1986—),女,硕士研究生,研究方向为农产品资源综合利用。E-mail:zhangman.opq@163.com
*通信作者:潘丽军(1955—),女,教授,学士,研究方向为农产品资源综合利用。E-mail:panlijun1955@163.com

