KAP6.3基因与西藏绒山羊生产性状关系的研究
吴玉江,富国文,益西多吉,王绍卿,张念伟,滕晓红,索朗达,巴 贵,次仁德吉,樊月圆*
(1.西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨850009;2.云南农业大学动物科学技术学院,云南昆明650201)
西藏绒山羊是我国养殖历史较为悠久的一种绒山羊,主要分布的克什米尔绒山羊属国家重点保护品种之一,有高原型和山谷型之分,广泛分布在西藏西北部广袤的羌塘草原,其中阿里、那曲地区的白绒山羊是西藏绒山羊的典型代表[1],其羊绒品质居世界羊绒之首[2]。羊毛纤维的品质直接影响了羊绒的价格,其中绒纤维细度是影响价格的最主要因素。除此之外长度、颜色、光泽度和拉力强度等也是衡量羊绒品质的重要指标。这些性状是非遗传因素和遗传因素共同作用的结果,它不仅受基因水平上的影响,而且生理状态、年龄、营养和气候等对其也有影响[3,4]。角蛋白(Keration)和角蛋白关联蛋白(keratin associated proteins,KAPs)是羊绒的主要结构蛋白,国内外大量研究表明,羊绒的角蛋白组成与其纤维的品质有密切关系,并受遗传、营养、生理和环境等因素的影响而发生变化[5-9]。KAPs是动物毛发的结构蛋白之一,根据其氨基的Cys含量,KAP蛋白被分为3类,分别为高硫家族(Cys<30%)、超高硫家族(Cys>30%)和富含Gly-Tyr家族[10-11]。目前大量研究表明,KAP基因的遗传差异可能在决定不同毛品质和产量等性状方面发挥重要的作用[12-17]。
本文采用PCR-SSCP 技术,以KAP6.3作为候选基因,对其多态性进行了分析,旨在探索KAP6.3基因多态性对西藏绒山羊生产性状的影响,为阐明西藏绒山羊品种特点及选种选育提供科学依据。
1 材料与方法
1.1 材料
采集西藏自治区曲尼帕试验站144只周岁西藏绒山羊耳组织样本,公母各半,放入无水乙醇于-20℃保存备用。产绒前体重、体高、体长、胸围、胸深、十字部高、绒长、毛长以及产绒量等数据,由曲尼帕试验站提供。
1.2 试验方法
1.2.1 耳组织样基因组DNA 提取 取15mg 左右耳组织,让其表面酒精挥发后,用剪刀尽可能地将其剪成碎末,转入1.5mL 离心管,参照DNA 提取试剂盒(TaKaRa)说明书进行提取。提取的基因组DNA 通过核酸蛋白分析仪测定其浓度,0.5%琼脂糖凝胶电泳检测其完整性。-80 ℃保存备用。
1.2.2 引物信息 参照GenBank 提供的山羊KAP6.3基因序列(登录号:AY310751)及刘海英(2007)[15设计的引物。上游引物为:5'-GCTATGGAGGCCTGGGCTG-3',下 游 引 物 为:5'-GGAAAATTGGAGGGTGAGAGTCTTC-3',预期扩增片段长度为199bp。引物由上海生物工程技术服务有限公司合成,其Tm 值为62.5 ℃。
1.2.3 PCR 扩增 PCR 反应体系:10×Premix taq 12.5μL,模板DNA 1μL(50ng/μL),上游引物0.5 μL(10pmol/μL),下游引物0.5μL(10pmol/μL),ddH2O10.5μL,共计25μL。PCR扩增程序:95 ℃预变性5min;30个循环(94℃30s,62.5℃40s,72℃1min);72℃延伸10min,4℃保存。
1.2.4 PCR-SSCP分析与测序 用14%聚丙烯酰胺凝胶进行电泳,电泳前120V 预电泳30 min。4 μL PCR 产物和8μL的变性buffer(95%去离子甲酰胺、1 mmol EDTA (pH=8.0)、0.025%二甲苯菁、0.025%溴酚蓝、10%甘油),98 ℃变性10min,取出迅速置于准备好的碎冰中,使之保持单链状态,10min后全部上到14%聚丙烯酰胺凝胶(Acr:Bis=29:1)中电泳。200V 高压电泳30min,然后110 V 电泳20h左右;电泳结束后,进行银染显带并用紫外凝胶成像系统照相分型。选取不同基因型个体的DNA 样品进行克隆,测序由上海生物工程技术有限公司进行。
1.3 数据统计分析
对不同基因型频率进行统计。运用SPSS 软件对数据进行分析,根据最小二乘线性模型,分析KAP6.3基因的性别因素和基因型因素的交互效应,采用了以下固定模型:Yijl=μ+αi+βj+eijl。式中:Yijl为个体表型记录,μ为试验全部观测值总体平均值,αi为性别效应,βj为基因型效应,eijl为随机误差。
2 结果与分析
2.1 PCR 产物和PCR-SSCP检测结果
PCR 扩增结果见图1,扩增片段长度为199bp;用14%聚丙烯酰胺凝胶检测其SNPs,其检测结果共发现5种基因型,分别命名为基因型1、基因型2、基因型3、基因型4和基因型5,PCR-SSCP 电泳结果见图2。
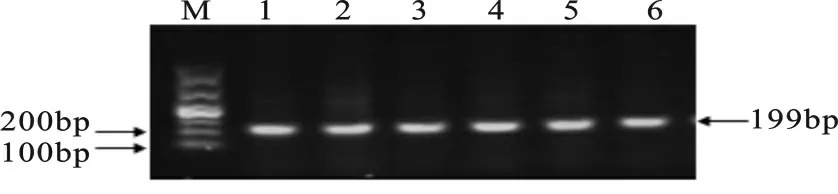
图1 KAP6.3基因的PCR 扩增产物1-6为扩增产物;M.DL 1000Fig.1 Amplified products of KAP6.3gene.1-6were amplified products;M was DL1000
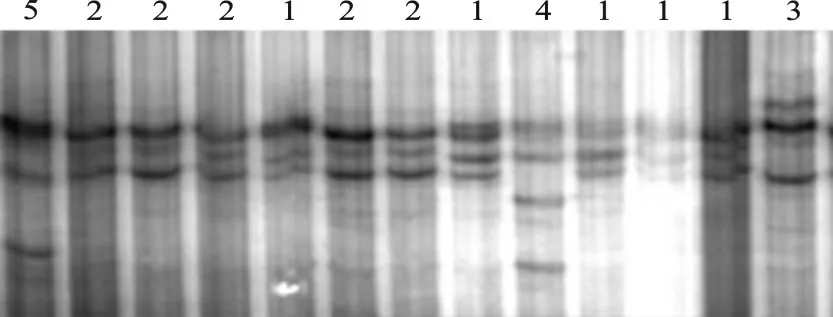
图2 KAP6.3基因的PCR-SSCP检测结果1-5为KPA6.3基因的5种基因型Fig.2 PCR-SSCP Test of KAP6.3gene1-5marked different genotypes of KAP6.3gene
2.2 KAP6.3基因扩增产物的序列分析
克隆测序结果与 GenBank (序列号:AY310751)中的序列进行对比,发现扩增片段内存在7 个SNPs,分别位于C134T、G148A、G170A、T210C、A217G、A229C 和T284G 处,其中T284G存在于该基因的3'-UTR 端。PCR-SSCP 和测序结果结合分析,分型如下:C-N-N-T-A-A-N 连锁突变命名为基因型1;C-N-G-T-N-A-T 连锁突变命名为基因型2;C-N-N-T-A-N-T连锁突变命名为基因型3;N-N-N-T-A-A-T连锁突变命名为基因型4;C-NN-N-A-A-T连锁突变命名为基因型5。各基因型序列比较结果如下:

图3 5种基因型的核甘酸序列与GenBank上的序列的BLAST结果Fig.3 BLAST result of nucleotide sequences of 5genotypes in GenBank
2.3 KAP6.3基因编码区氨基酸变化
利用DNAman软件对7个SNPs 造成的氨基酸变化进行分析,发现共存在2个同义突变和4个错义突变,4处错义突变分别为148位点TGC(Cys半胱氨酸)→TAC(Tyr酪氨酸);210位点TCT(Ser丝氨酸)→CCT(Pro 脯氨酸);217位点TAT(Tyr酪氨酸)→TGT(Cys 半胱氨酸)和229 位点TAT(Tyr酪氨酸)→TCT(Ser丝氨酸)。具体于各基因型中的分布如图4,比较发现5种基因型都在第30位发生了氨基酸Cys→Tyr的错义突变;基因型2的53位的氨基酸由Tyr转变为Cys;基因型3的57位的氨基酸由Tyr转变为Ser;基因型5的51位的氨基酸由Ser转变为Pro。

图4 5种基因型对应氨基酸序列的比对结果Fig.4 Comparison of amino acid sequence of 5genotypes
2.4 西藏绒山羊KAP6.3基因的基因型频率
根据聚丙烯酰胺胶图对应测序结果对所有试验个体进行分型,统计各基因型频率,结果如表1 所示。检测到的5种基因型中,基因型2在群体中的频率最高(50%),基因型1次之,这两种基因型是群体的优势基因型,占群体频率的89%;基因型3~5在群体中个体较少,其频率在3%~6%范围。

表1 西藏绒山羊KAP6.3 基因的基因型频率分布Table 1 Genotypes frequency of KAP6.3gene in Tibetan Cashmere goats
2.5 西藏绒山羊KAP6.3基因多态性与生产性状的相关性分析结果
考虑到基因型3、基因型4和基因型5在群体中所占比例不足10%,本研究只将基因型1和基因型2与生产性状做了相关性分析。在由表2可见,从基因型考虑,在体重指标方面,周岁西藏绒山羊母羊的基因型1 个体显著高于基因型2 个体(P<0.05);从性别因素考虑,在体尺性状方面,母羊在体高指标方面显著优于公羊(P<0.05),在十字部高指标方面极显著优于公羊(P<0.01);而在产绒性状方面,公羊个体在毛长指标方面极显著优于母羊(P<0.01),产绒量也显著高于母羊(P<0.05);而基因型和性别的互作没有对生产性状产生显著影响(P>0.05)。
3 讨论
3.1 KAP 家族基因多态性与产绒性状的相关性
KAPs是编码毛发纤维组成蛋白的一种结构基因,由多基因家族编码。目前在绵羊和山羊上报道有KAP1、KAP6、KAP8、KAP9、KAP13基因与羊毛的质量和产量的相关性研究。刘桂芬等[12]对高硫蛋白基因(KAP1.1、KAP1.3)的多态位点W08667与羊毛细度的相关性进行研究,发现该位点对新疆优质细毛羊的羊毛细度有显著影响(P<0.05);Itenge-Mweza等[13]研究发现KAP1.1基因在美利奴绵羊中存在多态性,且与羊毛的细度有显著的相关性;王杰等[14]利用PCR-SSCP方法对高原型藏山羊的KAP6.1和KAP6.2基因进行判型,并对各个基因型与产绒量、绒长度和细度的相关性进行分析;刘海英[15]在KAP6.3基因的编码区和3'-非翻译区共发现了10个SNPs位点,其中AB 基因型产绒量显著高于其它基因型;F 和H 基因型的产绒量最高,且绒长度最长;AC 基因型的绒纤维细度最小;KAP8.1和KAP8.2基因的多态性研究见于赵俊星等[16]和刘海英等[15],共有4 个SNPs被发现;研究发现KAP13-1基因也存在丰富的多态性。综上所述,KAP基因虽然具有较大的基因变异,但并未导致动物的致死,只是改变了毛发的特征如产绒量、绒的细度和长度等,因此这些变异才得以遗传保留。这也使得在KAP基因家族寻找影响产绒性状的有效QTL成为可能。
3.2 KAP6.3基因的多态性以及与生产性状的关系
本次试验采用PCR-SSCP技术及DNA 克隆测序方法对西藏绒山羊KAP6.3基因的编码区和部分3'-UTR区(199bp)进行多态性研究,显示为5种基因型,经测序共发现7个SNPs,与刘海英[15]在内蒙古绒山羊上检测到的SNPs有4 处相同,分别为C134T、G170A、A217G 和A229C,C149T 和G163A处的突变是在内蒙古绒山羊上检测得到,而G148A、T210C 和T284G 突变是在西藏绒山羊上检测得到的。由此可见,KAP6.3基因保守性较差,从而具有丰富的遗传变异,但由于研究群体所处的地理环境及气候条件的影响,不同种群变异位置存在较大差异。同时对7个SNPs所导致的氨基酸的变化进行比对,共存着4处错义突变,分别为30位Cys→Tyr、51位Ser→Pro、53位Tyr→Cys、57 位Tyr→Ser。其中217位和229位氨基酸变化与刘海英研究一致。氨基酸的改变可能会影响蛋白质的构型和表达,从而影响动物的经济性状。因此本研究又将优势基因型1和基因型2对西藏绒山羊生产性状的影响做了相关性分析。分析结果显示,周岁母羊在体尺指标如体高、十字部高方面显著高于公羊,而周岁公羊在毛长和产绒量方面明显优于母羊(P<0.05)。同时也发现,其它体尺指标,如体重、体长、胸围、胸深,母羊都高于公羊;而测定的三个产绒性状指标-绒长,毛长,产绒量,公羊却高于母羊。因此,分析产绒指标不仅跟动物皮肤面积的大小有关,而单位面积皮肤的绒密度可能才是决定产绒量的主要因素。
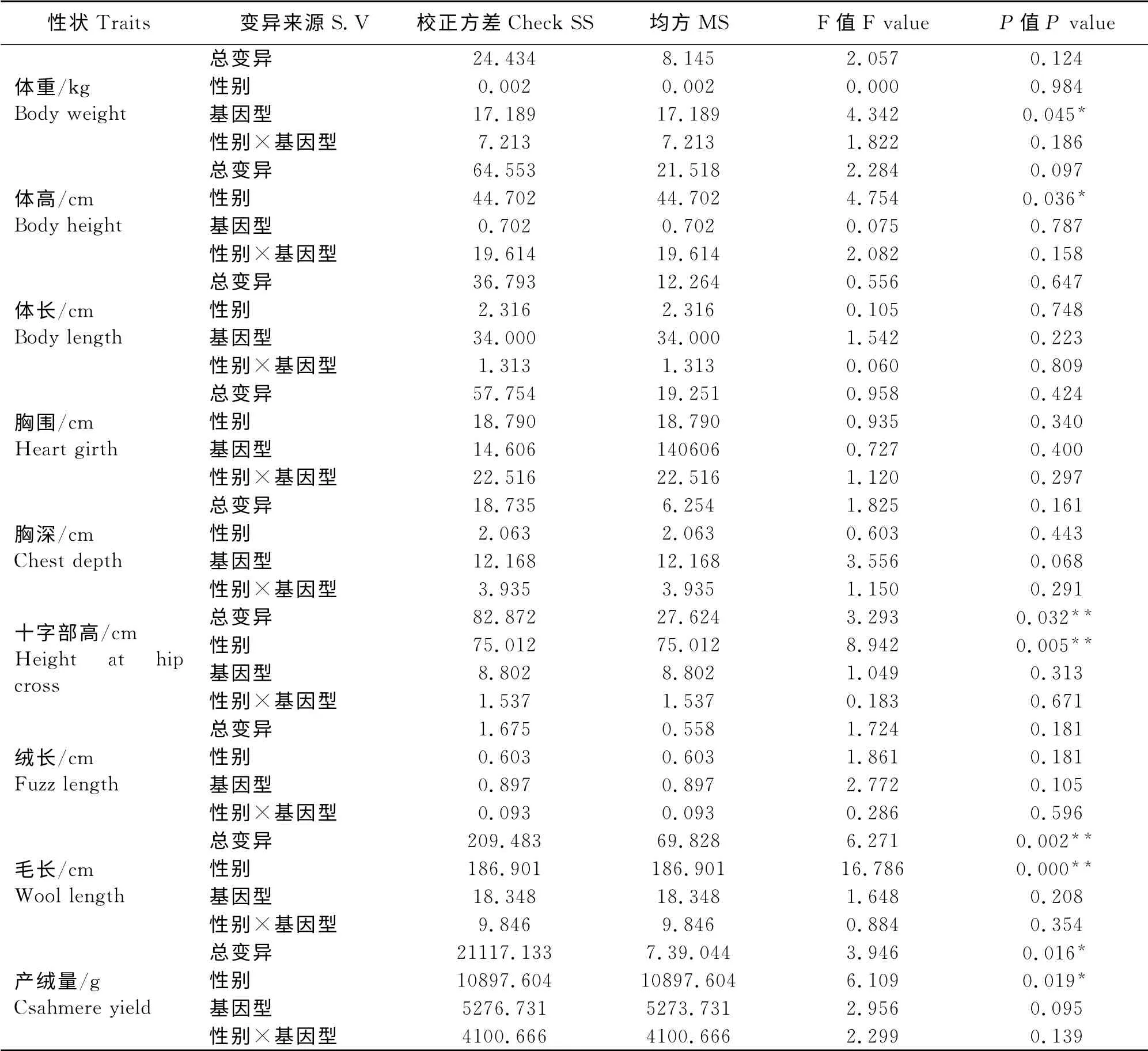
表2 基因型和性别对西藏绒山羊生产性状的方差分析Table 2 ANOVA between genotypes and sex and production traits in Tibetan Cashmere Goats
4 结论
KAP6.3基因在西藏绒山羊群体中存在较大的遗传变异,这些变异与羊的生产性状指标密切相关,可将其作为影响西藏绒山羊生长性状和产绒性状的候选基因,用于其具高产品系选育的辅助分子标记。
[1]高雪峰,邢玉梅.我国绒山羊品种资源现状及发展对策[J].中国草食动物,2011,31(6):50-53.
[2]Gillespie J M,Frenkel M J.The tyrosine-rich proteins of keratins.Occurrence,properties and regulation of biosynthesis[C].Proceedings of the 5th International Wool Textile Research Conference,1975,Aachen,1976:265-276.
[3]Gillespie J M,Marshall R C.Variability in the proteins of wool and hair[C].Proceedings of the 6thInternational Wool Textile Research Conference 1980Pretoria,1980:67-77.
[4]周旭英,邱建军,孔学民.西藏白绒山羊产业现状与未来发展[J].当代畜牧,2003(9):1-3.
[5]彭玉麟,贾志海,卢德勋,等.不同蛋白质水平的日粮对内蒙古白绒山羊消化代谢的影响[J].畜牧兽医学报,2002,33(4):321-326.
[6]Zhou H M,Allain D,Li J Q,et al.Effects of non-genetic factors on production traits of Inner Mongolia cashmere goats in China[J].Small Rumin Res,2003,47:85-89.
[7]王林枫,卢德勋,孙海州,等.光照和埋植褪黑激素对内蒙古绒山羊氮分配和生产性能影响的研究[J].中国农业大学学报,2006,11(1):22-28.
[8]牛一兵,贾志海,卢德勋,等.放牧条件下绒山羊绒毛季节性生长变化规律的研究[J].动物营养学报,2005,17(2):33-37.
[9]Bai J Y,Zhang Q,Li J Q,et al.Estimates of genetic parameters and genetic trends for production traits ofInner Mongolian White Cashmere goat[J].Asian-Aust J Anim Sci,2006,19(1):13-18.
[10]Rogers M A,Langbein L,Winter H,et al.Hair keratin associated proteins:characterization of a second high sulfur KAP gene domain on human chromosome 21[J].J Invest Dermatol,2004,122:147-158.
[11]Rogers M A,Langbein L,Winter H,et al.Characterization of a cluster of human high/ultrahigh sulfur keratin-associated protein genes embedded in the type I keratin gene domain on chromosome 17ql2-21[J].J Biol Chem,2001,276:19 440-19 451.
[12]刘桂芬,田可川,张恩平,等.优质细毛羊羊毛细度的候选基因分析[J].遗传,2007,29(1):70-74.
[13]Itenge-mweza T O,Forrest R H J.Polymorphism of the KAP1.1,KAP1.3and K33genes in Merino sheep[J].Mol Cellular Probes,2007,21:338-342.
[14]王 杰,代怡倩,王 永,等.高原型藏山羊KAP6.1 和KAP6.2位点与产绒性状的关系研究[J].西南民族大学学报:自然科学版,2010,36(6):962-966.
[15]刘海英.KAP8、KAP6.3和FGF5基因变异对绒毛性状的影响及绒毛品质变化规律的研究[D].北京:中国农业大学,2007.
[16]赵俊星,任有蛇,岳文斌.三个山羊品种KAP8基因的PCRSSCP分析[J].生物技术,2007,17(5):3-5.
[17]李明娜,刘 秀,王继卿,等.4个绒山羊群体KAP13-1基因的遗传多态性分析[J].西北农林科技大学学报:自然科学版,2013,41(4):7-15.

