渔用溶菌酶制品的稳定性研究
■ 邢思华 华雪铭朱站英, 黄 卫 沈彦萍沈文婧
(1.上海海洋大学农业部淡水水产种质资源重点实验室,上海201306;2.泗洪县水产技术推广站泗洪县水生动物疫病预防控制中心,江苏宿迁223900;3.杭州海皇饲料开发有限公司,浙江杭州311100;4.上海沈李科工贸有限公司,上海200436)
作为国际公认的绿色天然酶制剂[1-2],溶菌酶具有无毒[3]、无害、专一性强[4]的特点,并已经广泛应用于医疗[5]、食品[6]等行业。相关研究表明,溶菌酶在饲料行业也有着广阔的应用前景,在部分水产动物饲料中使用[7-8]已取得良好的效果。然而针对水产动物复杂的营养生理特性[9-12],渔用饲料高温高压的加工工艺特点以及酶制剂易失活的特性[13-14],饲用溶菌酶在水产饲料中的可行性、稳定性和真实有效性还有待进一步验证。研究采用人工模拟环境因子的方法探讨溶菌酶酶活力受温度、pH值等因素的影响,评价溶菌酶制品的储存效果,并通过体外消解法探讨溶菌酶制品对鱼体内源性消化酶的耐受性,为溶菌酶制品的改良及其在水产饲料中的应用提供参考。
1 材料和方法
溶菌酶制品为粉状脂质体,采用薄膜法制备而成。
1.1 溶菌酶制品活性随储存时间、温度和pH值的变化
将溶菌酶制品分装在自封袋中,放入干燥器,室温14~26℃保存。保存至60 d和90 d时在pH值7.2、37℃条件下分别测定溶菌酶活力。
以储存至60 d的溶菌酶制品为试验材料,在37℃及不同pH值(3.0、4.0、5.0、6.0、7.0与8.0[15])条件下测定溶菌酶活力。将溶壁微球菌接种于营养琼脂培养基,30℃培养48 h,用上述不同pH值的PBS冲洗菌落[16],转移至离心管,3 000 r/min离心1 min,弃上清液后,再用相应的PBS重新混匀溶壁微球菌,使悬浊液的透光度在0.4左右;同时用相应pH值的PBS溶解溶菌酶制品(0.01 g/ml)。
以保存至90 d的溶菌酶制品为试验材料,在pH值7.2及不同温度条件下测定溶菌酶活力。使用恒温水浴锅将温度分别控制在14、20、30、40、50、60、70、80、90℃和99℃。用pH值7.2的 PBS溶解溶菌酶制品(0.01 g/ml)、制备透光度约0.4的溶壁微球菌悬浊液。
溶菌酶活力测定:溶菌酶制品溶液50 μl和溶壁微球菌菌液3 ml在冰水浴条件下混匀,于570 nm处测量透光度,然后在试验设定温度条件下水浴30 min,混匀冰水浴20 min以终止反应,570 nm处测量透光度。溶菌酶活力计算公式如下:
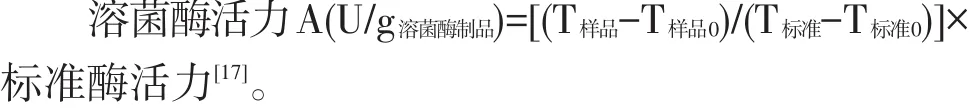
1.2 含溶菌酶制品的饲料耐挤压和耐高温特性
将溶菌酶制品按300 mg/kg的添加量与基础饲料原料(鱼粉6.2%、豆粕23.4%、菜籽粕18.9%、小麦麸15.0%、次粉15.0%、米糠5.0%、面粉11.7%、磷酸二氢钙1.5%、氯化胆碱1.0%、大豆油1.0%、复合多维0.5%、复合矿物质0.5%、食盐0.3%)逐级混合后加10%蒸馏水,取一部分经绞肉机两次挤压,测定挤压前后的溶菌酶活力;另取一部分密闭在自封袋内,放入烘箱,80℃加热2 h,待冷却后破碎,过60目筛绢,用无菌的pH值7.2 PBS溶解,静置20 min,反复混匀,3 000 r/min离心10 min后,取上清液在37℃条件下测定溶菌酶活力[17]。
1.3 体外消化试验
取草鱼(Ctenopharyngodon idellus)、鲫鱼(Caras⁃sius auratus)和鲤鱼(Cyprinus carpio)的肝胰脏和肠道不同部位(去肠道内容物),用pH值7.2的PBS漂洗后,吸干水分,装入1.5 ml离心管待用。
用pH值7.2的PBS将肝胰脏和肠道匀浆后(质量体积比1∶10),3 000 r/min离心1 min,取上清液即为粗酶液;将粗酶液稀释100倍后与储存60 d的溶菌酶制品的PBS溶液(0.01 g/ml)37℃预热后按体积比1∶9混合,混匀反应30 min,测定溶菌酶制品与粗消化酶液反应前后的溶菌酶活力。
试验鱼规格:草鱼(0.021 kg/尾)、鲤鱼(0.52 kg/尾)、异育银鲫(0.15 kg/尾)。溶菌酶测定方法参照1.1。
1.4 含溶菌酶制品的储存试验
在基础饲料原料(同1.2)中分别添加100、200、300、400 mg/kg与500 mg/kg溶菌酶制品(分别称为100、200、300、400、500饲料组),用实验室小型制粒机加工成直径为1.5 mm的颗粒饲料,密闭、干燥、常温(14~30℃)保存,参考沈明泉等的方法[18]每隔30 d在37℃条件下测定溶菌酶活力。
2 结果与分析
2.1 溶菌酶制品活性在不同温度和pH值条件下的变化(见图1~图2)
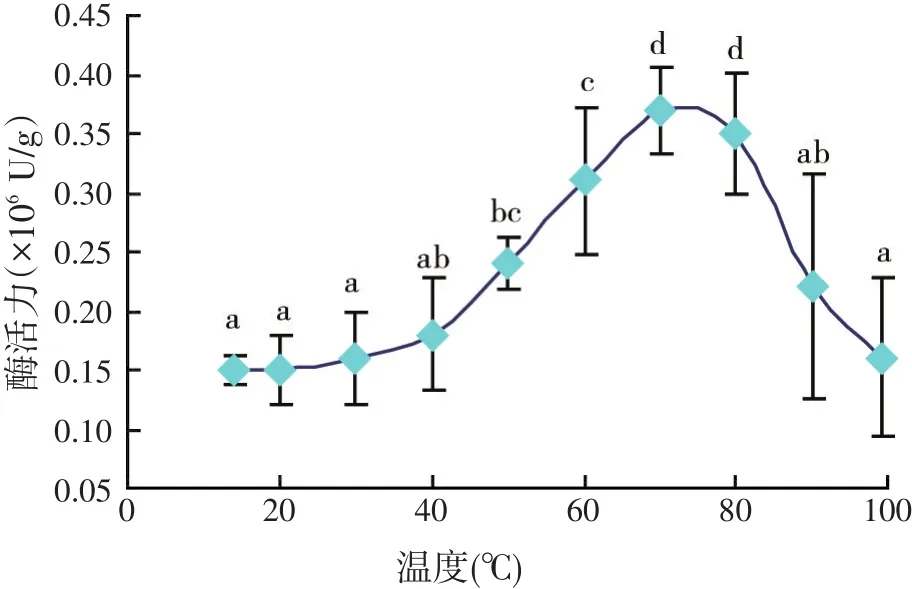
图1 溶菌酶制品酶活力随温度变化
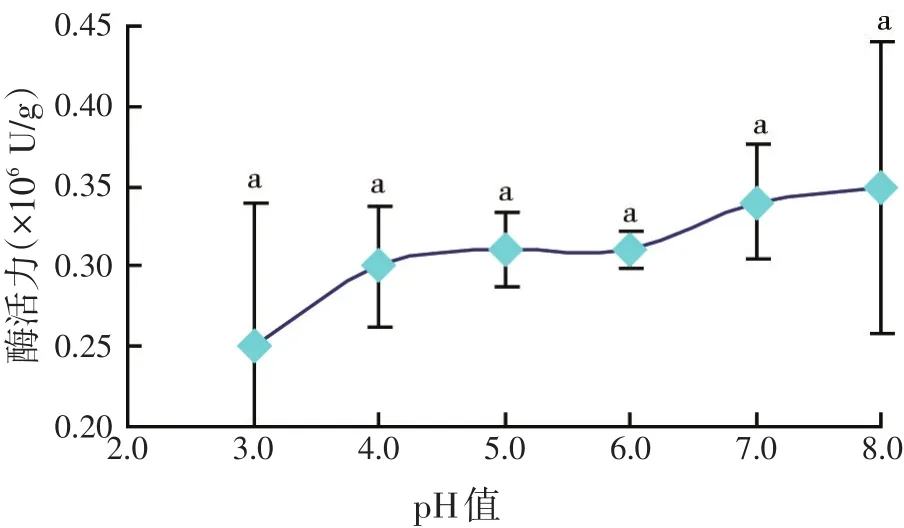
图2 溶菌酶制品酶活力随pH值变化
从图1可以看出,该溶菌酶制品的溶菌酶活力随温度升高呈现先升高后降低的显著变化(P<0.05),峰值出现在70℃。常温与高温条件下的溶菌酶活力无显著差异(P>0.05),表明该溶菌酶制品对高温具有比较强的耐受能力,可以承受饲料加工过程中的调质处理。程建军等[14]研究表明,未包被的蛋壳溶菌酶最适温度在50℃左右,在50℃时抑菌效果最佳,而本试验结果显示,该溶菌酶的最适温度在70℃附近,说明包被处理能在一定程度上提高溶菌酶的耐高温性能。而在不同的pH值(3.0~8.0)条件下,溶菌酶活力变化不显著(见图2),说明该溶菌酶制品在理论上可以适应不同水产动物、不同消化道pH值的变化。这与赖晓芳等[19]的研究结果基本一致。
2.2 含溶菌酶制品的饲料耐挤压和耐高温特性(见表1)

表1 饲料加工环境模拟对饲料溶菌酶活力的影响
含溶菌酶饲料经挤压和高温处理,溶菌酶活性从处理前的(0.64±0.01)×106U/g变化到(0.62±0.02)×106U/g和(0.55±0.01)×106U/g,但处理前后无显著差异(P>0.05),说明该溶菌酶制品对饲料加工过程有较好的耐受性。
2.3 消化酶对溶菌酶制品的体外消化(见图3)
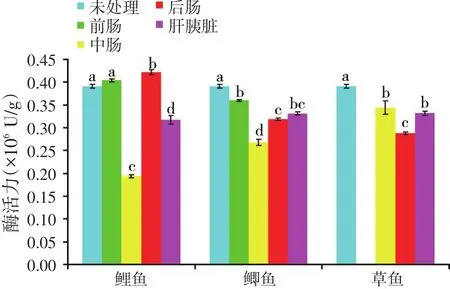
图3 三种鱼类肠道和肝胰脏粗酶液对溶菌酶制品酶活力的影响
饲料中所添加的外源溶菌酶在水产动物机体内能否最大程度耐受内源消化酶的消化分解,保持其自身的酶活性,是提高外源溶菌酶使用效果的重要影响因素[15]。从图3可以看出,鱼类消化道所分泌的消化酶对溶菌酶制品活力的影响因鱼的种类以及消化道位置的不同而不同,总体而言,外源溶菌酶在鱼类消化道中被不同程度地消化,且在中肠处溶菌酶的酶活损失较大,这可能与不同鱼类的食性及消化道不同部位的结构特点有关,具体原因有待进一步研究。鉴于溶菌酶对鱼类消化酶相对有限的耐受性,改进溶菌酶制品的包被技术对提高外源溶菌酶的使用效果具有重要意义。
2.4 含溶菌酶制品饲料与溶菌酶制品的储存试验
在0~90 d的保存期内,单独存放的溶菌酶制品酶活力显著降低(P<0.05,见图4)。当溶菌酶制品添加在配合饲料中时(见表2),随着保存时间的延长,饲料中的溶菌酶活力逐渐降低。100 mg/kg组酶活变化出现一个折线趋势,即0~30 d有较大的酶活变化,30~60 d出现一个稳定时期,60~90 d后又出现一个酶活下降时期。200、300和400 mg/kg组的酶活在30 d以后保持相对稳定。
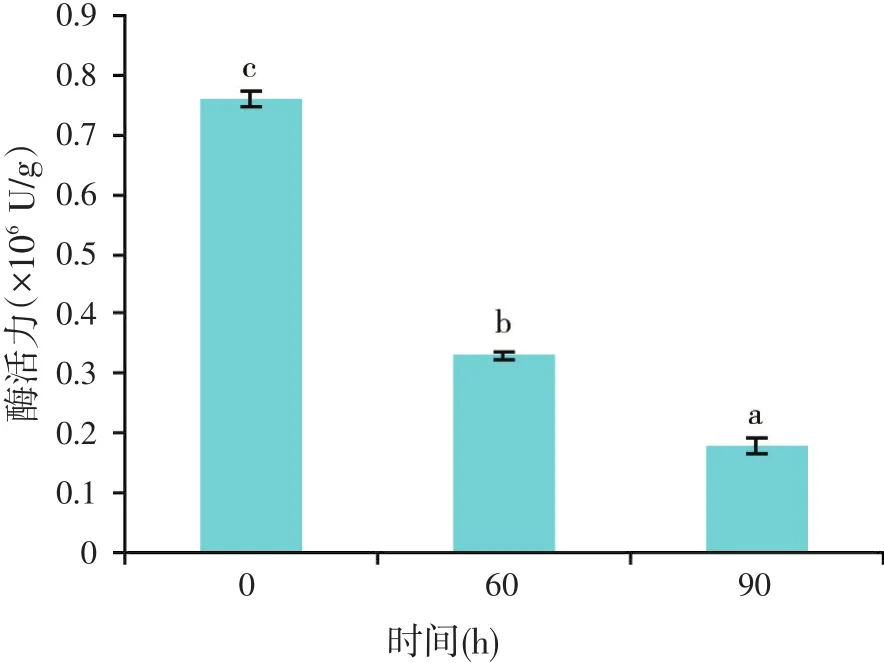
图4 溶菌酶制品酶活力随储存时间变化
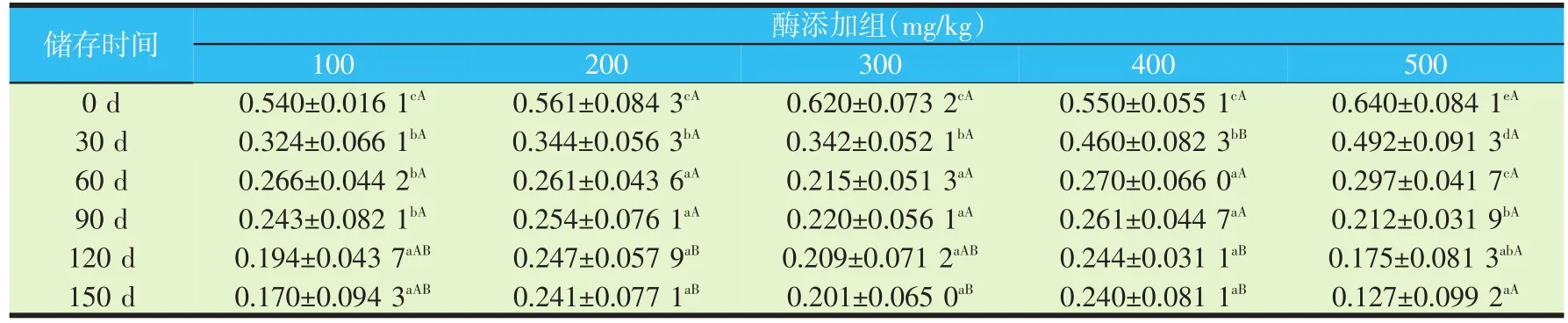
表2 饲料中溶菌酶活力随储存时间的变化(×106U/g)
相比较而言,溶菌酶制品单独存放较添加到饲料中更容易造成溶菌酶活力的降低。其可能原因是单独存放的溶菌酶制品需要应对环境的作用,而添加在饲料中的溶菌酶制品被饲料原料中的蛋白、脂肪等包裹,形成的“保护层”使溶菌酶制品与空气接触的机会大大减少[18],因此其活力变化比单独存放时相对稳定。另外,饲料中的溶菌酶活性虽然随储存时间的延长有不同程度的降低,但水产养殖季节性明显,饲料保存周期相对较短,因此,该溶菌酶制品符合渔用饲料的储存要求,具有较大的应用潜力。
3 结论
本研究所用渔用溶菌酶制品具有耐高温、耐挤压、对酸碱度不敏感等特点;添加溶菌酶制品的饲料在3个月后仍能保持35%~45%的溶菌酶活性。鉴于溶菌酶制品在鱼类消化酶作用下会被部分分解,有必要对溶菌酶制品的包被技术进行研究。

