青海牦牛牛病毒性腹泻和牛传染性鼻气管炎的流行病学调查
吕建军,张兰清
(1.青海省海西州都兰县香日德镇畜牧兽医工作站,青海都兰816100;2.青海省海西州德令哈市尕海镇畜牧兽医工作站,青海德令哈817000)
牛病毒性腹泻(bovine viral diarrhea,BVD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起牛的一种高度接触性传染病,临床上以发热、腹泻、消化道黏膜发炎和坏死、怀孕母畜流产、产死胎及畸型胎等为主要特征[1]。BVDV 进入机体后可造成持续性感染与免疫抑制,持续感染牛的血清抗体为阴性,但却终身带毒与排毒[2]。牛传染性鼻气管炎(infectious bovine rhinotracheitis,IBR)是由牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)引起牛的一种以流鼻汁、呼吸困难、气管粘膜发炎等呼吸道症状为主的接触性传染病[3]。IBRV 进入机体后可潜伏于荐神经节和三叉神经节造成潜伏感染,潜伏感染牛终生带毒,遇到应激时即向外排毒[4]。牦牛是高原牧区的主要家畜,是我国青藏高原特有的一个独立物种,我国亦是拥有牦牛数量最多的国家,约占世界的94.8%[5]。BVDV 与IBRV 均可造成机体的持续感染,使机体处于免疫耐受状态,此时机体虽不产生抗体,但却带毒、排毒,并可降低机体的免疫力,导致其他病原的继发感染。为研究青海牦牛中BVDV 与IBRV 的感染现状,有效保护青海牦牛及其牦牛养殖业的健康发展,本研究对收集于青海省不同地区的252份牦牛血清样品进行了BVDV 和IBRV 的流行病学调查,以期为牦牛BVDV 和IBRV 的预防奠定一定基础。
1 材料与方法
1.1 材料
1.1.1 血 清 2013年1月至4月,采自青海省果洛州达日县、班玛县、玛多县、久治县,黄南州泽库县、尖扎县,海南州共合县、同德县等的牦牛血清样品共计252份。
1.1.2 病毒与试剂 牛病毒性腹泻病毒、牛传染性鼻气管炎病毒均由青海畜牧兽医职业技术学院传染病实验室保存;病毒基因组RNA 提取试剂盒、病毒DNA 提取试剂盒、一步法RT-PCR 试剂盒、rTaq酶、DNA Marker DL 2000均为TaKaRa公司产品;牛病毒性腹泻病毒、牛传染性鼻气管炎病毒抗体ELISA 检测试剂盒为IDEXX 公司产品。
1.2 方法
1.2.1 抗原的检测
1.2.1.1 引物设计与合成 参照文献[6-7]采用的方法,分别设计合成针对BVDV、IBRV 的2对特异性检测引物(见表1),并由北京三博远志生物技术有限公司合成。
1.2.1.2 病毒基因组的提取 按病毒RNA 提取试剂盒的操作方法与步骤提取检测样品的病毒基因组RNA。按病毒DNA提取试剂盒的操作方法与步骤提取检测样品的病毒基因组DNA。

表1 引物序列表Table 1 Primer sequence table
1.2.1.3 BVDV 的RT-PCR 扩增与检测以提取的病毒RNA 为模板,参照一步法RT-PCR 检测试剂盒的使用说明和文献[6]的方法进行BVDV 的RT-PCR 扩增反应。RT-PCR 反应体系如下:2 xone step buffer 12.5 μL、BVDV P1 0.5 μL、BVDV P2 0.5μL、one step Enzyme Mix 0.5μL、RNA 5.0μL、RNase Free dH2O 6.0μL;RT-PCR反应参数为:50 ℃45min;94 ℃4min;94 ℃30s,62 ℃30s,72℃30s,30个循环;72℃10min;4℃终止。RT-PCR 结束后,取扩增产物经1%琼脂糖凝胶核酸电泳和凝胶成像扫描仪进行检测与鉴定。
1.2.1.4 IBRV 的PCR 扩增与检测 以提取的病毒DNA 为模板,参照文献[7]的方法进行BVDV 的PCR 扩增反应。PCR 反应体系如下:10×PCR Buffer 2.5μL、dNTP 2.0μL、IBRV P1 0.5μL、IBRV P2 0.5μL、rTaq 0.5μL、DNA 5.0μL、H2O 14.0μL;PCR 反应参数为:94 ℃4min;94 ℃30s,58 ℃30s,72℃30s,30个循环;72℃10min;4℃终止。PCR 结束后,取扩增产物经1%琼脂糖凝胶核酸电泳和凝胶成像扫描仪进行检测与鉴定。
1.2.2 抗体的检测 参照ELISA 抗体检测试剂盒使用说明书的操作方法与判定标准进行BVDV 和IBRV 抗体的检测。
1.2.3 抗原与抗体检测结果的比较 对抗原的RT-PCR/PCR 分子生物学检测结果与抗体的ELISA 免疫学检测结果进行比较分析,掌握青海省不同地区牦牛BVDV 和IBRV 的感染情况,同时比较分析在流行病学调查中使用分子生物学方法检测抗原与使用免疫学方法检测抗体的优缺点,寻找适合基层单位使用的检测方法。
2 结果与分析
2.1 抗原检测结果
对收集青海各县市的252份牦牛血清样品进行BVDV和IBRV 抗原核酸检测,结果见表2。BVDV阳性率介于6.45%~37.50%,总阳性率为21.83%,部分阳性样品核酸电泳图见图1。由图1知,阳性样品与BVDV阳性毒株对照均能扩增出288bp的特异性条带。IBRV阳性率介于3.22%~25.81%,总阳性率为13.89%,部分阳性样品核酸电泳图见图2。由图2可见,阳性样品与BVDV 阳性毒株对照均能扩增出362bp的特异性条带。BVDV/IBRV 混合感染样品数为9份,混合感染率为3.57%。

表2 抗原检测结果Table 2 Result of antigen detection

图1 部分样品BVDV RT-PCR扩增结果M.DNA 标准DL 2000;1-4.BVDV 阳性样品;5.阳性对照;6.阴性对照Fig.1 RT-PCR products of part sample for BVDVM.DNA Marker DL 2000;1-4Positive samples of BVDV;5.Positive control;6.Negative control

图2 部分样品IBR PCR 扩增结果M.DNA 标准DL 2000;1-3.IBRV 阳性样品;4.阳性对照;5.阴性对照Fig.2 PCR products of part sample for IBRVM.DNA Marker DL 2000;1-3.Positive samples of IBRV;4.Positive control;5.Negative control
2.2 抗体检测结果
本研究所收集的青海省各县市的252份牦牛血清样品BVDV 和IBRV 抗体检测结果见表3。由表3可知,BVDV 抗体阳性率介于6.45%~43.75%,总阳性率为23.02%;IBRV 抗体阳性率介于3.23%~32.26%,总阳性率为14.29%。BVDV/IBRV 混合感染抗体阳性率为3.57%。表明青海省不同地区均存在BVDV、IBRV 抗体阳性牦牛,由于该牦牛未进行BVDV、IBRV 疫苗的免疫接种,表明该抗体阳性由BVDV、IBRV 感染所致。
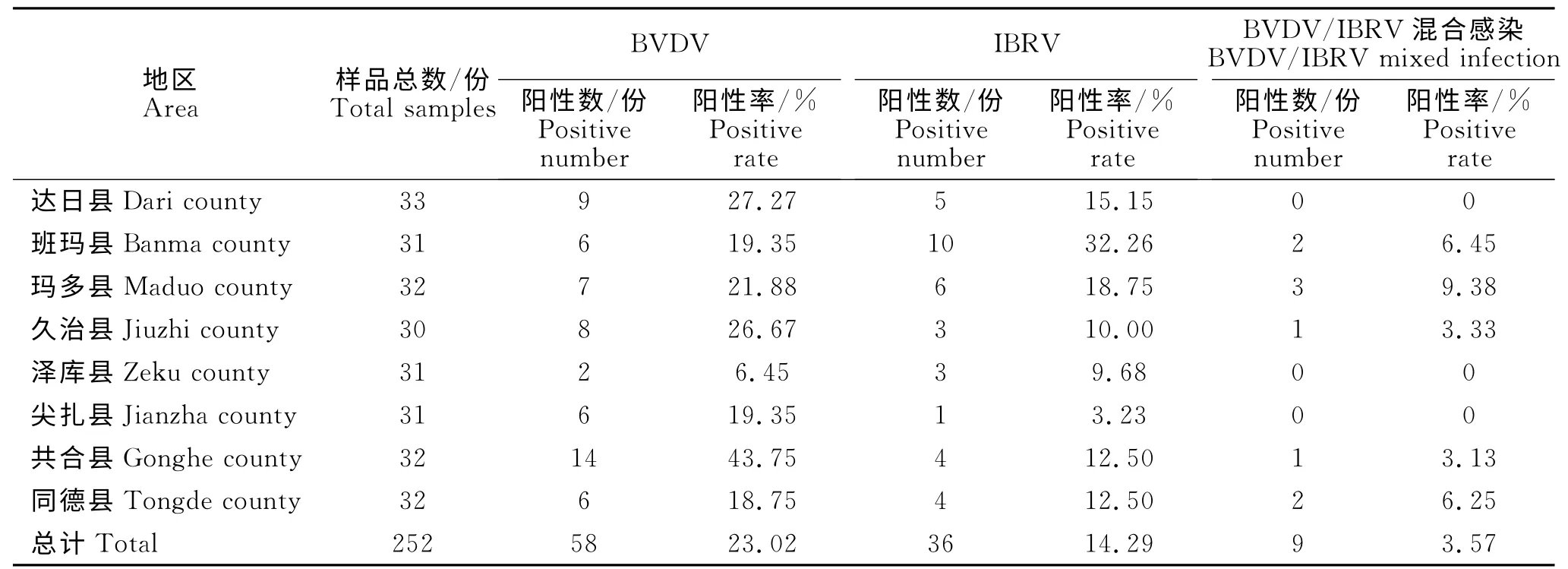
表3 抗体检测结果Table 3 Result of antibody detection
2.3 BVDV 抗原与抗体的比较结果
BVDV 的RT-PCR抗原检测方法和ELISA 抗体检测方法的比较结果显示,有4份BVDV 抗原检测阴性,但抗体检测结果为阳性;有1份BVDV 抗原检测阳性,但抗体检测结果为阴性。该结果表明存在4份感染BVDV 后逐渐康复的牦牛,该牛体内血清中抗原含量非常少,而野毒抗体效价却较高,致使RT-PCR方法没有检测到BVDV 抗原。同时也存在1份BVDV 早期感染或隐性感染牦牛,该牛体内存在BVDV 抗原,但还没有产生BVDV 抗体。
2.4 IBRV 抗原与抗体的比较结果
IBRV 的RT-PCR 抗原检测方法和ELISA 抗体检测方法的比较结果显示,有3份IBRV 抗原检测阴性,但抗体检测结果为阳性;有2份IBRV 抗原检测阳性,但抗体检测结果为阴性。该结果表明存在感染IBRV 后逐渐康复的牦牛,该牛体内血清中抗原含量非常少,而野毒抗体效价却较高,致使RTPCR 方法没有检测到IBRV 抗原。同时也存在IBRV 早期感染或潜伏感染牦牛,该牛体内存在IBRV 抗原,但还没有产生IBRV 抗体。
3 讨论
近年来,随着我国养牛规模的不断扩大,BVDV和IBRV 的感染日渐扩大,邓明亮等[10]于2012年对内蒙古通辽市、辽宁大连市、青海省5个县的840份血清进行BVDV 抗原的检测,共检出抗原阳性血清6份,平均阳性率为0.71%,地区最高阳性率为1.96%。而国内对IBRV 抗原的流行病学调查资料较少,本研究采用分子生物学技术对青海牦牛BVDV 和IBRV 感染情况首次进行了调查分析,结果显示BVDV 感染的平均阳性率为21.83%,IBRV感染的平均阳性率为13.89%,BVDV/IBRV 抗原混合感染阳性率为3.57%。该调查结果与邓明亮等[10]表现出了高度的一致性。表明青海省不同地区的牦牛均存在BVDV、IBRV 的感染,且感染在部分地区较为严重,应引起相关部门的重视。
在BVDV 和IBRV 的抗体检测和流行病学方面,研究学者已经做了大量的研究,沈艳丽等[9]于2011年对玉树地区六个县采集的牦牛血清571份进行了BVDV ELISA 抗体检测,检出阳性43 份,平均阳性率为7.5%,各县都有不同程度的感染,其中治多、称多、杂多三县的阳性率较高,均超过10%。叶成玉等[10]于2012年采用ELISA 检测试剂盒对青海天峻县的92份半野血牦牛血清进行了BVDV 抗体检测有35 份为阳性,阳性率为38.04%,从35 份阳性血清中随机抽取样品进行PCR 抗原扩增,结果均为阳性。贺晓龙等[11]于2009年对青海省14个地区采集420份牛血清样品进行了BVDV 抗体检测,检出阳性血清样品200份,平均阳性率为47.62%。韩志辉等[12]于2010年对大通种牛场和海晏地区采集的牦牛血清样品进行了BVDV 和IBRV 的抗体检测,大通种牛场牦牛BVDV 阳性率为23.42%,IBRV 阳性率为65.45%,海晏县牦牛群中BVDV 阳性率为l9.86%,IBRV 阳性率为4.96%。本研究次应用ELISA 免疫学检测方法对青海省不同地区的252份牦牛血清样品进行了BVDV 和IBRV 抗体检测的结果显示,BVDV抗体平均阳性率为23.02%,IBRV 抗体平均阳性率为14.29%。该调查结果与上述调查结果均表现出了高度的一致性,表明我国青海牦牛中BVDV、IBRV 感染的抗体阳性率较高,且地区分布差异较大,在部分地区较为严重。
BVDV 和IBRV 的感染给我国养牛业带来了巨大的经济损失,因目前还没有国产的安全有效的BVDV 和IBRV 疫苗,故及时诊断并发现和淘汰携带病毒的动物成为BVDV 和IBRV 防制的主要方法。对于BVDV 和IBRV 的诊断,笔者建议首先应采用血清学检测方法对畜群进行抗体监测,再重点对阳性畜群内的抗体检测阴性牛进行病毒的分子生物学检测,以及时发现和剔除隐性感染牛,逐步实现牛群的净化。
[1]童 钦,霍志云,胡桂学,等.牛病毒性腹泻病毒检测方法的研究进展[J].中国农学通报,2012,28(14):79-83.
[2]Helal M A,Okamatsu H,Tajima M.Bovine viral diarrhea virus infection in a dairy herd with high prevalence of persistently infected calves[J].Jpn J Vet Res,2012,60(2-3):111-117.
[3]张 辉,宋玲玲,杨宏军,等.牛传染性鼻气管炎病毒gD 基因截短表达及其抗血清制备[J].家畜生态学报,2013,34(1):29-33.
[4]Biswas S,Bandyopadhyay S,Dimri U,et al.Bovine herpesvirus-1(BHV-1)-a re-emerging concern in livestock:a revisit to its biology,epidemiology,diagnosis,and prophylaxis[J].Vet Q,2013,33(2):68-81.
[5]孙 凯,刘亚刚,王 妍,等.牦牛病毒性腹泻病毒E2基因的克隆鉴定及原核表达[J].四川动物,2011,30(6):886-889.
[6]郭春娟,吴星星,王 璐,等.牛病毒性腹泻病毒通用型RT-PCR 检测方法的建立[J].新疆农业大学学报,2012,35(3):217-221.
[7]杨 娟,支海兵.牛传染性鼻气管炎病毒PCR 检测方法的建立[J].中国奶牛,2007(8):7-10.
[8]邓明亮,费文涛,纪素坤,等.牛病毒性腹泻-黏膜病的流行病学调查[J].养殖与饲料,2012(11):33-35.
[9]沈艳丽,蔡金山,李静,等.青海省玉树地区牛病毒性腹泻-黏膜病血清学调查[J].中国动物检疫,2011,28(10):52.
[10]叶成玉,张海峰,李万财,等.青海天峻县半野血牦牛牛病毒性腹泻/黏膜病流行病学调查[J].黑龙江畜牧兽医,2012(8):117-118.
[11]贺晓龙,韩志辉.青海省牛传染性鼻气管炎血清学调查[J].青海大学学报:自然科学版,2009,27(11):57-59.
[12]韩志辉,圈 华,贺晓龙,等.牦牛病毒性腹泻/黏膜病和传染性鼻气管炎血清学调查[J].中国动物传染病学报,2010,18(6):56-59.

