黄芩苷联合黄芩素诱导乳腺癌细胞凋亡的机制研究
王 婷 ,黄立中 ,肖玉洁 ,罗 勇 ,吴双华
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.株洲市中心医院,湖南 株洲 412007)
黄芩苷联合黄芩素诱导乳腺癌细胞凋亡的机制研究
王 婷1,2,黄立中1*,肖玉洁1,罗 勇2,吴双华2
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.株洲市中心医院,湖南 株洲 412007)
目的 探讨黄芩苷和黄芩素联合应用对乳腺癌细胞凋亡的诱导作用及其相关机制。方法 将不同浓度的黄芩苷、黄芩素以及两者联合作用于人乳腺癌(Michigan Cancer Foundation 7,MCF-7)细胞。检测上述化合物对乳腺癌细胞的活力、凋亡情况以及凋亡相关蛋白表达的影响。结果 黄芩苷或黄芩素作用于乳腺癌细胞后,与作用前相比细胞生长抑制率显著升高(P<0.05);两者联合应用,与两者单独作用相比抗增殖作用明显增强(P<0.05)。流式细胞术检测发现两者作用后尤其是两者联用后细胞凋亡显著增加。蛋白印迹分析显示黄芩苷和黄芩素联合作用后Caspase-3、Caspase-9、Bax和p53的表达增加而Bcl-2表达下降,同时p-38活化亦增加。结论 黄芩苷和黄芩素均能诱导乳腺癌细胞的凋亡,两者联合应用后作用明显增强,其机制可能与其促进促凋亡相关蛋白Caspase-3、Caspase-9、Bax和p53等的表达,并抑制抗凋亡蛋白Bcl-2的表达有关。
黄芩苷;黄芩素;联合治疗;人乳腺癌;细胞凋亡
乳腺癌是女性最常见的癌症之一。占女性癌症的四分之一,且发病率呈逐年增加趋势[1]。虽然近年来治疗乳腺癌的方法和手段已经有了很大的进步,但病死率仍很高,侵袭与远处转移是其致死的最主要原因。寻找有效、低毒、价廉的治疗药物是目前研究的方向之一。众所周知,细胞稳态需要细胞增殖和细胞死亡之间的平衡,包括细胞凋亡。肿瘤生长是细胞增殖失控和凋亡不足所致,因此诱导细胞凋亡已成为治疗癌症的一种重要的有效的手段。
从植物中筛选有效抗肿瘤成分一直是抗肿瘤药物研究的热点,紫杉醇、长春新碱等药物的临床应用激励更多的学者投入植物药尤其是传统中药有效成分抗肿瘤作用的研究。作为清热解毒的传统中药黄芩的抗肿瘤作用近年受到关注。据报道[2-4],黄芩的有效组分黄芩苷或黄芩素有潜在的抗肝脏、前列腺、膀胱肿瘤作用。目前虽有报道其有治疗乳腺癌作用[5],但对于其机制的研究还比较少,因此深入研究其作用机制将有助于了解中药抗肿瘤的作用靶点及筛选出更有效的药物。
1 材料和方法
1.1 主要材料与仪器
主要材料:黄芩素(中国药品生物制品检定所,纯度 99.8%,批号:071012),黄芩苷(中国药品生物制品检定所,纯度98.6%,批号:110715-201016),两者均充分溶解于二甲基亚砜(Dimethyl Sulfoxide,DMSO)中,配制成浓度为5 000μg/L的贮存液,避光,4℃保存备用。根据前期预实验的研究结果,使用时用细胞培养液稀释成所需的浓度。DMSO的终浓度≤0.2%。兔抗人Caspase-3(半胱氨酸天冬氨酸蛋白酶-3)、Caspase-9(半胱氨酸天冬氨酸蛋白酶-9)、Bcl-2(B cell lymphoma 2,Bcl-2,B 细胞淋巴瘤基因-2)、Bax(Bcl-2 Associated X Protein,Bax,Bcl-2 相关x蛋白)、p53
和p-p38 MARK(磷酸化p38丝裂原活化蛋白激酶,p-p38)多克隆抗体均购自上海研晶生化试剂有限公司;辣根过氧化物酶标记羊抗兔IgG购于北京中杉金桥。主要仪器:电泳和凝胶成像分析系统(北京东南仪诚实验室设备有限公司);转膜仪(GE公司);酶联免疫检测仪(普朗医疗器械公司);流式细胞仪(BD公司)。
1.2 方法
1.2.1 细胞培养 乳腺癌(Michigan Cancer Foundation 7,MCF-7)细胞购自湘雅医学院中心实验室细胞库。将MCF-7细胞培养于含10%小牛血清的RPMI 1640培养基中。置于37℃,5%CO2环境中培养。细胞处于对数生长期时进行后续实验,每组实验重复3次。
1.2.2 MTT法检测细胞活力 MCF-7细胞接种于96孔培养板(1.0×104个/孔)过夜,加入不同浓度的黄芩苷、黄芩素、黄芩苷和黄芩素(具体浓度见表1),培养72 h后,加入 20 μL 0.5%MTT液 37℃培养4 h后,离心,弃去培养液,每孔加入150 μL二甲基亚砜(DMSO),将培养板低速振荡10 min。酶联免疫检测仪波长490 nm处测量各孔的光密度值(OD)。细胞生长抑制率(%)=(1-OD药物组/OD空白对照组)×100%,DMSO溶剂为空白对照组。
1.2.3 Western blot检测相关蛋白表达(1)收集细胞蛋白:细胞培养同前,过夜后加入黄芩苷(22.3μg/mL)、黄芩素(6.8μg/mL)或两者的联合(黄芩苷22.3μg/mL+黄芩素 6.8μg/mL),并设溶剂空白对照,药物干预48 h后,收集细胞,加入适量细胞裂解液和蛋白酶抑制剂苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)裂解,收集蛋白质液,BCA 法测蛋白浓度。(2)蛋白免疫印迹分析(Western blot):灌制12%的分离胶和4%的浓缩胶;将蛋白样品放入100℃的离子浴中5 min;按每泳道等量蛋白配置相应的上样体系;向各泳道中加入蛋白样品及分子量Marker,以GAPDH作为内参。电泳后剥胶,转膜。1∶200 稀释一抗(Caspase-3、Caspase-9、Bcl-2、Baxp53、p-p38)并将稀释液与转印膜共同孵育,室温2 h,取出转印膜,漂洗后,1∶800稀释二抗辣根过氧化物酶标记的羊抗兔IgG,并将稀释液与转印膜共同孵育,室温2 h;取出转印膜,漂洗,底物化学发光ECL显色。将胶片拍照,应用FluorChenm Q蛋白印迹成像和定量分析系统(美国Alpha)分析目标条带和内参条带光密度值,目的蛋白相对含量=目的蛋白光密度值/GAPDH光密度值。
1.2.4 流式细胞术检测细胞凋亡 Annexin VFITC/PI双染色法检测乳腺癌细胞凋亡和细胞周期。MCF-7细胞培养在6孔板至70%~80%的融合,分别用黄芩苷(22.3μg/mL)、黄芩素(6.8μg/mL)及两者联合处理 12、24、48 h, 收集悬浮细胞 (1~5)×106/mL,PBS 洗 2 次, 加入 400 μL 1×Binding Buffer重悬细胞,然后加入5 μL Annexin V-FITC,混匀后室温避光孵育 15 min。 加 10 μL PI染色液(50μg/mL),混匀,避光放置5 min。30 min内流式细胞仪检测,以Annexin V-FITC+PI-作为细胞早期凋亡标志,计算各药物浓度下MCF-7细胞的凋亡率,凋亡率:凋亡细胞数/(凋亡细胞数十正常细胞数)×100%
1.3 统计分析
采用SPSSl6.0统计软件进行统计学分析,计量资料采用“”表示,多个均数间比较采用方差分析(析因设计资料方差分析和重复测量资料方差分析),多组间每两两比较采用SNK法,多组分别与一个对照组比较采用Dunnet-t法,P<0.05有统计学意义。
2 结果
2.1 MTT法检测黄芩苷、黄芩素对MCF-7细胞生长的影响
2.1.1 不同浓度黄芩苷、黄芩素对MCF-7细胞生长的影响 与空白对照组相比,单用黄芩苷或黄芩素作用MCF-7细胞的生长抑制率均增加,差异均有统计学意义(P<0.05)。随着黄芩苷或黄芩素药物作用浓度的增加,MCF-7细胞的生长抑制率逐渐增加,差异有统计学意义(P<0.05),当黄芩苷和黄芩素联合应用后细胞生长抑制率分别与相应的同浓度黄芩苷或黄芩素单独作用相比显著增加(P<0.05)。通过析因分析显示两者之间存在交互作用(P<0.05)。见表1。2.1.2 两者联合对MCF-7细胞生长的影响 黄芩苷、黄芩素及两者联合作用于MCF-7细胞24、48、72 h,分别测定细胞活力。黄芩苷或黄芩素单独作用及联台应用后细胞生长抑制率增加,且随作用时间的延长抑制率明显增加,尤以两者联合作用72 h对MCF-7细胞抑制最为明显。结果见表2。
表1 MTT法检测不同浓度黄芩苷、黄芩素对MCF-7细胞生长率的影响 (,n=10,%)

表1 MTT法检测不同浓度黄芩苷、黄芩素对MCF-7细胞生长率的影响 (,n=10,%)
注:不同浓度黄芩苷间比较*F=12.004,P=0.000;不同浓度黄芩素间比较*F=21.939,P=0.000;黄芩苷与黄芩素交互作用F=1.725,P=0.041。
黄苓素*(μg/mL)黄苓苷(μg/mL)#0 0 6.8 13.5 27.0 54.0 5.4±4.0 13.9±6.8 29.1±14.4 53.8±13.0 57.4±9.6 22.3 17.7±7.5 41.3±15.7 51.9±18.0 57.6±17.3 59.1±22.9 33.5 27.4±10.3 43.2±16.4 52.5±17.7 56.7±18.7 59.9±20.7 44.6 39.4±13.7 48.5±19.9 55.3±20.5 59.4±20.9 59.3±23.5 89.3 50.6±15.4 56.8±21.4 57.6±20.7 60.0±20.9 60.5±22.9
表2 MTT法检测黄芩苷、黄芩素对MCF-7细胞生长抑制率的比较 (n=10,,%)

表2 MTT法检测黄芩苷、黄芩素对MCF-7细胞生长抑制率的比较 (n=10,,%)
注:不同组别间比较*F=69.117,P=0.000;不同时间点间比较#F=25.055,P=0.000。
时间点#组别*空白对照黄芩苷黄芩素两者联合24 h 6.8±3.1 7.6±4.0 9.4±4.7 19.6±7.1 48 h 4.3±2.4 9.8±4.7 12.5±5.3 35.2±10.3 72 h 5.4±3.2 17.7±6.6 13.9±7.2 41.3±12.8
2.2 黄芩苷、黄芩素对MCF-7细胞相关蛋白质表达影响的比较
与空白对照组比较,黄芩苷或黄芩素单用组Caspase-3、Caspase-9、Bcl-2、Bax、p53 等各蛋白表达水平均无显著性差异,而在两者联合组观察到Capase-3、Caspase-9、Bax和p53的蛋白表达明显增高,同时有Bcl-2水平下降。在p-p38测定中可观察到与空白对照组相比,黄芩苷或黄芩素单用组有表达增多的现象,而当两者联合时p-p38的表达增加超过2倍以上,显著高于黄芩苷、黄芩素单独作用组(P<0.05)。 结果见表 3。
表3 黄芩苷、黄芩素对MCF-7细胞蛋白表达影响的比较 (n=10,)

表3 黄芩苷、黄芩素对MCF-7细胞蛋白表达影响的比较 (n=10,)
注:与空白对照组比较*P﹤0.05,与两者联合组比较#P﹤0.05。
组别空白对照黄芩苷黄芩素两者联合Caspase-3 0.01±0.00 0.05±0.01 0.02±0.00 0.65±0.09*Caspase-9 0.02±0.00 0.03±0.00 0.05±0.01 0.68±0.08*Bcl-2 1.00±0.00 0.92±0.08 0.98±0.06 0.55±0.02*Bax 1.00±0.00 1.02±0.05 1.07±0.07 1.50±0.17*p53 1.00±0.00 0.98±0.11 0.97±0.10 1.35±0.14*p-p38 1.00±0.00 1.30±0.09#1.50±0.12#2.75±0.19*
2.3 流式细胞术检测黄芩苷、黄苓素联用对MCF-7细胞凋亡率的比较
流式细胞术分析黄芩苷 (22.3μg/mL)、 黄芩素(6.8μg/mL)和黄芩苷(22.3μg/mL)+黄芩素(6.8μg/mL)联合作用于MCF-7细胞12、24、48 h后细胞凋亡情况。黄芩苷或黄芩素单独作用48 h,分别只有2.75%和5.25%的MCF-7细胞发生凋亡,而两者联合48 h MCF-7细胞凋亡率为分别两者单用的3.8倍和7.3倍。两者联合在24 h和48 h后MCF-7细胞凋亡率是12 h的94.38倍和154.9倍(结果见表4)。
表4 流式细胞术检测黄芩苷、黄苓素联用对MCF-7细胞凋亡率的比较 (n=10,,%)
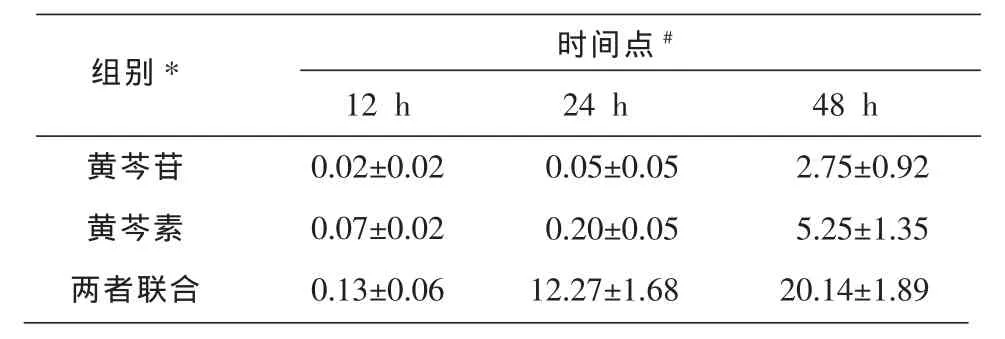
表4 流式细胞术检测黄芩苷、黄苓素联用对MCF-7细胞凋亡率的比较 (n=10,,%)
注:不同组别间比较*F=734.692,P=0.000;不同时间点间比较#F=718.185,P=0.000。
时间点#组别*黄芩苷黄芩素两者联合12 h 0.02±0.02 0.07±0.02 0.13±0.06 24 h 0.05±0.05 0.20±0.05 12.27±1.68 48 h 2.75±0.92 5.25±1.35 20.14±1.89
3 讨论
细胞死亡通常表现为两种形式:凋亡和坏死,凋亡代表“积极”的程序性细胞死亡,而坏死代表“消极”的细胞死亡。目前诱导癌症细胞的凋亡已成为抗癌治疗的一个关键策略。
研究中发现黄芩苷或黄芩素单独作用于MCF-7细胞均能产生明显的抑制作用,且细胞的生长抑制呈现浓度依赖性,这与以往的前列腺癌和膀胱癌[4]的研究结果基本一致。值得注意的是,与黄芩苷或黄芩素单独作用相比,黄芩苷和黄芩素联合应用更能显著增加对细胞生长的抑制作用。本研究通过析因分析(见表1)进一步发现黄芩苷22.3μg/mL和黄芩素6.8μg/mL最低有效浓度联合应用既能最大限度地抑制细胞生长,相比于其他更高浓度的联合组,其细胞生长抑制率差异没有统计学意义。故本研究选择黄芩苷(22.3μg/mL)和黄芩素(6.8μg/mL)的最低有效浓度联合应用进行后续的实验,以探索两者联合应用的作用机制。
既往研究显示,黄芩提取物成分黄酮类化合物(包括黄芩苷和黄芩素)对乳腺癌细胞的生长具有抑制作用[3]。国内徐维恒等[4]报道黄芩素能抑制MCF-7细胞的增殖,诱导细胞凋亡的发生。我们的研究中联合了黄芩苷和黄芩素,以了解联合应用的效果。通过流式细胞术对MCF-7的细胞在不同时间点的凋亡率分析,发现黄芩苷和黄芩素联合应用48 h与单用黄芩苷或黄芩素相比,凋亡率分别增加了约10倍或4倍。
通常细胞凋亡包括死亡受体途径、线粒体途径和内质网途径。其启动涉及多种外界因素及调节机制。虽然其详细机制还未完全阐明,但各种凋亡途径最终都汇聚于半胱天冬蛋白酶(Caspase)家族。细胞凋亡的过程实际上是Caspase不可逆有限水解底物的级联放大反应过程。近年的研究表明,通过激活Caspase信号转导级联反应通路能诱导细胞凋亡的发生[5]。黄芩苷和黄芩素联合应用48 h诱导MCF-7细胞中Caspase-9和Caspase-3的表达。结果表明,Caspase-9和Caspase-3可能是作为黄芩苷、黄芩素联合诱导的细胞凋亡机制而被激活。
线粒体途径的Bcl-2蛋白的过度表达可能导致细胞质凋亡途径的抑制作用。促凋亡Bcl-2[6]家族成员(如Bax)与抗凋亡Bcl-2家族成员的比例增加,在线粒体外膜的孔隙形成,释放凋亡线粒体蛋白,激活半胱天冬酶和诱导细胞凋亡。研究发现,与黄芩苷或黄芩素单独作用相比,黄芩苷和黄芩素的联合应用后Bcl-2表达降低,Bax蛋白表达增加。说明两者联合诱导的细胞凋亡不仅涉及线粒体途径,也通过上调Bax和下调Bcl-2起作用。
p53基因是癌症中最常见的突变基因,其功能作为一个转录因子在细胞凋亡中调控下游基因。已有报道,MCF-7细胞诱导p53依赖的凋亡[7]。本研究中,黄芩苷、黄芩素联合应用上调p53蛋白水平,表明p53参与了两者联合诱导的细胞凋亡过程。
与黄芩苷或黄芩素单独作用相比,黄芩苷和黄芩素联合应用增加MCF-7细胞的凋亡,且诱导的细胞凋亡与 Caspase-3、Caspase-9、Bcl-2、Bax、p53 有关。已有报道,黄芩苷诱导细胞凋亡涉及MCF-7细胞中Bax和p53蛋白表达上调[8]。研究中我们用最低浓度的黄芩苷或黄芩素单独作用,不引起明显的细胞生长抑制,而两者联合应用却明显增强。且无论是22.3μg/mL 黄芩苷或是 6.8μg/mL 黄芩素都不能单独明显改变某些凋亡相关蛋白的表达。
p38 MAPK参与调控细胞对应激和细胞因子的应答。在许多肿瘤细胞中通过MAPK信号通路调节细胞存活和凋亡而发挥抗癌的特性。有报道称,黄芩素的作用涉及p38 MAPK。然而,MCF-7细胞中黄芩苷和黄芩素联合应用是否也通过p38 MAPK机制的研究尚不清楚。研究结果提示,通过p38 MAPK信号通路黄芩苷和黄芩素的结合增加了细胞凋亡。在MCF-7细胞中黄芩苷和黄芩素的联合诱导出黄芩苷或黄芩素单独作用所未能诱导出现的某些凋亡蛋白。
当两种药物产生类似疗效时,与单个药物疗效简单之和相比,它们的联合作用会产生更大的效果。药物联合的效果可能取决于药物间的相互作用。研究发现黄芩苷或黄芩素单独作用p53、Caspase-9、Caspase-3和Bcl-2、Bax的水平均未发生明显改变,提示在低浓度下两种单体成分对这些凋亡相关蛋白的作用微弱。但当黄芩苷和黄芩素联合作用时,这些蛋白的表达上调或下调,提示两者联合的作用机制产生变化,这为研究抗癌药物提供了新的可行有效的途径。
总之,黄芩苷联合黄芩素应用通过p38 MAPK信号通路增强了MCF-7细胞凋亡。激活Caspase-9和Caspase-3,下调Bcl-2和上调p53和Bax的表达,从而产生抑制肿瘤细胞的作用,为临床治疗提供了新的思路和依据。
[1]Tessari A,Palmieri D,Di Cosimo S.Overview of diagnostic/targeted treatment combinations in personalized medicine for breast cancer patients[J].Pharmgenomics Pers Med,2013,12(7):1-19.
[2]Kim SJ,Lee SM.Effect of baicalin on toll-like receptor 4-mediated ischemia/reperfusion inflammatory responses in alcoholic fattyliver condition[J].Toxicol Appl Pharmaco,2012,258(1):43-50.
[3]Parajuli P,Joshee N,Rimando AM,et a1.In vitro antitumot mechanisms of various scutellaria extracts and constituent flavonoids[J].Planta Med, 2009,75(3):41-48.
[4]徐维恒,肖 雷,马宜明.黄芩素对乳腺癌细胞 MCF-7和MDAMB-231 增殖的影响[J].中国药师,2011,14(1):26-28.
[5]Yu SS,Spicer DV,Hawes D,et al.Biological effects of green tea capsule supplementation in presurgery postmenopausal breast cancer patients[J].Front Oncol,2013,13(3):291-299.
[6]Martin LA,Dowsett M.BCL-2:a new therapeutic target in estrogen receptor-positive breast cancer[J].Cancer Cell,2013,24(1):7-9.
[7]Tokgun O,Akca H,Mammadov R,et al.Convolvulus galaticus,Crocus antalyensis,and Lilium candidum extracts show their antitumor activity through induction of p53mediated apoptosis on human breast cancer cell line MCF-7 cells[J].J Med Food,2012,15(11):1 000-1 005.
[8]Kong W,Jiang X,Mercer WE.Downregulation of Wip-1 phosphatase expression in MCF-7 breast cancer cells enhances doxorubicin induced apoptosis through p53 mediated transcriptional activation of Bax[J].Cancer Biol Ther,2009,8(6):555-563.
(本文编辑 杨 瑛)
Effect and Mechanism of Baicalin and Baicalein Induced Cell Apoptosis in Breast Cancer Cells
WANG Ting1,2, HUANG Lizhong1*,XIA0 Yujie1, LUO Yong2, WU Shuanghua2
(1.College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine,Changsha,Hunan 410208,China; 2.Central Hospital of Zhuzhou,Zhuzhou,Hunan 412007, China)
Objective To study the breast cancer cell apoptosis is induced by the combination therapy of baicalin and baicalein and its related mechanism.Methods Different concentrations of baicalin,baicalein and combined effects of the two drugs in breast cancer MCF-7 cells,testing drugs on breast cancer cell viability, apoptosis and apoptosis-related protein expression.Results Baicalin or baicalein acting on the breast cancer cells,cell growth inhibition was significantly higher(P<0.05);compared with baicalin or baicalein alone,the combination treatment with baicalin and baicalein significantly enhanced the anti-proliferative effect(P<0.05).Cell apoptosis was significantly increased after treating with baicialin or baicalein especially the combination of baicalin and baicalein.Western blot analysis revealed that the expression of Caspase-3,Caspase-9,Bax and p53were increased.Meanwhile,the level of Bcl-2 expression was decreased.Moreover, the activation of p-38 were increased.Conclusions Baicalin and baicalein could induce the apoptosis of breast cancer cells alonely, while the effects significantly enhanced after the combination with baicalin and baicalein.This mechanism may be related with the drugs activate the expression of apoptosis-related protein Caspases-3,Caspase-9,Bax and p53, down-regulate the level of Bcl-2, and inhibit the expression of anti-apoptotic protein Bcl-2.
baicalin; baicalein; combination therapy; breast cancer; cells apoptosis
R285.5
A
10.3969/j.issn.1674-070X.2014.05.006.023.05
2013-10-08
高等学校博士学科点专项科研基金资助课题(20114323110006);湖南省高校创新平台开放基金(湘财教指[2009]70号-09k058)。
王 婷,女,博士研究生,主治医师,研究方向:中西医结合肿瘤学。
*黄立中,男,教授,博士研究生导师,E-mail:hlz992002@163.com。

