某市药品生产企业质量管理中存在的问题及对策
王全领(安徽砀山县食品药品监督管理局,安徽砀山 235300)
某市药品生产企业质量管理中存在的问题及对策
王全领*(安徽砀山县食品药品监督管理局,安徽砀山 235300)
目的:探讨药品生产企业质量管理中存在的问题,并提出相应的对策。方法:采用问卷调查的方式,对某市7家药品生产企业的基本情况、人员资质、检验仪器设备、质量控制等方面进行调查,并对相关数据进行统计汇总,分析其存在的问题。结果与结论:所调查的7家企业共有36条生产线、263个药品批准文号、1 268名职工。7家企业中,质量管理人员大专以上学历者占61.9%,质量检验人员大专以上学历者占36.4%;质量管理和检验人员工龄结构较合理,10年以下和10年以上各占50%左右。部分企业检验仪器设备不能满足现实要求,需要委托检验。各企业基本能按《药品生产质量管理规范》的要求对纯化水、注射用水系统及洁净室的洁净度定期进行监测。但各企业发展不均衡,人员素质有待提高,检验能力参差不齐,监管机制和法规体系不完善。建议企业应强化培训,不断提高质量管理和检验人员专业水平,并及时购置相关检验仪器设备;政府相关部门应完善监管机制,健全法规体系,强化技术监督,提高监管水平,确保药品质量。
药品生产企业;质量管理;质量检验
我国2010年版《药品生产质量管理规范》(GMP)[1]明确规定,药品生产企业应当建立药品质量管理体系,确立符合药品质量管理要求的质量目标,配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。由此可见,质量管理是药品生产企业的核心工作之一,是确保药品质量的前提条件。药品生产企业的质量管理体系包括质量保证(QA)和质量控制(QC)两大部分。近年来发生的诸如“齐二药”“欣弗”“铬超标胶囊”等事件,暴露出药品质量管理中尚存在一些问题。为了全面了解药品生产企业的质量管理和检验现状,发现存在的问题,探讨药监部门如何进一步加强监管,促进企业质量管理部门切实发挥应有的作用,笔者对某市药品生产企业的质量管理和检验情况开展了调研与分析,并提出了一些建议,供业界参考。
1 资料与方法
1.1 资料来源
本研究资料由该市的7家药品生产企业提供,其质量管理涉及的人员、设施、设备及相关统计数据截至2012年10月。由于涉及到被调查企业的商业信息,应企业要求,本研究对上述药品生产企业的所在地及名称不予公开。
1.2 方法
成立调研小组,制订关于药品生产企业基本情况、人员资质、检验仪器设备、质量控制等方面的调查表,采用问卷调查的方式,对7家药品生产企业质量管理和检验情况进行调查,并以电话询问和现场座谈的方式对有关情况进行核实。通过Excel和Access对以上数据进行处理并统计分析。
2 结果
2.1 7家药品生产企业的基本情况
所调查的7家药品生产企业中,原料药、制剂、中药饮片生产企业6家,医用氧生产企业1家。共36条生产线,拥有药品批准文号总数263个,常年生产的品种48个,年均生产药品4 504批次,生产涉及原料药品种106个,生产涉及药用辅料品种86个。7家药品生产企业的基本情况统计见表1。
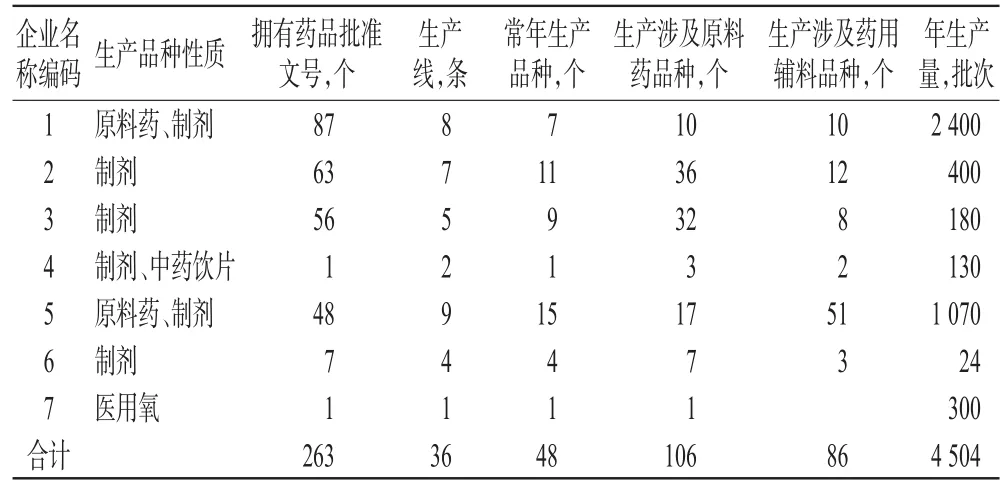
表1 7家药品生产企业的基本情况统计Tab 1 Basic situation of 7 pharmaceutical manufacturers
2.2 7家药品生产企业质量管理和检验人员基本情况
7家药品生产企业质量管理和检验人员基本情况见表2;质量管理和检验人员学历、职称、专业构成情况见表3;质量管理及检验人员工龄构成情况见表4。

表2 7家药品生产企业质量管理和检验人员基本情况Tab 2 Basic situation of qualitymanagement and inspection staff in 7 pharmaceuticalm anufacturers
从表2~表4可以看出,7家药品生产企业质量管理和检验人员在企业中所占比例还是较小的,这说明企业对质量管理和检验工作重视不够。质量管理人员资质大多数为药学相关专业(医用氧生产企业除外),且大专以上学历者占61.9%(13/21)。从事质量检验的人员学历普遍较低,大专以上学历者仅占36.4%(20/55)。这可能与质检岗位的工作性质有关,质检工作只需要按照质量标准和标准检测方法按部就班地操作,创造性的工作较少。同时,单位领导对质检人员的职称评定工作也不够重视,且其工资与职称也不挂钩。但这就为制订和修订物料、中间产品和成品的内控标准和规范检验、保证产品质量埋下了安全隐患。上述企业中质量管理和检验人员工龄结构较合理,10年以下和10年以上的基本各占一半,这表明人员流动基本稳定,不像其他岗位和行业人员流动频繁。

表3 质量管理和检验人员学历、职称、专业构成情况Tab 3 The composition of education background,professional title and specialty of quality m anagem ent and inspection staff

表4 质量管理及检验人员工龄构成情况Tab 4 The com position of the length of service among qualitym anagem entand inspection staff
2.3 6家药品生产企业检验仪器设备基本情况
6家药品生产企业主要检验仪器设备情况见表5;6家药品生产企业委托检验情况见表6(表中,“-”表示厂家无需委托检验或无需对应项目的委托检验;第7家企业为医用氧企业,不涉及相关项目,不予统计)。
从表5、表6可见,部分企业检验仪器设备不全,不能满足生产的需要,需要委托检验,只有高效液相色谱仪各家制剂企业均有配置。部分厂家缺少的仪器主要有:原子吸收分光光度计、红外分光光度计、气相色谱仪等。有些企业(如企业2)虽然有气相色谱仪,但由于缺乏配套仪器及试剂,并没有自行检测,而是委托给了其他企业检验。另外,6家药品生产企业中,由于无一家企业设置实验动物房,因此所涉及的动物实验均需委托检验。在“铬超标胶囊”事件发生后,大多胶囊剂生产企业均配置了原子吸收设备。2011年3月颁布的GMP新增的第十一章“委托生产与委托检验”,提出了药品委托生产的范围和所有活动,均应符合GMP和相关药品安全监管和注册的要求。该规范首次从技术管理角度提出药品委托生产和委托检验的基本控制原则,明确了委托双方的责任、技术事项,有利于促进药品委托生产和委托检验的受托方确保持续稳定地生产出符合预订用途和注册要求的药品[2]。
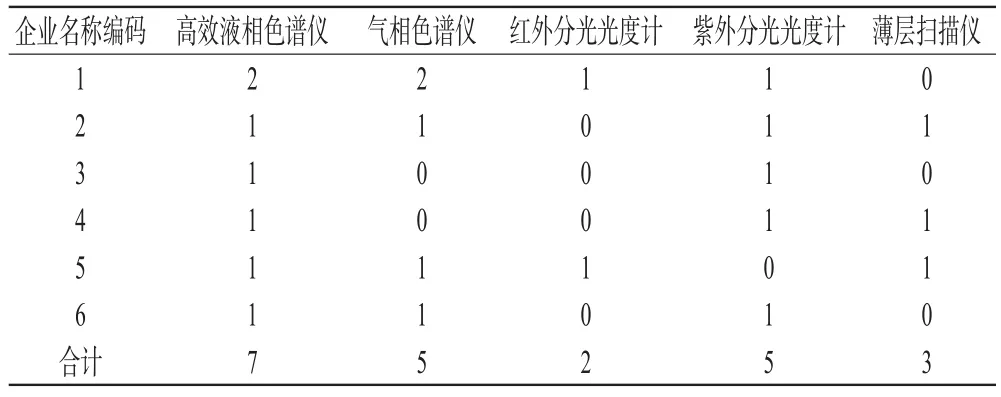
表5 6家药品生产企业主要检验仪器设备情况Tab 5 The situation of main inspection equipm ents in 6 pharm aceuticalmanufacturers

表6 6家药品生产企业委托检验情况Tab 6 The situation of entrusted inspection in 6 pharmaceuticalmanufacturers
2.4 6家药品生产企业质量监控工作基本情况
制水系统和洁净室质量监控情况见表7;洁净室质量监控情况见表8。

表7 制水系统和洁净室质量监控情况Tab 7 The quality monitoring of water system and clean room
从表7、表8可见,各企业基本能按GMP的要求对纯化水、注射用水系统及洁净室的洁净度定期监测,并达到要求。不同的是,质量管理较好的企业工作做得更实在和严谨,个别企业工作流于形式。
3 讨论
3.1 企业质量意识淡薄,人员素质有待提高
质量管理和检验人员是把好药品质量关的关键责任人。但部分企业负责人自身未经药品法律法规以及GMP方面的专门培训,对药品质量管理和检验工作的重要性认识不足。对人员和仪器设备配置不够,不能满足要求[3]。调查发现,企业负责人往往将药品生产和销售放在第一位,当质量和市场、质量和经济效益发生矛盾时,企业决策者往往对管理人员或检验人员按规定做出的结论不予采纳,以牺牲质量来获取暂时的效益。有些企业人员准入把关不严,导致检验人员专业水平低、技术能力较差[4]。还有些企业从事药品质量检验的人员专业技术培训、考核制度不够健全。各级各类人员基础知识培训未到位,有些方面的培训还有盲点,如仪器、菌检等方面问题操作人员不能正确回答。培训大多采用答卷形式,得分普遍偏高,工作流于形式。

表8 洁净室质量监控情况Tab 8 The qualitymonitoring of clean room
因此,企业应从小处着手,从点滴做起,加强基础管理,提高全员素质。一要加强质量法制和质量意识教育。结合本厂的实际情况,认真贯彻并组织实施《中华人民共和国药品管理法》、GMP等法律法规,以适应新形势下药品监督管理的要求。加强质量管理知识的培训和岗位操作技术培训,对新聘用人员进行岗前培训,对洁净区的所有人员(包括维修、辅助人员)应进行洁净区管理、卫生知识、微生物知识等内容的培训,并对各种培训定期考核及建立教育档案,以此提高人员素质,端正职工的整体行为。二要加大考核力度。严格执行责权分明的质量责任制,做到执行人员到位、管理制度到位、岗位责任到位,加大质量考核力度,做到有据可依、违规必究,杜绝管理漏洞,保证药品质量。三要严格执行药品检验标准。药品生产企业必须贯彻“标准就是法规”的思想,对原材料、中间体、终端产品制订相应的质量标准。在生产过程中,也应制订并严格遵守操作规范,严格执行验收标准,保证产品质量。四要开展规范实验室和规范实验动物房建设。实验动物在药品生产企业中作为原材料和药品质检手段以及用于新药研究,有着重要的作用,加强药品生产企业实验动物管理将促进医药工业发展。
3.2 企业发展不均衡,检验能力参差不齐
企业检验所需的人员和设施、设备和企业的经济效益高度相关。一方面是效益差的企业检验能力有限,难以满足药品生产的需求;另一方面,发展良好的企业检验能力却高度过剩。由于受传统思维的束缚,许多实验室的能力并未被充分开发和合理利用,尤其是药品生产企业强制通过GMP认证之后,由于重复建设导致4 000多家企业生产和检验能力严重过剩,资源闲置、浪费现象严重。如果药品生产企业的检验实验室积极参与实验室认可,这些检验实验室就可向第二方实验室转变。利用好自身优势,将闲置的资源充分运用起来,面向市场,转变观念,提高自身的检验质量,甚至可进一步向第三方实验室转化。在提高检验质量和能力的同时,演变成为独立的权威检验机构,为市场提供更高质量的服务,优化配置全行业和全社会的实验室资源,借此实现实验室质量管理水平的一次飞跃,完善药品检验工作质量。这对于保障人民的安全用药有重大意义[5]。
3.3 监管机制和法规待完善
药品生产企业管理、检验人员的监管机制需进一步完善,监管手段有待改进。目前,药品监管部门虽然对企业质量和生产负责人及部门负责人进行备案管理,但还缺少相应的罚则,经常出现人员已发生变化但企业并未及时向监管部门报告的情况。同时,由于没有明确的管理依据,对企业质量检验人员也无法进行审核管理,导致非药学专业或素质较低的人员进入质量检验队伍,造成企业质检水平参差不齐。药品监管相关法律法规不够完善。首先,《中华人民共和国药品管理法》[6]、GMP等法律法规对从事药品质量检验工作的人员未明确规定准入资格,如学历、职称、上岗资格等,未明确规定人员数量或所占比例,且对出具虚假报告书应承担的责任也未进行明确规定。对质量和生产负责人及部门负责人虽然规定了学历,要求有实践经验,但在法律法规培训、在岗情况、不良行为处理等方面均未作硬性规定。我国现行的GMP和美国的动态药品生产管理规范(cGMP)还有一定差距,不仅表现在法律效力上,而且表现在内容方面,美国的cGMP更注重现场检查、现场动态控制和过程控制,而我国的GMP认证更注重静态认证;还有就是更新机制上,我国的GMP缺乏系统的更新制度,是一种随机的行动,缺乏动力,而美国的cGMP是主动地吸取优秀企业的做法,逐步推广。建议国家药品监督管理部门建立定期修订GMP的机制,使之逐步与国际接轨,也能不断激励药品生产企业生产出质量更卓越的产品[7]。
3.4 药品质量控制机制待加强
要建立和完善药品生产企业质量责任控制体系。一是要认真做好药品生产企业质量管理和检验人员的岗位培训和备案工作。加强对涉药单位法人和质量负责人的法律培训,做到每年至少培训1次,逢训必考。同时,建立企业主要负责人的学法、守法档案,并把对药品生产企业药品质量管理人员、检验人员的培训工作做到规范化、制度化。只有企业自身员工的业务素质,特别是质量管理人员和检验人员的业务素质提高了,才能从源头上保障出厂药品的安全、有效。二是要督促药品生产企业建立质量承诺制,公开向消费者和服务对象进行质量和经营行为的承诺,并建立企业生产质量管理负责人责任追究制,进一步强化药品生产企业依法生产的自律意识,建立行业自律机制。三是要对质管人员全面登记,建立辖区内各药品生产企业质量管理和检验人员档案,并经常检查质量管理和检验人员的在位情况,及时掌握其动向。应进一步明确质量管理的终极目标是达到“用户需求的质量”,而不是为了“过关、达标、免责”或“应付评估、检查、认证”。也就是说,要让产品质量在循环中提高,改进产品质量的关键就是树立改进产品质量形成过程的观念[8]。
3.5 加强技术监督,提高监管水平
要充分发挥技术支撑的作用,加强药品的质量监督。技术监督是药品质量管理的重要内容。仅靠每年几次的例行药品抽验,是无法实现技术监督的效果的。应加强对药品生产企业各个环节的监督,督促药品生产企业严格按照国家标准组织生产,加强对药品生产企业检验工作的业务指导,加大对药品生产企业购进原辅料和药品出产前检验的监督检查力度。要不断加强监管人员的业务素质建设。药品生产监管是一项专业性和技术性很强的工作,同时药品生产者依法制药也是对行政执法人员依法行政能力的考验。这就要求药品监管工作者既要有丰富的业务知识,又要有较强的法律法规知识。因此,执法人员首先要加强药品生产专业知识的学习,只有具备一定的专业知识,才能有效地开展监督;其次,执法人员要熟练掌握国家有关药械政策及相关法律法规,尤其是GMP认证规范的要求,这样监管工作才能做到有的放矢;还要提高开拓创新能力,积极推进监管体制创新、监管方法创新和监管制度创新。
4 结语
GMP在我国开展的时间虽然较短,但整体水平的提升却非常显著。2010年版GMP实施以来,已有近700家企业或独立车间通过了认证,更多药品生产企业仍在认证的准备之中[9]。按照国家食品药品监督管理总局的要求,我国的药品生产企业均要于2015年12月31日前通过2010年版GMP的认证[10]。目前,上述7家药品生产企业仅有3条生产线通过认证,这也是中西部经济欠发达地区药品生产企业发展的缩影。2010年版GMP的全面实施任重而道远。
[1] 卫生部.药品生产质量管理规范:2010年修订版[S].2011-01-17.
[2] 李晓红,袁志江.浅谈我国药品生产企业委托生产的管理[J].中国药事,2012,26(10):1 091.
[3] 范新玉,付晓玲,涂登云,等.2006年滁州市药品、医疗器械、药包材生产企业检验部门现状调研[J].安徽医药,2008,12(2):187.
[4] 罗兰,高宏亮.制药企业药品质量检验工作中的问题不容忽视[J].食品药品监管,2007,16(10):13.
[5] 韦晟,顾新.实验室认可:提升企业药品检验能力的重要途径[J].中国药房,2008,19(7):486.
[6] 中华人民共和国主席令.中华人民共和国药品管理法[S]. 2001-02-28.
[7] 田云,杨世民.美国药品生产科学及对我国药品生产质量管理的启示[J].中国药房,2007,18(16):1 206.
[8] 许敏.药品生产企业质量管理体系现状分析及改进思路[J].中国药事,2012,26(1):92.
[9] 吕锐.在药品GMP实施中运用质量风险管理的探讨[J].中国药事,2013,27(10):1 097.
[10] 国家食品药品监督管理总局.关于贯彻实施《药品生产质量管理规范(2010年修订)》的通知[EB/OL].(2011-02-25)[2014-02-20].http://www.sda.gov.cn/WS01/CL0844/59017. htm l.
Problems and Countermeasures of Quality M anagement in Pharmaceutical M anufacturers from a City
WANG Quan-ling(Dangshan County Food and Drug Administration of Anhui Province,Anhui Dangshan 235300,China)
OBJECTIVE:To discuss the problems of quality management in pharmaceuticalmanufacturers and put forward the corresponding countermeasures.METHODS:By questionnaire survey,7 pharmaceuticalmanufacturers were investigated in terms of basic situation,personnel qualification,test equipment,quality control,etc.The relevant data were summarized statistically to analyze its problems.RESULTS&CONCLUSIONS:7 included enterprises own 36 production lines,263 drug approval number and 1 268 employees in total.There were 61.9%of quality management staffs w ith college degree or above and 36.4%of quality inspection staffsw ith college degree.Quality management and inspection personnel aremore reasonable in structure of length of service,less than 10 years and more than 10 years of length of service accounted for 50%,respectively.Inspection equipment can not meet the practical requirements in part of enterprises,and quality inspection should be entrusted to other companies.Each enterprise can regularly monitor purified water,water for injection system and clean class of clean room according to the requirements of GMP.But there still are some problems,such as unbalanced development,low quality of personnel,uneven inspection ability and not perfect regulations and supervision system.It is suggested to strengthen the training,constantly improve the quality management and the skill of inspection personnel and timely purchase related inspection equipment.Relevant government departments should improve the regulatory mechanism,perfect laws and regulations system,strengthen supervision and improve the supervision level to ensure the quality of drugs.
Pharmaceuticalmanufacturers;Quality management;Quality inspection
R95
A
1001-0408(2014)17-1561-04 DOI 10.6039/j.issn.1001-0408.2014.17.08
*主管药师。研究方向:药品监管。电话:0557-8027571
2013-12-28
2014-02-25)
·医药热点·

