外泌体在疾病诊疗中的研究进展
刘艳华综述,王小中审校
(南昌大学第二附属医院检验科,江西南昌330046)
.综述.
外泌体在疾病诊疗中的研究进展
刘艳华综述,王小中审校
(南昌大学第二附属医院检验科,江西南昌330046)
外泌体是多种细胞主动分泌的直径为40~100 nm的囊泡,这些成分可以从多种体液中分离.外泌体含有蛋白质, mRNA,miRNAs等信号分子,它们反映分泌细胞的生理状态和功能状态,从而提供了丰富的潜在的生物标志物分子源.除了用于疾病诊断外,外泌体还具有抗肿瘤免疫,诱导肿瘤免疫逃逸、促进肿瘤血管新生和肿瘤转移等生理功能.本文主要对外泌体在疾病诊疗中的研究进展进行综述.
外泌体;生物标志物;MicroRNA;诊断;治疗
外泌体(Exosomes)是一种细胞主动分泌的大小均一,直径为40~100nm的脂质双分子层结构囊泡,可由树突细胞、淋巴细胞、血小板、肥大细胞、内皮细胞、成纤维细胞、间充质干细胞和肿瘤细胞等不同细胞类型脱落释放,在大多数体液如外周血、尿液、唾液、腹水、羊水、乳汁、脑脊液、关节液、支气管肺泡灌洗液等体液中可检测到[1].透射电子显微镜下外泌体观察常为杯状,但是在体液中通常为球形结构,在蔗糖溶液中的密度为1.13~ 1.19g/ml,其密度与细胞来源相关,并随蛋白含量而改变[2].不少实验证明外泌体可携带多种蛋白质、脂质、mRNA、miRNA,参与细胞通讯、细胞迁移、血管新生、免疫反应和肿瘤细胞生长等过程.然而,外泌体的发现虽有30多年历史,但其在疾病诊疗方面的研究还处在初级阶段.
1 外泌体的起源、结构及其生物学特性
1985年Pan等[3]通过电镜发现,在网织红细胞向成熟红细胞发育过程中,晚期胞内体可与细胞膜相融合释放其中大量的亚细胞囊泡结构,由于外泌体含有大量特异性的蛋白质及功能性的mRNAs、miRNAs,是细胞积极分泌的结构,与凋亡细胞分泌的小泡有着本质区别.外泌体的质膜含有丰富的胆固醇、鞘磷脂、神经酰胺、脂筏及磷脂酰丝氨酸.外泌体也含有与其来源细胞相类似的细胞因子、生长因子等蛋白质,以及脂质、编码或非编码RNA等生物活性物质,在细胞之间物质交换过程中具有重要作用.
几乎所有的外泌体都有微管蛋白、肌动蛋白结合蛋白、四跨膜蛋白.不同细胞来源的外泌体蛋白组成存在差异,但它们有着共同的蛋白质组分,包括膜转运和融合相关蛋白(Rab GTPases,Annexins,Flotillin等)、多囊泡胞内体产生相关蛋白(Alix, TSG101等)、分子伴侣(HSP70,HSP90)、整合素和四跨膜蛋白超家族(CD63,CD9,CD81,CD82等),这些成分反映了其生物起源[4,5].外泌体可通过受体依赖性调控机制直接刺激受体细胞,也可通过转运质膜受体、功能性蛋白、mRNA、miRNA和细胞器调控受体细胞[6].同时,外泌体可携带多种反映细胞来源的组织/细胞类型特异性蛋白,其蛋白成分也随来源细胞的不同而存在差异,如抗原提呈细胞分泌的外泌体质膜上含有MHC-I和MHC-Π共刺激蛋白CD80和CD86;来源于血小板的外泌体质膜上有血管性血友病因子和整合蛋白CD41a;T淋巴细胞分泌的外泌体表面含有穿孔蛋白和颗粒酶.外泌体中含有各种mRNA、miRNA及siRNA等,mRNA可以在受体细胞中翻译出相应的蛋白质,miRNA通过降解或者抑制mRNA的翻译来调控蛋白质在目标细胞中的表达,siRNA可以敲除受体细胞中的目标基因达到基因沉默的作用[7].
微泡(Microvesicles)是广泛存在于正常细胞和肿瘤细胞的胞外细胞器样结构,能运载多种特异性蛋白、微小RNA及DNA片段,在细胞间物质和信息转导中起重要作用.微泡可能含有多种亚型,包括外泌体、脱落小泡(shedding vesicles,SV)、分泌性微泡、膜颗粒及外泌体样小泡等,这些命名是否存在概念的重合尚不明确.外泌体是细胞经过"内吞-融合-外排"等一系列调控过程而形成的细胞外纳米级小囊泡,其膜上含有GPI铆定蛋白、CD63、TNFR1,其分泌主要依靠转运必需内吞体分选复合物,多数为持续性释放.然而,SV一般大于200nm,甚至超过1μm,无规则形状,含有收缩蛋白、金属蛋白酶及整合素,脂类成分以胆固醇为主,一般不会持续释放[8].
2 外泌体的提取和鉴定
外泌体提取的方法有离心法、过滤离心法、密度梯度离心法、免疫磁珠法和色谱法等[9],但没有一种方法能同时保证外泌体的含量、纯度、生物活性.离心法是外泌体提取常用的方法,得到的外泌体量多,但是纯度不足,而且这种物理作用可导致外泌体结构及大小的改变.过滤离心法是利用不同截留相对分子质量(MWCO)的超滤膜离心分离外泌体,这种操作简单、省时,不影响外泌体的生物活性,但分离的外泌体纯度也不足.外泌体目前广泛应用的提取方法是蔗糖密度梯度超速离心法,通过逐步去除细胞、细胞碎片,在高达100 000g离心力的情况下得到富含外泌体的沉积物,在蔗糖梯度液中将其中含有与外泌体非特异性结合的蛋白质、蛋白质聚集物等杂质超速离心进行进一步的纯化.此种方法分离得到的外泌体纯度高,但前期准备工作繁杂,耗时,量少.免疫磁珠法是利用包被有单克隆抗体的球型磁性微粒特异性结合靶物质得以分离外泌体,这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备,但是非中性pH和非生理性盐浓度会影响外泌体的生物活性,不便进行下一步的实验.另外,根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系,利用色谱法也可对外泌体进行分离,此法分离到的外泌体在电镜下大小均一,纯度高,但需要特殊的设备,应用不广泛.
外泌体是细胞内内溶酶体微粒内陷形成多囊泡体,并在刺激作用下多囊泡体与细胞膜融合向胞外分泌的大小均一,直径为40~100nm的囊泡,可以通过电镜进行观察;外泌体的特异性蛋白包括Alix、Flotillin-1、Lamp-1、Lamp-2、CD63和CD9等[10],可通过免疫印迹分析以及流式细胞仪进行鉴定.目前的实验技术主要依靠离心速率法来分离各类微泡,但物理作用能导致微泡结构及大小的改变,流式细胞仪可以同时检测物质的大小和密度,但300nm以下的囊泡无法被测到.微泡没有独特的表面标志物,其膜脂质成分、蛋白组成、密度也还需进一步检测.
3 外泌体在疾病诊断的研究进展
在疾病诊断方面,外泌体含有蛋白质,mRNA, miRNAs等信号分子,它们反映分泌细胞的生理状态和功能状态,甚至还会包含细胞病态相关的分子信息,从而提供了丰富的潜在的生物标志物分子源.临床研究已发现,不同疾病的不同类型细胞都能分泌含有RNAs的外泌体,这使得从人体体液中纯化外泌体,再对其RNA成分及序列分析成为可能,有望用于疾病诊断及监测,尤其在肿瘤标志物检测方面.外泌体作为生物标志物虽然还处于起步阶段,但随着进一步的研究,外泌体的临床应用可能会有良好的前景.
3.1 外泌体在肿瘤疾病诊断中的应用肿瘤是威胁人类健康和生存最主要的疾病之一,恶性肿瘤发病率和死亡率日趋增高,给社会和家庭带来沉重的经济和疾病负担.肿瘤在生长过程中会不断地将外泌体释放到周围环境中,外泌体含有miRNA,因此检测体液中的外泌体及外泌体RNA有助于肿瘤诊断和预后判断,Rosell等[11]对非小细胞肺癌的相关研究得出了相似的结果.miRNA不仅是遗传信息的内源性调控者,也是调节细胞通讯的分泌因子及疾病的生物标志物.miRNA作为一种在某些肿瘤中可能出现异常表达的非编码的RNAs,可以作为肿瘤诊断和预后判断的生物标志物[12].Taylor等[13]发现卵巢癌患者与正常人血液中外泌体的miRNA图谱有明显的差异,说明外泌体有助于卵巢癌的诊断;并且还发现从血清中分离出的肿瘤来源外泌体中的miRNA与卵巢癌组织中提取出的miRNA具有很好的相关性,以及患者组与正常对照组的miRNA图谱分析结果也显示出明显的差异.卵巢癌患者血清中的外泌体有8种miRNA显著增加[13],另外,也有研究[14]发现卵巢癌患者的腹水和血清中可检测到蛋白CD24和EpCAM的表达.
2008年Mitchell等[15]发现miR-141是前列腺癌的一个可靠的诊断标志物,且有研究[16]证明血清miR-141与miR-375水平与前列腺癌的肿瘤进展相关.Nilsson等[17]发现在前列腺癌患者尿中的外泌体有蛋白标记物5T4,前列腺癌基因-3(PCA-3)和mRNA(TMPRSS2-ERG)的表达存在,在前列腺癌患者尿外泌体中也检测到PSA和PSMA的表达,但它们在尿中表现出了极大的变异.另外,前列腺癌患者的尿中也有miR-107和miR-574-3p上调的实验研究[18],血浆中的外泌体均有存活素(Survivin),前列腺癌存活素的表达与健康者和良性前列腺增生相比上调了.经免疫印迹法和流式细胞仪分析[19],膀胱肿瘤细胞来源的外泌体在膀胱肿瘤中可能检测到蛋白质的阳性表达,其中重要的有外泌体中CD36,CD44的表达在健康和疾病状态有明显的差别.
CA19-9仍然是胰腺癌最可靠的诊断血清标记物,但可结合其他诊断工具,如胰腺癌患者血清miRNA可鉴别疾病是良恶性肿瘤还是炎症[14], Wang等研究[20]证实了胰腺癌血清中外泌体携带胰腺癌干细胞标记物.另外,外泌体miRNA也可作为肺癌的诊断标志物[21].Logozzi等[22]发现血浆外泌体中CD63+可作为黑色素瘤的蛋白标志物.胶质母细胞瘤患者血清中可检测到肿瘤特异性的表皮生长因子受体(EGFRⅧ)[23],血清miR-21在胶质母细胞瘤体中增加了40倍.
可见,临床分析证明外泌体对实体肿瘤如卵巢癌、前列腺癌、膀胱癌、胰腺癌、肺癌等有一定的作用,外泌体miRNA的数量可能与肿瘤的大小变化有关,肿瘤患者血清的外泌体数量可能也与肿瘤的分期、分级相关.靶向癌症的外泌体的标志物可能为肿瘤疾病的诊断和治疗提供新的指标和途径,对肿瘤高危人群早期诊断和早期治疗以降低或减缓肿瘤病例的发生发挥重要的作用.
3.2 外泌体在非肿瘤疾病诊断中的应用在过去几年,外泌体在肾脏疾病的研究越来越受到关注.尿中发现外泌体意义很大,尿样标本外泌体蛋白图谱分析可能具有相当重要的诊断提示作用.尿蛋白组学检查,包括游离蛋白和外泌体蛋白图谱检查,可以为多种疾病的诊断和鉴定提供了尿样标本生物标志物.研究人员发现[24]尿外泌体中的胎球蛋白-A在啮齿类动物的肾毒性暴露后几个小时内就升高了50倍,且在观察尿肌酐的变化之前胎球蛋白-A在急性肾损伤患者已明显升高.最近的一项研究[25]显示,相比局灶节段性肾小球硬化患者,微小肾脏病变患者糖蛋白B7-1在尿沉渣中mRNA比值增加了.也有研究[26]发现尿颗粒酶mRNA水平可能区分细胞排斥反应与急性肾损伤患者.
外泌体的分离可能会提高尿mRNA分析的灵敏度和精确度.研究发现[27]IgA肾病患者尿中几种miRNAs(miR-200a,miR-200b和miR-429)丰度的减少了,并且其减少的程度与疾病的严重程度相关.尿中外泌体和外泌体miRNA以及其定量PCR准确检测的稳定性,进一步支持其成为在肾脏病中潜在的非侵入性的生物标志物.分析尿样本中外泌体的蛋白图谱还可能协助肾脏疾病的诊断(表1)[28].

表1 与肾疾病相关的尿液外泌体蛋白质
目前研究发现羊水和乳汁等体液中检测到的外泌体也发挥一定的作用.Ke11er等[29]通过RTPCR分析羊水中的外泌体,发现外泌体存在编码ZFY(人类Y染色体的性别决定区编码一种锌指蛋白)的mRNA,可用于胎儿性别的判断.人乳汁提取的外泌体中含有59种与免疫功能相关的microRNA,占已经确定的免疫功能相关microRNA总量的67%[30].Welker等[31]研究表明血清外泌体中CD81在慢性丙型肝炎患者中表达升高,并且其与炎症纤维化的严重程度相关,提示外泌体CD81可能是丙型肝炎诊断一个潜在的蛋白标志物.外泌体还可以运载很多与神经系统疾病相关的microRNA成分(表2)[32].
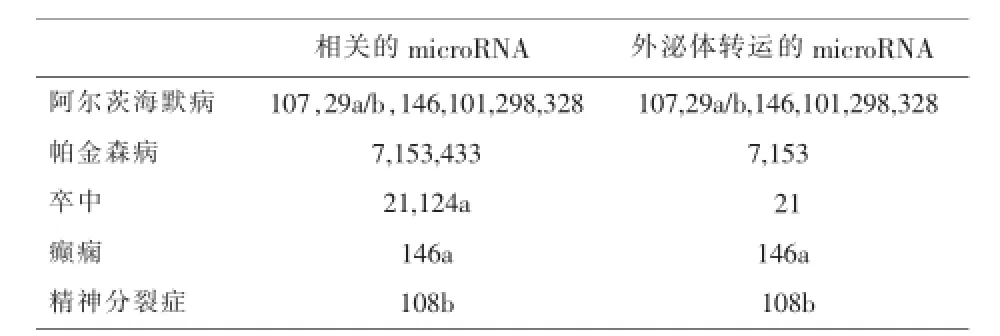
表2 神经系统疾病相关microRNA在外泌体中的分布
总之,外泌体可以作为蛋白质和RNA的生物标志物的来源.外泌体存在于许多体液中,如血清、尿液、唾液、腹水、羊水、乳汁等,获取方便,由于其标记蛋白以及miRNA的选择性富集,使外泌体成为一种非常有吸引力的非侵入性的疾病诊断手段.
4 外泌体在疾病治疗的研究进展
4.1 外泌体在肿瘤疾病治疗中的研究进展外泌体作为一种新型的非细胞肿瘤疫苗,国内外学者进行了大量的相关研究.自从1998年Ziwogel等[33]首先使用树突状细胞来源的外泌体(Dexo)作为肿瘤疫苗,在动物模型中应用负载肿瘤抗原的Dexo使荷瘤小鼠肿瘤得以消退后,树突状细胞来源的外泌体(Dexo)和肿瘤细胞来源的外泌体(Texo)的抗肿瘤免疫作用得到了深入的研究,其中部分研究已进入I期临床试验阶段.前者主要通过刺激T细胞的体外增殖分化来诱导体内的抗肿瘤免疫效应,后者通过抗原提呈细胞交叉呈递给细胞毒性T淋巴细胞(CTL),使其产生肿瘤杀伤作用.研究[34]显示,从骨髓瘤细胞系J558分离的Texo表达P1A肿瘤抗原,能够诱导抗J558肿瘤作用,使得80%的免疫小鼠获得抗肿瘤免疫保护,同样自体及异基因含有MUC1肿瘤抗原的Texo,能诱导CTL效应并能抑制表达MUC1肿瘤细胞的生长.王丽英等[35]利用负载乳腺癌抗原脐血Dexo,促进同种异体T细胞增殖,并能诱导特异性抗乳腺癌的免疫效应.陈绍倩等[36]研究表明人白血病细胞株K562细胞分泌的外泌体及K562细胞总RNA刺激人Dexo能够诱导出K562细胞特异性CTL效应,发挥特异性抗白血病细胞的免疫反应.
目前有大量研究表明外泌体具有抗肿瘤免疫的作用,但外泌体在肿瘤免疫逃逸中作用的研究也比较多.有研究报道,肿瘤细胞来源的外泌体可以通过表达FasL来诱导CD8+T细胞凋亡,导致肿瘤的免疫逃逸.Clayton等[37]的一项研究表明,外泌体可以选择性地抑制白细胞介素-2(IL-2)的功能,使其只发挥促进调节性T细胞的作用,而不表现其促进CTL的增殖和分化的功能.外泌体也可能诱导肿瘤血管新生并促进肿瘤转移.有研究[38]显示,肿瘤实体来源的外泌体在中低剂量时表现出对肿瘤细胞的促增殖作用,在高剂量时则表现为抑制增殖作用.
4.2 外泌体在非肿瘤疾病应用的研究进展外泌体在自身免疫性疾病和缺血性疾病治疗方面,都取得一定的研究进展.未成熟的树突细胞通过免疫抑制因子修饰后,可以分泌具有抑制自身免疫的外泌体,机体注射外泌体后可减轻炎症性肠病、类风湿性关节炎等疾病[39].研究[40]发现人CD34+造血干细胞可以分泌具有促血管形成作用的外泌体,对缺血性疾病具有改善作用.2011年Alvarez等[41]首次成功利用外泌体治疗了鼠的阿尔茨海默病模型,显著下调了阿尔茨海默病相关蛋白的表达(蛋白下降62%),减少了B淀粉的沉积.相关研究[42]已证实来源于胚胎干细胞(ESCs)和某些成体干细胞的外泌体可以改变受体细胞的生理功能,从而保护急性损伤的心脏、肝脏和肾脏;与干细胞的移植治疗相比,外泌体可以避免细胞移植引起的长期异常分化和肿瘤形成,因此通过干细胞来源的外泌体进行调控血管生成和促进损伤细胞修复有望成为组织损伤修复的治疗新策略.外泌体包含多种蛋白质和遗传物质,表明蛋白质等大分子物质可以装载到外泌体上.外泌体可穿透细胞膜释放mRNA到靶细胞,使受体细胞翻译转染mRNA,并且外泌体广泛分布于不同体液,在体内有较长的半衰期,因此,利用电穿孔或脂质体转染的方式直接把药物转入外泌体或者将编码兴趣蛋白质的基因转入分泌外泌体的细胞,外泌体也可能成为一种理想的药物载体[43].
5 展望
长期以来,针对外泌体的研究大多集中于研制安全而有效的非细胞肿瘤疫苗.该疫苗表达特异的肿瘤抗体能刺激免疫系统抑制肿瘤生长,但该疫苗发展的瓶颈在于制备时必须使用已接受过治疗的患者的DC细胞,同时外泌体所负载的抗原大量变异,广谱性不高.然而,外泌体作为疾病诊断的生物标志物,目前的研究还不多.外泌体包含多种蛋白质和遗传物质,并且广泛分布于不同体液中,在体内有较长的半衰期,所以,外泌体可作为一种无创或微创的非侵入疾病诊断手段,一定条件下能够代替组织活检减轻患者的痛苦,提高疾病早期诊断率.因此,如何在各种体液中检测到针对疾病特异性的外泌体生物标志物将是值得努力探索的目标之一.
[1]Simons M,Rapose G.Exosmes-vesicular carriers for intercellular communication[J].Curr Opin Cell Biol,2009,21(4):575-581.
[2]Mathivanan S,Simpson RJ.ExoCarta:A compendium of exosomal proteins and RNA[J].Proteomics,2009,9(21):4997-5000.
[3]Pan BT,Teng K,Wu C,et al.Electron microscopic evidence for externalization of the transferring receptor in vesicular form in sheep reticulocytes[J].J Cell Biol,1985,101(3):942-948.
[4]Aliotta JM.Tumor exosomes:a novel biomarker?[J].J Gastrointest Oneol,2011,2(4):203-205.
[5]Petersen S H,Odintsova E,Haigh T A,et a1.The role of tetraspanin CD63 in antigen presentation via MHC class II[J].Eur J Immunol,2011,41(9):2556-2561.
[6]Tetta C,Bruno S,Fonsato V,et a1.The role of microvesieles in tissue repair[J].Organogenesis,2011,7(2):105-115.
[7]Lasser C,Eldh M,Lotvall J.Isolation and characterization of RNA-containing exsomes[J].J Vis Exp,2012,(59):e3037.
[8]Cocucci E,Racchetti G,Meldolesi J,et al.Shedding microvesicles: artefacts no more[J].Trends Cell Biol,2009,19(2):43-51.
[9]卢婉,杨人强,王伶.外泌体的研究进展[J].生命的化学,2013,33(4): 438-442.
[10]The'ry C,Amigorena S,Raposo G,et a1.Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].Curr Proto Cell Bio1,2006,3(3):22.
[11]Rosell R,Wei J,Taron M.Circulating microRNA signatures of tumor-derived exosomes for early diagnosis of non-small-cell lung cancer[J].Clin Lung Cancer,2009,10(1):8-9.
[12]Lu J,Getz G,Miska EA,et a1.MicroRNA expression profiles cIassify human cancers[J].Nature,2005,435(7043):834-838.
[13]Taylor DD,Gercel-Taylor C.MicroRNA signatures of tumorderived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecol Oncol,2008,110(1):13-21.
[15]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[16]Brase JC,Johannes M,Schlomm T,et al.Circulating miRNAs are correlated with tumor progression in prostate cancer[J].Int J Cancer,2011,128(3):608-616.
[17]Nilsson J,Skog J,Nordstrand A,et al.Prostate cancer-derived urine exosomes:a novel approach to biomarkers for prostate cancer [J].Br J Cancer,2009,100(10):1603-1607.
[18]Bryant RJ,Pawlowski T,Catto JW,et al.Changes in circulating microRNA levels associated with prostate cancer[J].Br J Cancer, 2012,106(4):768-774.
[19]Welton JL,Khanna S,Giles PJ,et al.Proteomics analysis of bladder cancer exosomes[J].Mol Cell Proteomics,2010,9(6):1324-1338.
[20]Wang H,Rana S,Giese N,et al.Tspan8,CD44v6 and α6β4 are biomarkers of migrating pancreatic cancer-initiating cells[J].Int J Cancer,2013,133(2):416-426.
[21]Rabinowits G,Gercel-Taylor C,Day JM,et al.Exosomal microRNA:a diagnostic marker for lung cancer[J].Clin Lung Cancer,2009 (1),10:42-46.
[22]Logozzi M,De Milito A,Lugini L,et al.High levels of exosomes expressing CD63 and caveolin-1 in plasma of melanoma patients [J].PLoS One,2009,4(4):e5219. [23]Skog JT,Van Rijn S,et al.Glioblastoma microvesicles transport RNA and Proteins that promote tumour growth and provide diagnostic biomarkers[J].Nat Cell Biol,2008,10(12):1470-1476.
[24]Zhou H,Pisitkun T,Aponte A,et al.Exosomal Fetuin-A identified by proteomics:a novel urinary biomarker for detecting acute kidney injury[J].Kidney Int,2006,70(10):1847-1857.
[25]Navarro-Munoz M,Ibernon M,Perez V,et al.Messenger RNA expression of B7-1 and NPHS1 in urinary sediment could be useful to differentiate between minimal change disease and focal segmental glomerulosclerosis in adult patients[J].Nephrol Dial Transplant,2011,26(12):3914-23.
[26]van Ham SM,Heutinck KM,Jorritsma T,et al.Urinary granzyme A mRNA is a biomarker to diagnose subclinical and acute cellular rejection in kidney transplant recipients[J].Kidney Int,2010,78(10): 1033-1040.
[27]Wang G,Kwan BC,Lai FM,et al.Expression of microRNAs in the urinary sediment of patients with IgA nephropathy[J].Dis Markers,2010,28(2):79-86.
[28]PisitkunT,JohnstoneR,KnepperMA.Discoveryofurinary biomarkers[J].Mol Cell Proteomies,2006,5(10):1760-1771.
[29]Keller S,Ridinger J,Rupp AK,et a1.Body fluid derived exosomes as a novel template for clinical diagnostics[J].Transl Med,2011,9: 86.
[30]Zhou Q,Li MZ,Wang XY,et a1.Immune-related microRNAs are abundant in breast milk exosomes[J].Int J Biol Sci,2012,8(1):118-123.
[31]Welker MW,Reichert D,Susser S,et al.Soluble serum CD81 is elevated in patients with chronic hepatitis C and correlates with alanine aminotransferase serum activity[J].PloS One,2012,7(2): e30796.
[32]Bian S,Sun T.Functions of noncoding RNAs in neural development and neurological disease[J].Mol Neurobiol,2011,44(3):359-373.
[33]Zitvogel L,Regnault A,Lozier A,et a1.Eradication of established murine tumors using a novel cell-free vaccine:dendritic cell derived exosomes[J].Nat Med,1998,4(5):594-600.
[34]Hao S,Moyana T,Xiang J.Review:cancer immunotherapy by exosome-based vaccines[J].Cancer Biother Radiopharm,2007,22(5): 692-703.
[35]王英丽,张阳,徐广伟,等.负载乳腺癌抗原的脐血树突细胞外泌体抗肿瘤免疫作用[J].中国妇幼保健,2013,28(17):2274-2276.
[36]陈邵倩,杜英,王鑫,等.K562细胞外泌体诱导特异性CTL生成的研究[J].中国实验血液学杂志,2006,14(6):1168-1171.
[37]Clayton A,Mitchell JP,Court J,et al.Human tumor-derived exosomes selectively impair iymphocyte responses to interleukin-2[J]. Cancer Res,2007,67(15):7458-7466.
[38]杨子楠,魏继武.外泌体在肿瘤发展中的研究进展[J].肿瘤, 2011,31(6):565-569.
[39]Bianco NR,Kim SH,Ruffiaer MA,et a1.Therapeutic effect of exosomes from indoleamine 2,3-dioxygenase-positive dendritic cells in collagen-induced arthritis and delayed-type hypersensitivity disease models[J].Arthritis Rheum,2009,60(2):380-389.
[40]Sahoo S,Klychko E,Thome T,et al.Exosomes from human CD34+stem cells mediate their proangiogenic paracrine activity[J].Circ Res,2011,109(7):724-728.
[41]Alvarez-Erviti L,Seow Y,Yin H,et a1.Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J].Nat Biotcchnol,2011,29(4):341-345.
[42]胡国文,汪泱,沈晓黎,等.外泌体及其在干细胞中的研究进展[J].上海交通大学学报,2013,33(6):868-873.
[43]Lai RC,Yeo RW,Tan KH,et al.Exosomes for drug delivery-a novel application for the mesenchymal stem cel1[J].Biotechnol Adv,2013,31(5):543-551.
R730.5,R730.23
A
1674-1129(2014)03-0267-05
10.3969/j.issn.1674-1129.2014.03.012
2014-02-18;
2014-04-02)
国家自然科学基金(No.81360083)
刘艳华,女,1988年出生,规范化培训学员,主要研究方向为:临床检验诊断.
王小中,男,出生于1973年,教授,主要研究方向为血液病分子机制及诊断.

