伊马替尼治疗晚期脊索瘤患者的临床研究
祁楠 杜楠 韦兴 陈秉耀 李晓松 马俊勋 付艳 赵辉
伊马替尼治疗晚期脊索瘤患者的临床研究
祁楠 杜楠 韦兴 陈秉耀 李晓松 马俊勋 付艳 赵辉
目的研究晚期脊索瘤患者口服伊马替尼治疗的临床疗效分析。方法本研究收集 2007 年6 月至 2012 年 6 月,在解放军总医院第一附属医院住院治疗的晚期脊索瘤患者 63 例,其中失访病例 24 例,我们长期追踪到的 39 例为可评价患者。患者在接受伊马替尼治疗前通过病理组化检测 PDGFRβ 蛋白表达情况,分为低表达组和高表达组。所有患者均口服伊马替尼的剂量为每天 400 mg ,每3个月进行1次 CT或 MRI 检查肿瘤生长情况,按照 RECIST 标准评价临床治疗效果,同时比较两组患者对伊马替尼治疗疗效的差别,并以 SPSS13.0 作统计分析,P<0.05 具有统计学意义;采用 Kaplan-Meier 法绘制患者生存曲线。结果免疫组化提示高表达 PDGFRβ 患者为 25 例,占 64.1%,14 例低表达患者,占 35.9%;在 39 例可评价患者中,完全缓解 ( CR ) 病例为 0 例 ( 0% ),部分缓解 ( PR ) 病例为3例 ( 8% ),病情稳定 ( SD ) 患者为 27 例( 69% ),疾病进展 ( PD ) 病例为 9 例 ( 23% );临床获益率为 76.9% ( CR%+PR%+SD% );中位无疾病进展期为9个月,中位生存时间为 31.2 个月。PDGFRβ 高表达组临床获益人数为 22 例 ( 临床获益率 88% ),低表达组临床获益人数8例 ( 临床获益率 57.1% );两组患者相比差异有统计学意义,P 值为 0.0282。结论本研究提示伊马替尼在治疗晚期脊索瘤方面具有抗肿瘤活性,临床获益率较好,同时在 PDGFRβ 高表达的患者获得了更好的疗效。
脊索瘤;伊马替尼;治疗结果;方案评价
脊索瘤是一种发病率极低的低度恶性肿瘤 ( 1 / 10 万 )[1],最常发生在骶骨 ( 50% )、颅底 ( 35% ) 及脊柱 ( 15% ) 等中轴骨部位[2-3]。脊索瘤的发展比较缓慢且局限,但仍存在转移到肝脏、肺脏、淋巴结及皮肤的风险;局部复发是治疗中的主要问题。临床上有<50% 的患者发生局部复发[4-5]。尽管手术辅助放疗作为治疗脊索瘤的主要方式,但传统手术、放疗及化疗对晚期脊索瘤的治疗不尽人意[6];因此对于既往治疗失败患者治疗方式的探索显得更为重要。由于其发病率较低,其治疗的方式并未满足临床的需求,脊索瘤的治疗在国际上仍具有很大的挑战性。近年来,随着分子靶向药物研究的日益进展,对于脊索瘤的研究也趋于增多;PDGF 在肿瘤中的自分泌刺激、PDGFR 的过表达或过度活化或者刺激肿瘤内血管生成都会促进肿瘤生长;PDGFR 的阻断可以降低实体瘤中组织间质液压而增强药物传送而受到关注。伊马替尼通过抑制 PDGFR 而发挥抗肿瘤作用[7],被用于治疗慢性粒细胞性白血病 ( CML )、胃肠道间质瘤和其它一些疾病。目前,伊马替尼治疗脊索瘤在美国已经进入临床二期阶段,我们本次实验的目的是想观察伊马替尼在治疗晚期脊索瘤患者中的疗效,为其临床应用提供可靠的依据。
资料与方法
一、患者资料
收集 2007 年6月至 2012 年6月,在我院收治的经多次手术或放疗后局部复发或远处转移的晚期脊髓瘤患者共 63 例,失访 24 例,获长期随访者 39 例 ( 由于随访跨度时间长,患者依从性较差,很多患者在治疗的期间停止了治疗 )。39 例中男24 例,女 15 例;中位年龄为 60 岁。主要的入选标准:至少具有一个影像学可测量病灶,明确的病理诊断,肝肾功正常,心功能正常。
二、实验设计
我们实验的目的是观察伊马替尼对晚期脊索瘤患者的疗效,因此我们观察的终点为无疾病进展期及中位生存时间。
实验开始前所有入组患者均经 CT 或 MRI 明确具有可测量病灶,并测量病灶大小。同时检测患者病理组织 PDGFRβ 的表达情况。患者每日口服400 mg 伊马替尼,预计口服时间为1年,若患者口服后疗效好,可继续口服至病情进展。
三、数据分析
1. PDGFRβ 的分析:患者脊索瘤石蜡组织样本取自本医院病理科,PDGFRβ 检测采用免疫组化法。兔抗人 PDGFRβ 单克隆抗体购自 Cell Signaling公司,实验操作严格按照说明进行,应用德国莱卡图像分析仪分析。PDGFRβ 免疫阳性物质定位于胞质,参考半定量积分法:无色0分,浅黄色1分,棕黄色2分,棕褐色3分;再按阳性细胞百分比打分:0分阳性细胞数<5%,1分阳性细胞数 5%~25%,2 分>26%~50%,3 分>51%~75%,4 分>75%;最后按染色强度与阳性细胞之和判断结果,>3 分为过表达,<2 分为低表达。
2. 疗效及安全性评价:每3个月复查1次 CT或 MRI,按照 RECIST 标准评价疗效,分为完全缓解 ( CR )、部分缓解 ( PR )、稳定 ( SD ) 及进展( PD )。将药物的副作用及毒性反应分为消化道反应及骨髓抑制。
四、统计学方法
所有数据的分析采用 SPSS13.0 软件;患者生存曲线及疾病进展时间的计算采用 Kaplan-Meier 法并绘制生存曲线。
结 果
一、一般情况
本组 39 例入组可评价患者的随访时间为 3~48个月,平均 31.2 个月。病灶发生在骶骨者 23 例,发生在脊柱及其他部位的分别为 9 例及 7 例。所有患者均经手术切除,术后接受放疗的为 36 例;接受化疗的为 11 例。而发生局部复发的为 23 例,远处转移的为 16 例。所有患者在入组前均复查肿瘤病灶大小及检测肿瘤组织中 PDGFRβ 的表达情况,且按时服用伊马替尼 400 mg 每日 (表1 )。
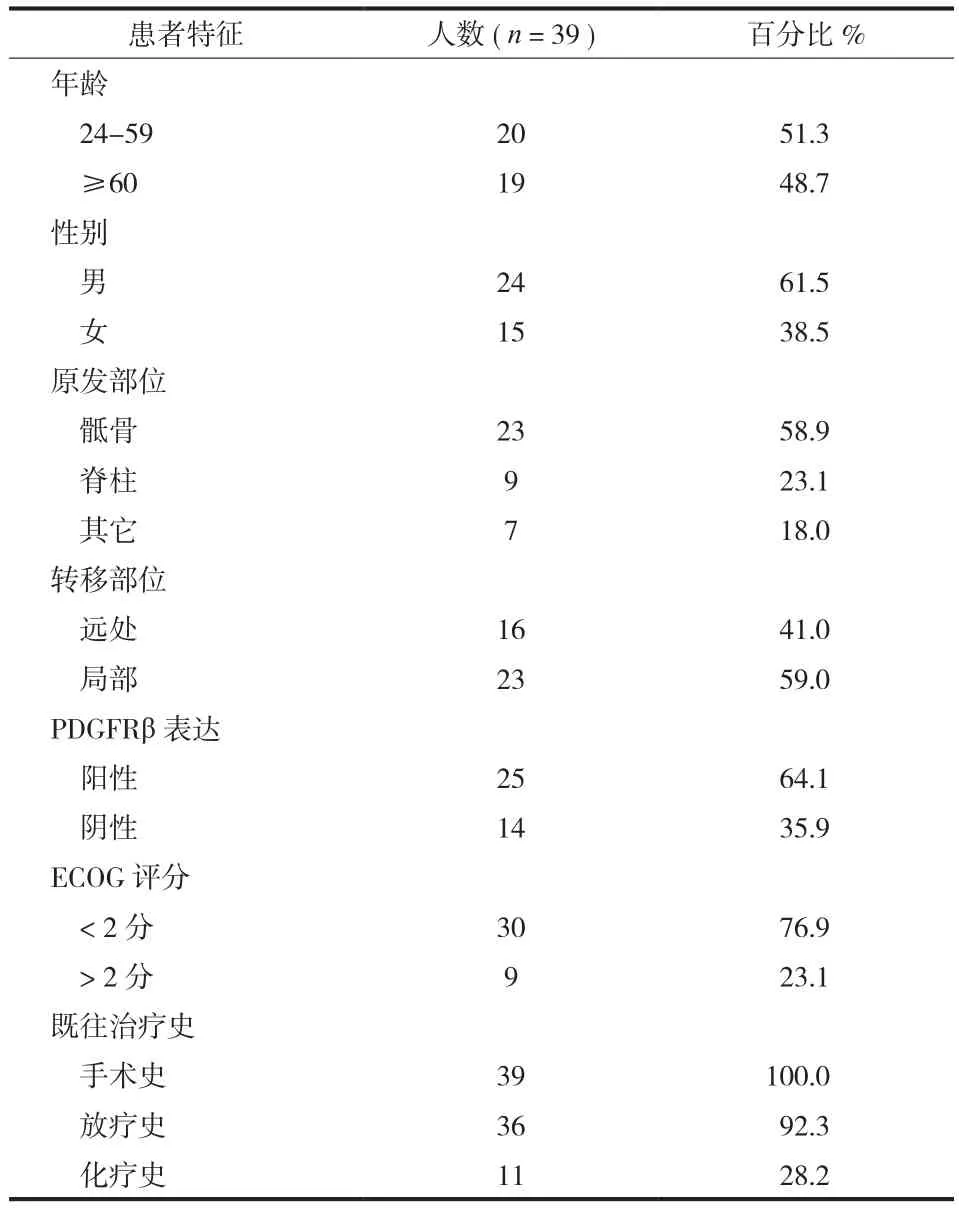
表1 入组患者临床特征Tab.1 Clinical characteristics of the study population
二、疗效分析
所有入组患者中未见到完全缓解 ( CR ),疗效达到部分缓解 ( PR )、病情稳定 ( SD )、病情进展( PD ) 的患者分别为:3 例、27 例及 9 例;临床获益率为 76.9%,中位生存时间为 31.2 个月,中位无疾病进展时间为 9 个月 (图1 )。本组疗效最好的1 例 48 岁男性患者为口服伊马替尼 6 个月,疗效达到 PR。手术切除后 1 年复发,后口服伊马替尼治疗,治疗后 6 个月复查 MRI 示病灶较前缩小,疗效达到 PR;患者术前 (图2A )、术后复发 (图2B ) 及口服伊马替尼治疗后 (图2C ) 的 MRI 结果显示口服伊马替尼明显减小了病灶大小 (图2 )。
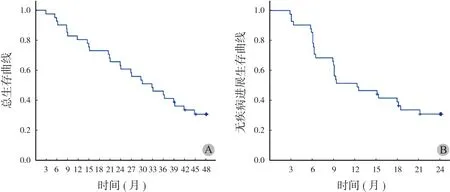
图1 生存曲线 A:总生存曲线;B:无疾病进展生存曲线Fig.1 Survival curve A: Overall survival curve; B: Progression-free survival curve

图2 患者术前 ( A )、术后复发 ( B ) 及口服伊马替尼 6 个月后 ( C ) 的 MRI 影像学资料Fig.2 MRI data before the surgery ( A ), after the surgery ( B ) and 6 months after oral imatinib treatment ( C )
三、PDGFRβ 表达情况与预后
高表达 PDGFRβ 的患者为 25 例,临床获益为22 例,占 88%;低表达组患者为 14 例,临床获益为 8 例,占 57.1%;两组相比,高表达组患者的预后要好于低表达组,两组相比 P<0.05 具有统计学意义 (表2,3 )。
四、毒副作用
患者口服伊马替尼治疗期间,未发生患者因消化道反应、骨髓抑制或其它药物副作用而终止药物治疗。
讨 论
入组的可评价 39 例在观察期间只接受伊马替尼的治疗,按照 RECIST 标准,入组患者的治疗有效人数 ( CR+PR+SD ) 为 30 例,占总体患者的 76.9%;所有患者的中位无疾病进展期为 9 个月,中位生存时间为 31.2 个月。
近期一个关于伊马替尼治疗晚期脊索瘤的二期临床试验显示了阳性结果,通过对50 例口服伊马替尼患者的研究发现,1 例在口服药物 6 个月的时候达到 PR,有 35 例疗效达到 SD,临床获益率达到 64%;中位无疾病进展期为 9.2 个月,中位生存时间为 35 个月[8]。通过我们的研究得出的中位无疾病进展时间为 9 个月,中位生存时间为31.2 个月,与其研究结果相一致。早在 2007 年 Stacchiotti 通过对 55 例晚期脊索瘤患者的研究发现,对于其中 44 例可评价患者,中位无疾病进展期为 32 周;84% 的患者服药后病情稳定,其中 30 例病情稳定时间可持续>6个月;总体患者的临床获益率为 73%[9]。但并不是所有的研究结果都是一致的,另外一个二期临床却得出了阴性结果,并且没有提供标准的药物治疗[10]。

表2 入组患者的 PDGFRβ 表达情况Tab.2 PDGFRβ expression examination in the study population

表3 入组患者口服伊马替尼的疗效Tab.3 Clinical effects of oral imatinib treatment in the study population
既往一项关于伊马替尼治疗脊索瘤的前瞻性临床报道提示:观察到患者的客观应答率为 33%,患者的中位无疾病进展时间为6个月[11];然而研究组中 42% 的患者发生了转移,其增长速率要比正常患者要快,且其预计生存时间为 1~3 年。
我们对患者选择的治疗剂量为 400 mg 每日来证明在 PDGFRβ 不同的表达情况下与疗效的关系。事实上,剂量依赖性的疗效在治疗脊索瘤的病例中亦观察到[12]。然而,对于脊索瘤治疗剂量的研究仍需要进一步探索,包括患者所可能出现的毒副反应及获益率。
我们入组患者在服药期间并未出现不耐受的消化道反应及骨髓抑制。但药物的副作用在其它的研究中持续存在[13],许多药物的副作用貌似很严重,贫血影响着 25% 的患者,一个可能的解释为这些晚期脊索瘤患者运动受限,经常需要口服激素类药物,又或者是因为先前的骨盆手术的影响。
我们所有接受治疗的患者不管其有无从伊马替尼治疗中获益,均检测其 PDGFRβ 的表达情况。尽管我们实验的目的并不是研究伊马替尼治疗晚期脊索瘤的机制;但我们在研究中发现其中有 64.1% 的患者检测出 PDGFRβ 的表达,且其预后要好于未表达的患者。最近的研究数据表明,其他酪氨酸激酶( 例如表皮生长因子受体 ) 和 mTOR 都参与了脊索瘤的病理发生[14-16]。这些因素可能成为肿瘤治疗无效的原因;另外这些通路不同靶点的表达或激活在患者中也是有差异的[15]。有文献报道表皮生长因子受体抑制剂舒尼替尼和 mTOR 抑制剂可应用与对伊马替尼产生抵抗的治疗作用[17-20]。此类药物对于脊索瘤治疗的研究正在进行中。
通过我们的实验初步揭示了伊马替尼在晚期脊索瘤治疗中的疗效,但其作为单药使用或联合其它药物治疗需要进一步的研究证实。
[1] Newton H. Chordoma. In Raghavan D, Brecher ML, Johnson DH, et al. Testbooks of Uncommon cancer, 3rd edition. Chichester, UK: John Wiley & Sons Ltd, 2006, 614-625.
[2] McMaster ML, Goldstein AM, Bromley CM, et al. Chordoma: incidence and survival patterns in the United States, 1973-1995. Cancer Causes Control, 2001, 12(1):1-11.
[3] Bergh P, Kindblom LG, Gunterberg B, et al. Prognostic factors in chordoma of the sacrum and mobile spine: a study of 39 patients. Cancer, 2000, 88(9):2122-2134.
[4] Boriani S, Bandiera S, Biagini R, et al. Chordoma of the mobile spine: ffty years of experience. Spine (Phila Pa 1976), 2006, 31(4):493-503.
[5] Tzortzidis F, Elahi F, Wright DC, et al. Patient outcome at long-term follow-up after aggressive microsurgical resection of cranial base chondrosarcomas. Neurosurgery, 2006, 58(6):1090-1098.
[6] Fleming GF, Heimann PS, Stephens JK, et al. Dedifferentiated chordoma. Response to aggressive chemotherapy in two cases. Cancer, 1993, 72(3):714-718.
[7] Tamborini E, Miselli F, Negri T, et al. Molecular and biochemical analyses of platelet-derived growth factor receptor (PDGFR) B, PDGFRA, and KIT receptors in chordomas. Clin Cancer Res, 2006, 12(23):6920-6928.
[8] Stacchiotti S, Longhi A, Ferraresi V, et al. Phase II study of imatinib in advanced chordoma. J Clin Oncol, 2012, 30(9): 914-920.
[9] Stacchiotti S, Ferrari S, Ferraresi V, et al. Imatinib mesylate in advanced chordoma: A multicenter phase II study. Journal of Clinical Oncology 2007, 25(18S):10003.
[10] Chugh R, Dunn R, Zalupski MM, et al. Phase II study of 9-nitro-camptothecin in patients with advanced chordoma or soft tissue sarcoma. J Clin Oncol, 2005, 23(15):3597-3604.
[11] Scimeca PG, James-Herry AG, Black KS, et al. Chemotherapeutic treatment of malignant chordoma in children. J Pediatr Hematol Oncol, 1996, 18(2):237-240.
[12] Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST). Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromaltumors: a meta-analysis of 1,640 patients. J Clin Oncol, 2010, 28(7):1247-1253.
[13] Blanke CD, Rankin C, Demetri GD, et al. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol, 2008, 26(4):626-632.
[14] Han S, Polizzano C, Nielsen GP, et al. Aberrant hyperactivation of akt and Mammalian target of rapamycin complex 1 signaling in sporadic chordomas. Clin Cancer Res, 2009, 15(6): 1940-1946.
[15] Tamborini E, Virdis E, Negri T, et al. Analysis of receptor tyrosine kinases (RTKs) and downstream pathways in chordomas. Neuro Oncol, 2010, 12(8):776-789.
[16] Shalaby A, Presneau N, Ye H, et al. The role of epidermal growth factor receptor in chordoma pathogenesis: a potential therapeutic target. J Pathol, 2011, 223(3):336-346.
[17] George S, Merriam P, Maki RG, et al. Multicenter phase II trial of sunitinib in the treatment of nongastrointestinal stromal tumor sarcomas. J Clin Oncol, 2009, 27(19):3154-3160.
[18] Linden O, Stenberg L, Kjellen E. Regression of cervical spinal cord compression in a patient with chordoma following treatment with cetuximab and gefitinib. Acta Oncol, 2009, 48(1):158-159.
[19] Singhal N, Kotasek D, Parnis FX. Response to erlotinib in a patient with treatment refractory chordoma. Anticancer Drugs, 2009, 20(10):953-955.
[20] Stacchiotti S, Marrari A, Tamborini E, et al. Response to imatinib plus sirolimus in advanced chordoma. Ann Oncol, 2009, 20(11):1886-1894.
( 本文编辑:王永刚 )
第七届中国骨科医师年会通知
第七届中国骨科医师年会将颠覆传统的授课模式,秉承与时俱进、勇于创新的教育精神,充分运用互动网络教育平台,通过课程网络直播、课程网上回顾等新途径传播教育资源。同时,本着增强课程实用性的理念,加重实体操作讲解项目的比重,以授课连同手术演示的崭新教育形式结合网络化教育平台进行全方位、立体化的教育资源传播。会议期间,除继续以往的理论课程外,增加多形式的 WORKSHOP、实况手术录像转播等多样的培训模式,将为不同层级的医生群体提供一个良好的学术互动交流媒介,为广大骨科医生带来一场学术交流与继续教育的盛宴!
1. 会议时间:2014 年 5 月 9 日至 11 日
2. 会议地点:中国北京九华山庄
3. 学分授予:国际级 I 类继续教育学分
4. 会议费用:
( 1 ) 正式代表1000 元,1300 元 ( 含餐费 );
( 2 ) CAOS 会员代表800 元,1100 元 ( 含餐费 );
( 3 ) 研究生、学生 600 元,800 元 ( 含餐费 )。研究生注册现场必须出示带照片的有效学生证,否则视为全费代表。
5. 注册程序:
登录会议网站 ( www.caos-china.org ),点击“个人代表注册”按钮,在线填写注册信息。注册 10 人 ( 含 ) 以上的单位或公司请点击“团队代表注册”按钮进行注册。上网有困难的代表可以向大会秘书处索取并填写注册表,连同汇款凭证于规定日期前通过传真或邮寄的方式递交至大会秘书处 ( 汇款方式请咨询会议主办单位-中国医师协会骨科医师分会 )。
6. 联系人及地址:
中国医师协会骨科医师分会
010-51921376,010-64174393
E-mail:info@caos-china.org
中国医师协会骨科医师分会
A clinical study of imatinib in the treatment of advanced chordoma patients
QI Nan, DU Nan, WEI Xing, CHEN Bing-yao, LI Xiao-song, MA Jun-xun, FU Yan, ZHAO Hui. Department of Oncology, the frst Affliated Hospital of the General Hospital of CPLA, Beijing, 100048, PRC
ObjectiveTo study the clinical effects of advanced chordoma patients who were treated with oral imatinib.MethodsFrom June 2007 to June 2012, 63 advanced chordoma patients who were admitted in our hospital were selected, including 24 cases with lost follow-up. The other 39 evaluable patients were followed up continuously. The platelet-derived growth factor receptor-β ( PDGFR-β ) protein expressions were detected pathologically before patients receiving imatinib treatment, and then they were divided into low and high expression groups. The dosage of oral imatinib for all the patients was 400 mg/d. The tumor growth was examined through CT or MRI every 3 months. The Response Evaluation Criteria in Solid Tumors ( RECIST ) was used to evaluate the clinical effects, and at the same time the differences in clinical effects of imatinib treatment between the 2 groups was compared. The Statistical Package for the Social Sciences Version 13.0 ( SPSS13.0 ) was used in statistical analysis, and P<0.05 meant that there were statistically signifcant differences. The survival curve was drawn using the Kaplan-Meier method.ResultsImmunohistochemistry results were listed as follows. 25 patients had high expression of PDGFRβ, accounting for 64.1%. 14 patients had low expression of PDGFRβ, accounting for 35.9%. Among the 39 evaluable patients, no patients have complete response ( CR ), accounting for 0%, 3 patients with partial response ( PR ), accounting for 8%, 27 patients with stable diseases ( SD ), accounting for 69% and 9 patients with progressive diseases ( PD ), accounting for 23%. The clinical beneft rate was 76.9% ( CR%+PR%+SD% ). The median progression-free survival time was 9 months, and the median survival time was 31.2 months. The number of clinical benefts was 22 in PDGFRβ high expression group, and the clinical beneft rate was 88%. The number of clinical benefts was 8 in PDGFRβ low expression group, and the clinical beneft rate was 57.1%. There were statistically signifcant differences between the2 groups, and the p value was 0.0282.ConclusionsOur study further confrms the anti-tumor activity of imatinib in advanced chordoma patients and good clinical benefts. Meanwhile, better clinical effects can be achieved in PDGFRβ high expression group.
Chordoma; Imatinib; Treatment outcome; Program evaluation
10.3969/j.issn.2095-252X.2014.02.008
R739.4
卫生部医药卫生科技发展研究基金 ( W2011BX055 )
100048 北京,解放军总医院第一附属医院肿瘤二科 ( 祁楠,杜楠,李晓松,马俊勋,付艳,赵辉 );骨科骨肿瘤病区 ( 韦兴,陈秉耀 )
杜楠,Email: dunan05@yahoo.com.cn
2013-04-15 )

