HPLC检测大鼠组织样品中花椒麻素方法的建立
方国珊,张 磊,张端丽,周 敏,刘 雄,
(1.西南大学食品科学学院,重庆 400715;2.重庆师范大学生命科学学院,重庆 401331)
花椒为芸香科(Rutaceae)花椒属植物Zanthoxylum bungeanum的果皮,是我国传统的“八大调味品”之一,主要含有挥发油、生物碱、酰胺类物质、香豆素等多种化学成分,对心血管系统、消化系统、神经系统、免疫机能、凝血功能等都有重要作用[1-6]。花椒麻素是一类链状不饱和脂肪酸酰胺类物质,具有强烈的刺激性[7-9],目前已鉴定出22 种[10],主要有α-山椒素、β-山椒素、γ-山椒素、δ-山椒素及其羟基同系物等,其检测方法主要有高效液相色谱法、液相色谱-质谱联用法、薄层层析法、近红外检测法、紫外分光光度计法等[11-15]。国内外对花椒麻素在生物样品中检测方法的研究报道较少,有文献报道,采用液相色谱-质谱联用法测定大建中汤中羟基-α-山椒素、羟基-β-山椒素及γ-山椒素在血浆、尿液中的含量[16],前处理简便、灵敏度高,但设备昂贵、检测成本高,Munekage等[17]采用高效液相色谱测定大建中汤中羟基-α-山椒素及羟基-β-山椒素在血浆中的浓度,所需样品量少,分离效果好,但组织样品中干扰杂质较多,已报道的检测方法效果并不理想,而目前组织样品中花椒麻素的检测方法尚未见报道,故本实验旨在建立组织样品中花椒麻素含量的检测方法,以期为花椒麻素进一步研究提供科学依据。
1 材料与方法
1.1 材料与试剂
花椒麻素标品(纯度>97%) 实验室自制;五味子醇甲(纯度>98%) 南通飞宇生物科技有限公司;甲醇 美国Spectrum公司。
1.2 仪器与设备
LC-20A高效液相色谱仪(配有LC-20AD泵、SPDM20A检测器、SIL-20A全自动进样器、CTO-10AS柱温箱及LCsolution工作站) 日本岛津公司;XW280A旋涡混合器 上海医科大学仪器厂;Eppendorf Centrifuge 5810型离心机 德国Eppendorf公司;1-15 PK冷冻离心机 德国Sigma公司;JA2003A电子天平 上海精天电子仪器有限公司;Cole Parmer手持匀浆机 美国Cole-Parmer仪器公司;HH-4水浴锅 常州澳华仪器有限公司;DHG-9070电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;Milli-Q Biocel超纯水器 美国密理博公司。
1.3 动物
SD大鼠,雄性、体质量(220±20)g、SPF级,购于重庆腾鑫比尔实验动物销售有限公司,动物许可证号:SCXK(渝)2007-0008。大鼠单笼饲养,室温保持(25±1)℃,12 h明暗轮换(8∶00~20∶00),基础饲料喂养适应一周后,按照40 mg/kg体质量的剂量灌胃大鼠,15、30、45、60、90、180、360 min及12 h后断头处死,立刻解剖取样,胃和小肠需剪开洗出内容物,皮肤需刮净,其余组织直接用冰冷的生理盐水洗去表面血液,草纸轻轻吸干后称量,铝箔纸包裹后置于-80 ℃待测。同样的方法采集未灌胃的正常大鼠的组织样品作为空白组织。
1.4 花椒麻素测定方法的建立
1.4.1 色谱条件
色谱柱:岛津Interstil ODS-SPC18柱(250 mm×4.6 mm,5 μm);流动相:甲醇∶水=70∶30(V/V);进样量:20 μL;流速:0.5 mL/min;柱温:35 ℃;检测波长:254 nm。
1.4.2 标准溶液的制备
花椒麻素标准溶液的配制:精密称取花椒麻素适量,用甲醇溶解配制成2 mg/mL的储备液。分别精密量取该储备液适量,用流动相逐级稀释成质量浓度为1、2、5、10、20、50、100 μg/mL和200 μg/mL的花椒麻素系列标准溶液,置冰箱(4 ℃)备用。
内标液:精密称取五味子醇甲0.006 0 g,用甲醇溶解配制成60 μg/mL备用。
1.4.3 生物样品的处理方法
取组织样品(脑、心、胃、脾、肺、肾、胰腺、皮肤、平滑肌、脂肪、睾丸和前列腺)加入5 mL甲醇和20 μL内标五味子醇甲(60 μg/mL),肝和小肠加入30 mL甲醇和20 μL五味子醇甲(60 μg/mL)。匀浆,静置4 h,8 000 r/min离心10 min,合并两次组织匀浆液于65 ℃烘干。加入1 mL甲醇,涡旋混合30 s,10 000 r/min冷冻离心10 min,过0.45 μm有机滤膜进样。
1.4.4 生物样品中标准曲线的制备
用空白组织匀浆液配制质量浓度分别为0.1、0.2、0.5、1、5、10、20、50、100 μg/mL 9 个梯度的花椒麻素标准液样品,按上述方法进行处理测定,建立标准曲线。以待测物质量浓度为横坐标,待测物峰面积与内标峰面积的比值为纵坐标,用加权最小二乘法进行回归运算,求得直线回归方程,即为标准曲线。
1.4.5 回收率的测定
用大鼠空白组织匀浆液配制质量浓度分别为1、5、10 μg/mL的组织样品,加入内标20 μL,按1.4.3节操作,每添加量进行5样本分析。与相应质量浓度的纯品溶液加入内标,对比。测定提取样品峰面积Ax和纯品峰面积As,按下式计算样品提取回收率(R/%):

1.4.6 方法的精密度
用大鼠空白组织匀浆液配制1、5、10、50、100 μg/mL 5个质量浓度的组织样品,按1.4.3节处理,每个质量浓度进行样本分析,连续测定3 d,并与标准曲线同时进行。根据当日标准曲线计算组织样品的质量浓度,计算方法的精密度。方法的精密度用日内相对标准偏差(RSD)和日间RSD表示。
1.4.7 稳定性考察
取洁净的离心管,加入空白大鼠组织匀浆液,加标准品使质量浓度分别为1、5、10、50、100 μg/mL,分别放置-20 ℃冰箱冷藏1月;-20 ℃和室温反复冻融3次,每个过程12 h;室温20 ℃摆放12、24 h,同1.4.3节处理,测定药物含量。
2 结果与分析
2.1 方法专属性考察
取大鼠空白组织匀浆液1 mL,加入内标溶液,按1.4.3节方法操作,获得空白样品色谱图1A;将一定质量浓度的花椒麻素标准溶液和内标溶液加入空白组织匀浆液,依同法操作,获得相应的色谱图1B;取大鼠给药后的组织匀浆液,依法操作,可得给药后大鼠组织样品的色谱图1C(以肝为例)。可见,花椒麻素的保留时间约为23.1、24.2 min和25.5 min,内标的保留时间约为17.3 min,组织中的内源性物质不干扰花椒麻素及内标的测定。
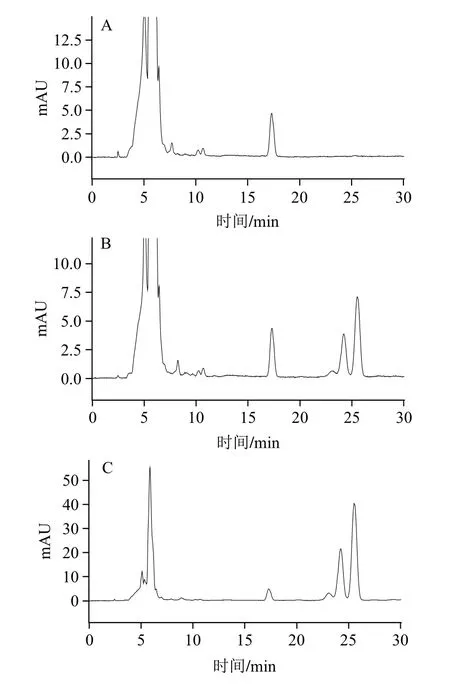
图1 花椒麻素在肝组织中的色谱图Fig.1 HPLC chromatograms of alkylamide from Sichuan pepper in rat liver samples
2.2 组织样品的标准曲线
按1.4.3节组织样品处理方法提取样本,得到大鼠组织样品的标准曲线,由表1可知,花椒麻素在大鼠不同组织中的线性范围略有不同,心脏、脾脏、肺、脑、肌肉、皮肤、睾丸及前列腺的线性范围为0.1~10 μg/mL,肾脏和脂肪的线性范围为0.1~20 μg/mL,肝脏和小肠的线性范围为0.1~50 μg/mL,胃中花椒麻素的线性范围为0.1~100 μg/mL,定量限(RSN=3)均为0.1 μg/mL。
2.3 加标回收实验
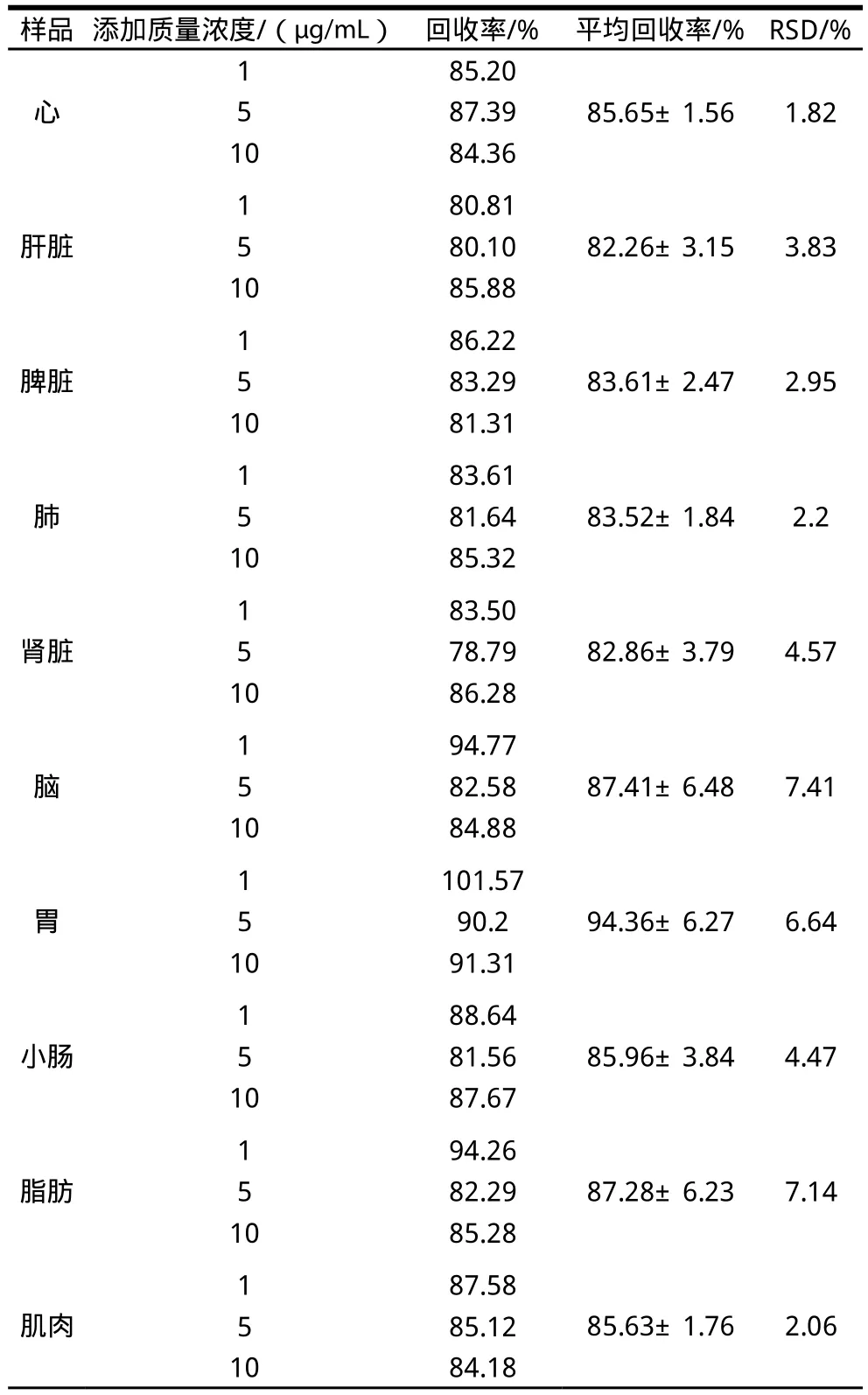
表2 花椒麻素在大鼠组织样品中的提取回收率(n=5)Table 2 Recovery rates of alkylamide from Sichuan pepper in spiked samples of rat tissues (n=5)

续表2
表2表明:肝脏、脾脏、肾脏及肺中的回收率大于82%,其余组织样品中的回收率均大于85%,RSD均小于9%,本方法在低、中、高3个添加水平上的回收率最低为78.79%,能满足生物样品的定量分析要求[18]。
2.4 精密度
本实验通过日内、日间变异考察了方法的精密度,由表3可知,方法的日内RSD小于7%,日间RSD小于11%,完全符合目前生物分析方法指导原则质控样品批内及批间RSD值不超过15%的要求[19]。

表3 花椒麻素精密度(n=5)Tabbllee 3 Precision of the method (n=5)
2.5 稳定性

表4 稳定性结果(n=5)Table 4 Stability of alkylamide from Sichuan pepper during storage at room temperaturree (n=5)
由表4可知,短期室温放置稳定性中,组织样品中花椒麻素测定均值与加入值之间的RSD小于6%,表明组织样品处理后室温条件下至少可稳定24 h;-20 ℃室温反复冻融3次后,组织样品的RSD小于10%,表明组织样品在冷冻-融溶循环3次实验中无明显降解;贮藏1个月的组织样品RSD小于8%,1 μg/mL的组织样品贮藏1个月后,质量浓度与初始样品存在显著性差异,而样品质量浓度在5~100 μg/mL时,无显著性变化,说明低质量浓度的样品不宜贮藏,样品处理后应尽快测定。
3 讨论及结论
3.1 试验方法的选择
花椒麻素的检测方法包括紫外分光光度计法、近红外检测法、薄层层析法、高效液相色谱法等[11-15]。高效液相色谱具有分析成本低、灵敏度高、层析时间短、试验方法简便等优点,对一些高熔点、低挥发、极性强以及对热不稳定的物质具有良好的分离效果,并能在室温中操作,安全简便[20],故本研究采用此种方法。
3.2 色谱条件的确定
本实验选择岛津I n t e r s i l O D S-S P C18(250 mm×4.6 mm,5 μm)为分析柱,在一定比例范围内考察甲醇-水流动相对检测色谱峰的影响。以峰面积为指标,对比不同流速(0.50、0.55、0.60、0.65、0.70、0.75、0.80、0.90、1.00 mL/min)及不同比例(55∶45、60∶40、62∶38、65∶35、68∶32、70∶30、72∶28、75∶25)的流动相的色谱图,结果表明,随着流速的提高,出峰时间不断提前,峰面积逐渐减小,难以与内标及内源性杂质分离,而随着有机相比例的提高,峰面积先增后减,当甲醇和水比例70∶30、流速0.5 mL/min时,峰形对称,花椒麻素和内标均达到基线分离,组织样品中的其他成分不干扰样品的测定。
3.3 样品的处理方法
花椒麻素醇溶性强,在选取萃取溶剂时,曾采用乙醚、氯仿、氯仿-丙酮(1∶1、2∶1)、氯仿-甲醇(1∶1、1∶2、2∶1)、甲醇8种,乙醚等极性小的溶剂对其萃取率虽然高,但乙醚易挥发,从而造成提取后质量浓度的误差,不便于操作,且对呼吸道有强烈刺激作用,氯仿和丙酮或甲醇不同比例的提取溶剂,仅对个别组织的提取效率高,故选用甲醇为提取溶剂,成本低,提取率高,提纯后杂质少,操作十分方便。
本实验建立了以五味子醇甲为内标,高效液相色谱法测定大鼠组织样品中花椒麻素的含量方法,简便快速、重复性好、灵敏度高,在一定质量浓度范围内,线性关系良好,回收率高,无干扰,适用于大鼠组织样品中花椒麻素含量的测定。
[1]WU Tingting, HOU Aijun, HONG Zhenyi, et al.Extracts ofZanthoxylum bungeanumregulate cholesterol accumulation induced by sterols and LPSin vitroandin vivo[J].Journal of Chinese Pharmaceutical Sciences, 2012, 21(6): 582-590.
[2]CHU Chinying, LEE H J, CHU C Y, et al.Protective effects of leaf extract ofZanthoxylum ailanthoideson oxidation of low-density lipoprotein and accumulation of lipid in differentiated THP-1 cells[J].Food and Chemical Toxicology, 2009, 47(6): 1265-1271.
[3]GONG Youwen, HUANG Yongfu, ZHOU Ligang, et al.Chemical composition and antifungal activity of the fruit oil ofZanthoxylum bungeanumMaxim.(Rutaceae) from China[J].Journal of Essential Oil Research, 2009, 21(2): 174-178.
[4]CHOU S T, CHAN H H, PENG H Y, et al.Isolation of substances with antiproliferative and apoptosis-inducing activities against leukemia cells from the leaves ofZanthoxylum ailanthoidesSieb.&Zucc[J].Phytomedicine, 2011, 18(5): 344-348.
[5]PEREIRA S S, LOPESA L S, MARQUES R B, et al.Antinociceptive effect ofZanthoxylum rhoifoliumLam.(Rutaceae) in models acute pain in rodents[J].Journal of Ethnopharmacology, 2010, 129(2): 227-231.
[6]VILLALBA M A, CARMO M I, LEITE M N, et al.Atividades farmacológicas dos extratos deZanthoxylum chiloperone(Rutaceae)[J].Revista Brasileira de Farmacognosia, 2007, 17(2): 236-241.
[7]ALBIN K C, SIMONS C T.Psychophysical evaluation of a sanshool derivative (alkylamide) and the elucidation of mechanisms subserving Tingle[J].PLoS ONE, 2010, 5(3): e9520.
[8]LENNERTZ R C, TSUNOZAKI M, BAUTISTA D M, et al.Physiological basis of tingling paresthesia evoked by hydroxy-αsanshool[J].The Journal of Neuroscience , 2010, 30(12): 4353-4361.
[9]KLEIN A H, SAWYER C M, ZANOTTO K L, et al.A tingling sanshool derivative excites primary sensory neurons and elicits nocifensive behavior in rats[J].Journal of Neurophysiol, 2011, 105(4):1701-1710.
[10]王宇, 王钊.花椒属植物中生物活性成分研究近况[J].中草药, 2002,33(7): 93-97.
[11]雷绍荣, 欧阳华学, 赵志峰.反相高效液相色谱法测定花椒油中麻味成分[J].西南农业学报, 2005, 18(6): 264-266.
[12]SUGAI E, MORIMITSU Y, KUBOTA K.Quantitative analysis of sanshool compounds in Japanese pepper (Xanthoxylum piperitumDC.)and their pungent characteristics[J].Bioscience Bioechnology and Biochemistry, 2005, 69(10): 1958-1962.
[13]刘雄.花椒风味物质的提取与分离技术的研究[D].重庆: 西南大学,2003.
[14]付陈梅, 阚建全, 刘雄, 等.紫外分光光度计法测定花椒油中酰胺类物质含量[J].中国食品添加剂, 2003(6): 100-102.
[15]祝诗平, 王刚, 杨飞, 等.基于近红外光谱的花椒麻味物质快速检测方法[J].红外与毫米波学报, 2008, 27(2): 129-132.
[16]IWABU J, WATANABE J, HIRAKURA K.Profiling of the compounds absorbed in human plasma and urine after oral administration of a traditional Japanese (Kampo) medicine,daikenchuto[J].Drug Metabolism and Disposition, 2010, 38(11):2040-2048.
[17]MUNEKAGE M, KITAGAWA H, ICHIKAWA K, et al.Pharmacokinetics of daikenchuto, a traditional Japanese medicine (Kampo)after single oral administration to healthy Japanese volunteers[J].Drug Metabolism and Disposition, 2011, 39(10): 1784-1788.
[18]国家药典委员会.药物制剂人体生物利用度和生物等效性试验指导原则[M]//中华人民共和国药典: 二部.2010年版.北京: 中国医药科技出版社, 2010: 附录195-199.
[19]钟大放, 李高, 刘昌孝.生物样品定量分析方法指导原则(草案)[J].药物评价研究, 2011, 34(6): 409-415.
[20]王慧文.高效液相色谱技术在药品检验中的应用及进展[J].安徽医药, 2008, 12(11): 1087-1090.

