核桃青皮提取物对几种采后病原真菌抑制作用的研究
王刚霞,彭新媛,吴忠红,李维霞,张正方,吴 斌,*
(1.新疆大学化学化工学院,乌鲁木齐830041;2.新疆农业科学院农产品贮藏加工研究所,乌鲁木齐830091;3.新疆大学理化测试中心,乌鲁木齐830041)
新鲜果蔬是人体日常必需的维生素、矿物质和膳食纤维的重要来源,具有独特的形、色、味,是人们最好的保健食品。但果蔬采后极易受到有害病原菌的侵染而腐烂变质,据不完全统计,我国贮运的主要果蔬因采后病害造成的损失达25%~30%[1],造成巨大的经济损失。目前,控制果蔬采后腐烂最主要的方法仍是使用化学杀菌剂[2],但长期使用化学药剂易出现抗药菌系而使药效降低,同时化学药剂具有毒性物质残留、致癌和致畸等问题[3]。因此,开发高效、安全、无毒和性能稳定的天然植物防腐保鲜剂已成为果蔬采后保鲜技术的研究热点[4-6]。
核桃(Juglans regia Linn.)是核桃属植物中经济价值最高的一种,在中国栽培历史悠久,资源丰富,具有显著的经济效益和药用价值[7]。核桃青皮为核桃未成熟时的外果皮,其性辛、苦、涩、有毒、微寒,具有抗肿瘤作用,外用于皮肤疥癣、疣等皮肤病[8]。我国核桃青皮年产量在35万吨以上,但是大部分核桃青皮被作为废弃物扔掉,造成极大的资源浪费,并严重污染环境[9]。为了充分利用这一资源,国内外学者对核桃青皮提取物的抗氧化性、抑菌性、杀虫、除草以及抗病毒等方面进行了大量研究工作[10-13]。但关于核桃青皮提取物对果蔬采后病原真菌抑制效应方面的研究报道较少。
本文以新疆核桃青皮为试材,研究核桃青皮提取物对果蔬采后腐烂主要致病真菌青霉菌(Penicillium citrinu)、匍枝根霉(Rhizopus stolonifer)、灰葡萄孢(Botryis Cinerea)、镰刀菌(Fusarium oxysporum)、交链孢属(A lternaria)的抑制作用,为天然植物提取剂在果蔬采后保鲜上的应用和核桃青皮的再利用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜核桃(Juglans regia Linn.) 采自新疆吐鲁番,将核桃青皮在-20℃下用植物粉碎机粉碎,在-50℃下真空冷冻干燥除去水分,过40目筛,得核桃青皮干粉,置于-80℃冰箱中备用;无水乙醇 分析纯;葡萄糖、琼脂粉 均购自上海日心食品有限公司;青霉菌(P.citrinu ACCC30287)、匍枝根霉(R.stolonifer ACCC36077)灰葡萄孢(B.cinerea ACCC36056)、镰刀菌(F.oxysporum ACCC31371)、交链孢属(Alternaria CFCC6872) 新疆农业科学院微生物研究所。
LGJ-10型冷冻干燥机 北京松源华兴科技有限公司;Coulter Avanti J-25型高速冷冻离心机BECKMAN公司;FW-80型植物粉碎机 北京永光明医疗仪器有限公司;IKA RV10型旋转蒸发仪 德国;LDZX-50KBS型高压灭菌锅 上海申安医疗器械厂;SW-CJ-ID型超净工作台 苏州净化设备有限公司;DHP-420型恒温培养箱 北京市永光明医疗器械仪器厂;Nikon H 600L型显微镜 上海仪圆光学仪器厂。
1.2 实验方法
1.2.1 核桃青皮提取物的制备 将1.5g核桃青皮干粉溶解至15m L 80%乙醇溶液中,室温条件下反应45m in,将提取液低温(4℃)离心30m in(8000r/m in),然后真空抽滤,再将滤液45℃下旋转蒸去乙醇,得到20%的固体浓缩物,将浓缩物用超声波溶解在水中(做孢子萌发实验的供试液须隔夜再过滤),配制不同浓度的供试液,置于4℃冰箱备用。
1.2.2 最低抑菌浓度(M IC)和最低杀菌浓度(MBC)的测定[1]在无菌条件下,向培养皿里倒入9m L PDA培养基,再加入1m L供试液,对照组加入1m L无菌水,轻轻摇匀,制成带药的培养基,吸取待测菌种悬浮液100μL于培养皿表面,涂布均匀,置于28℃下培养48h,观察测试菌种的生长情况,已完全没有菌生长的最低浓度作为待测物的最低抑菌浓度MIC。把上述没有长菌丝的双碟平皿继续培养48h后取出观察,以完全无菌生长的为最低杀菌浓度MBC。
1.2.3 核桃青皮乙醇提取物对供试菌种孢子萌发率的活性测定[14]取在PDA培养基上培养6~7d的平板,用无菌葡萄糖溶液将孢子洗下,用四层纱布过滤,将滤液充分摇匀制成孢子悬浮液,在显微镜下调整其孢子含量为每视野50~60个。取载玻片,先加一滴供试液,对照组加入等量无菌葡萄糖溶液,然后再加入0.05m L的孢子悬浮液,每个处理重复3次。将玻片置于25~28℃培养箱中,12h后镜检,观察孢子萌发情况,统计100~150个孢子,并按下式计算萌发率和抑制率。

1.2.4 核桃青皮提取物对供试菌种菌丝生长活性的测定[15]无菌条件下,取1m L供试液与灭菌的9m L PDA培养基混合后,倒入直径为9cm培养皿,轻轻摇匀,制成带毒培养基,各浓度均重复3次;对照加入等量的无菌水,待凝固后,用直径6mm的打孔器在培养好的供试真菌菌落边缘切下菌饼反接于培养皿内,于28℃培养72h后观察结果,用十字交叉法测量菌落扩展直径,并按下式计算菌丝生长抑制率:
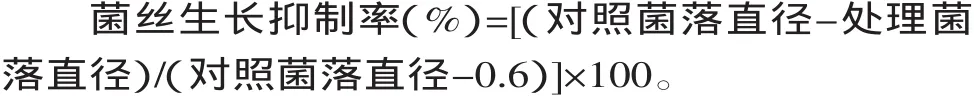
1.3 数据统计分析
用SPSS 13.0软件进行数据分析,用Duncan氏新复极差法对测试结果进行显著性分析。
2 结果与分析
2.1 最低抑菌浓度和最低杀菌浓度的测定
通过96h观察,可知核桃青皮提取物对5种供试菌种的MIC和MBC值(表1),对青霉菌的MIC和MBC值均为5mg/m L;对灰葡萄孢的MIC和MBC值均为10mg/m L;对镰刀孢和匍枝根霉的MIC、MBC值均为10.0mg/m L和15.0mg/m L;对交链孢属的MIC、MBC值分别为5.0mg/m L和10.0mg/m L。可见,核桃青皮在15.0mg/m L时能有效杀菌。
2.2 核桃青皮乙醇提取物对孢子萌发的影响

表1 核桃青皮提取物最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定结果Table1 Minimal inhibitory concentrations and bactericidal concentrations of extracts from walnutgreen husk
核桃青皮提取物对5种供试菌种的孢子均有显著的抑制作用(表2),不同浓度的提取物对同种菌的抑制率具有明显的差异(p<0.05),对镰刀菌的影响更为明显,当浓度为1mg/m L和5mg/m L时,对其的抑制率分别为10.24%和43.23%;当浓度为20mg/m L时,完全抑制了其孢子的萌发。随着提取物浓度的增加,对其他4种供试菌种的抑制作用也在增强,抑制率均能达到90%以上。通过SPSS分析软件对所得数据进行分析,得核桃青皮提取物对5种供试菌种孢子萌发抑制率的毒力回归方程以及EC50(见表3),5种供试菌种的EC50值的次序为青霉菌<镰刀菌<交链孢属<匍枝根霉<灰葡萄孢,表明提取物对不同菌种的抑制效果具有差异性,对青霉菌的抑制效果最明显,对镰刀菌、匍枝根霉、交链孢属的抑制作用次之,对灰葡萄孢的抑制效果最差,孢子萌发抑制率和毒力方程结果基本一致,核桃青皮提取物对供试菌种孢子萌发的抑制作用见图1。
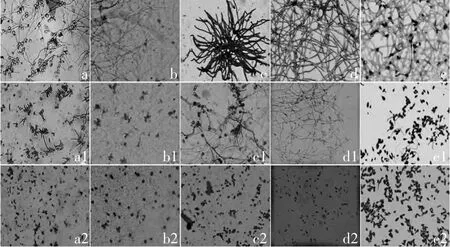
图1 核桃青皮提取物对供试菌种孢子萌发的抑制作用Fig.1 Inhibitory effectof EEW on the spore of pathogenic fungi
2.3 核桃青皮乙醇提取物对供试菌种菌丝生长抑制活性的影响
由表4可知,核桃青皮提取物对5种供试菌种菌丝生长均具有很强的抑制作用,不同浓度处理对同种病原菌的抑制效果不同(p<0.05),且随浓度的增大抑制作用增强;当提取物浓度为1mg/m L时,对5种供试菌种的抑制率均小于13%,但当浓度为20mg/m L时对大部分供试菌种的抑制率均在90%以上,其中对交链孢属抑制率达91.71%。通过SPSS软件对所得数据进行分析,得提取物对5种供试菌种的毒力回归方程及EC50(见表5),其中EC50值的次序为交链孢属<青霉菌<镰刀<匍枝根霉<灰葡萄孢,抑制效果与对孢子萌发的抑制作用基本趋势一致,对交链孢属和青霉菌的抑制效果均为明显。
3 讨论
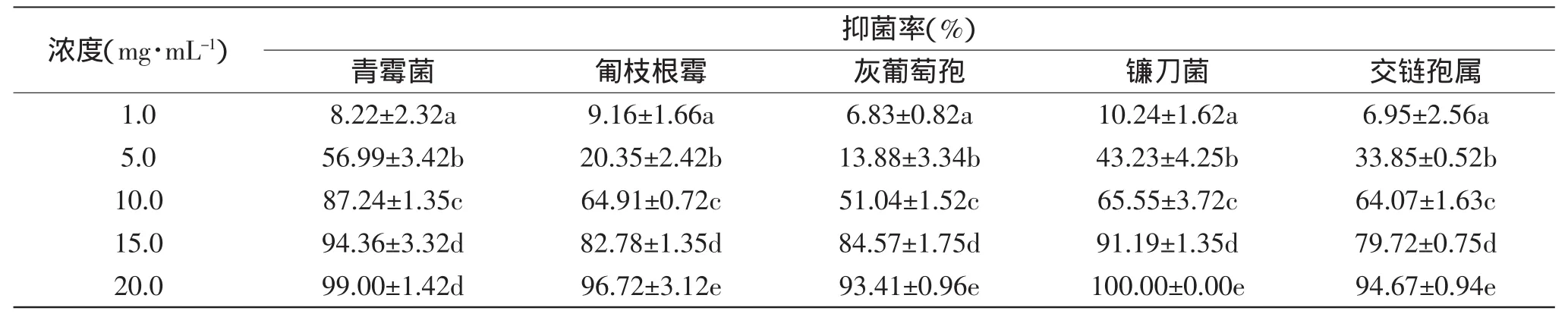
表2 不同浓度核桃青皮提取物对5种供试菌种孢子萌发的影响Table2 Inhibition effects of extracts from walnutgreen husk by different concentration on spore germination of 5 kinds of pathogenic fungus
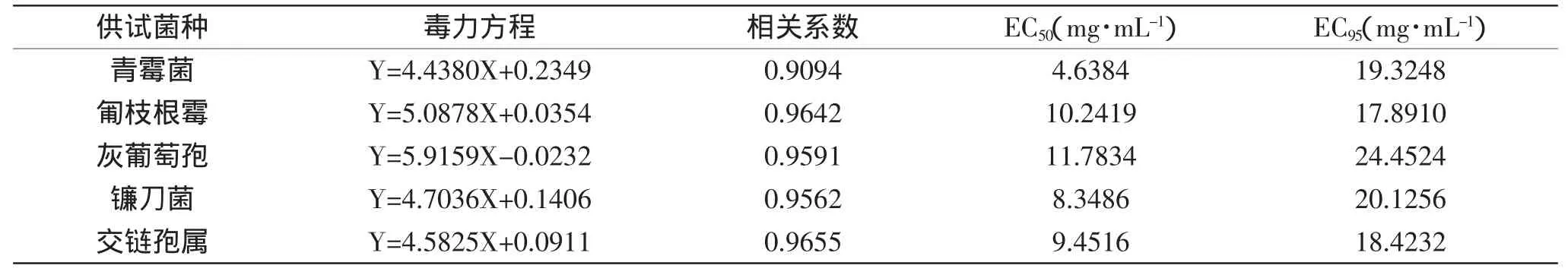
表3 核桃青皮提取物对5种供试菌种孢子萌发抑制作用的毒力方程Table3 Toxicity of extracts from walnut green husk on spore germination against5 kinds of pathogenic fungi
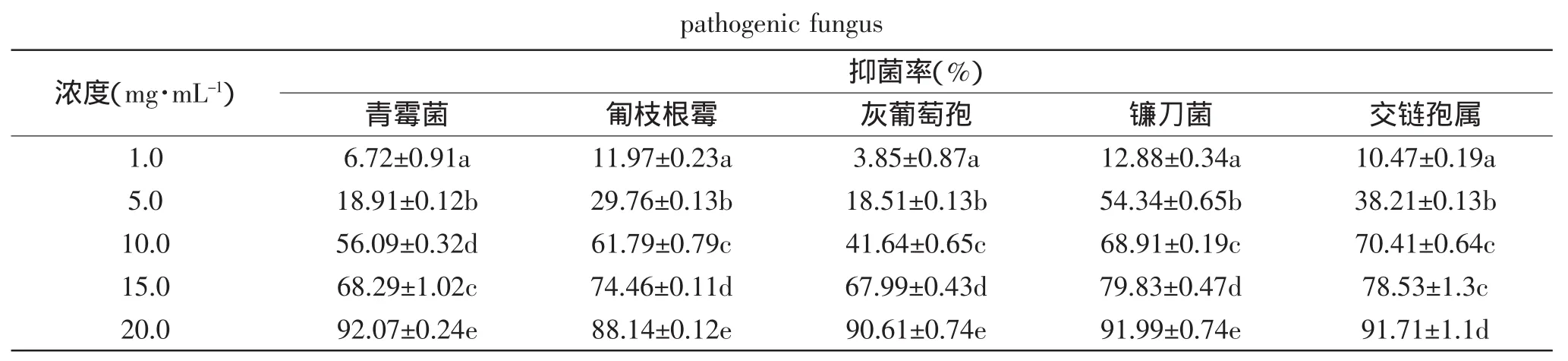
表4 核桃青皮提取物对5种供试菌种菌丝生长的抑制作用Table4 Inhibition effects of extracts from walnutgreen husk by different concentration on hyphal growth of 5 kinds of
核桃青皮中的多酚类、蒽醌类、香豆素类化合物均有较强的抑菌杀菌性[10,16-17],尤其对多种植物致病真菌有较强的抑制作用。翟继梅等[13]研究表明,核桃青皮乙醇提取物对水稻纹枯、棉花立枯等植物病原真菌具有较好的抑菌活性。苏学友等[18]研究表明核桃青皮水提物对苹果轮纹病菌、苹果腐烂病菌、小麦赤霉病菌等植物病原真菌抑菌效果明显。Oliveira等[7]对六种不同品种的核桃青皮提取物的抑菌性进行了对比研究,结果表明,不同品种的核桃青皮提取物对植物真菌均有显著的抑制作用。本研究发现核桃青皮提取物对几种采后病原真菌的菌丝生长和孢子萌发均有较好的抑制作用,对交链孢属和青霉菌的抑制效果更为明显,与上述核桃青皮提取物对植物真菌抑制作用的报道一致。目前,关于核桃青皮提取物有效抑菌成分的研究相对较少,刘丹萍等[19]通过对核桃青皮中胡桃醌抑菌性的测定,奠定了胡桃醌为核桃青皮主要有效抑菌成分的基础。但是核桃青皮提取物成分相当复杂,其抑菌性可能为各种酚类物质的协同作用,因此其抑菌机理有待进一步确定。
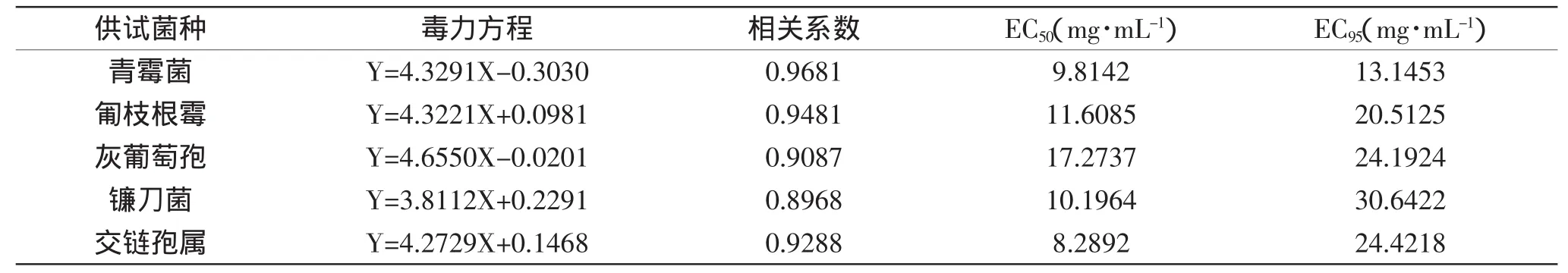
表5 核桃青皮提取物对5种供试菌种菌丝生长抑制作用的毒力方程Table5 Toxicity of extracts from walnutgreen husk hyphal growth of 5 kinds of pathogenic fungi
以往研究表明,很多植物提取剂对果蔬有一定的防腐保鲜作用,且大部分植物提取物成分之间存在明显抗菌性的协同增效作用[20-21],将提取物进行复配能够克服或延缓病原菌的抗药性、扩大杀菌范围,提高防腐效果[4,22]。因此,对核桃青皮的进一步研究可致力于将其与抗氧化能力强、成膜效果好的物质进行复配,根据不同果蔬的不同储藏特性,对特定的果蔬进行最优配方的选择。
4 结论
本实验中,核桃青皮提取物对5种果蔬采后主要病原真菌均有较好的抑制效果,对孢子萌发和菌丝生长的抑制作用趋势大体一致,表明其在果蔬采后病害防治上有较大的应用潜力。本课题组下一步将致力于其主要抑菌活性物质的分离纯化与结构分析的研究,从而明确抑菌的物质基础以及在果蔬贮藏过程中的病害防治效果。
[1]杨红,关文强,杨家荣.丁香精油及其与壳聚糖复合物对水果采后病原菌的抑制作用[J].植物保护,2006,32(4):70-73.
[2]高兆银,胡美娇,李敏.壳聚糖对热带水果采后病原菌的抑茵活性研究[J].中国南方果树,2008,37(4):51-53.
[3]周家华,常虹,赵毅,等.中国果蔬冷链物流的发展现状及建议[J].食品工业科技,2012,33(6):8-10.
[4]Shi Zai Feng,Guang Ying Chen,Xiao Peng Zhang,et al.Preservation of fresh areca nuts with several herbal medicine extracts[J].Advanced Materials Research,2013,647:532-537.
[5]妮蒋,覃柳燕,陈乾平,等.10种香料植物挥发油的抑菌活性研究[J].植物保护,2012,38(1):104-107.
[6]何首林,何军,高保卫,等.28种植物提取物对苹果、番茄防腐保鲜活性研究[J].西北林学院学报,2012,27(6):115-119.
[7]Oliveira Ivo,Anabela Sousa,Isabel C FR Ferreira,etal.Total phenols,antioxidant potential and antimicrobial activity ofwalnut(Juglans regia L.)green husks[J].Food and Chemical Toxicology,2008,46(7):2326-2331.
[8]李福荣,王庆国,韩纪举,等.青龙衣有效成分的初步提取分离及体外抗肿瘤活性研究[J].时珍国医国药,2011,22(3):608-609.
[9]赵国建,王向东,王未芳.核桃青皮多酚的抗氧化性研究[J].农产品加工,2011,36(2):36-39.
[10]Pereira JoséAlberto,Ivo Oliveira,Anabela Sousa,et al.Bioactive properties and chemical composition of six walnut(Juglans regia L.)cultivars[J].Food and Chemical Toxicology,2008,46(6):2103-2111.
[11]Mikulic-Petkovsek M,A Slatnar,R Veberic,et al.Phenolic response in green walnut husk after the infection with bacteria Xanthomonas arboricola pv.juglandis[J].Physiological and Molecular Plant Pathology,2011,76(3-4):159-165.
[12]Liu Junxi,MinMeng,Chen Li,etal.Simultaneousdetermination of three diarylheptanoids and anα-tetralone derivative in the green walnut husks(Juglans regia L.)by high-performance liquid chromatography with photodiode array detector[J].Journal of Chromatography A,2008,1190(1-2):80-85.
[13]翟梅枝,王磊,何文君.核桃青皮乙醇提取物抑菌活性研究[J].西北植物学报,2009,29(12):2542-2547.
[14]孙广宇,宗兆锋.植物病理学实验技术[M].北京:中国农业出版社,2002:153.
[15]方中达.植病研究方法[M].北京:中国农业出版社,2007:140.
[16]Carvalho Márcia,Pedro J Ferreira,Vanda S Mendes,et al.Human cancer cell antiproliferative and antioxidant activities of Juglans regia L[J].Food and Chemical Toxicology,2010,48(1):441-447.
[17]Li Chen,Jun-Xi Liu,Liang Zhao,et al.Capillary zone electrophoresis for separation and analysisof four diarylheptanoids and anα-tetralone derivative in the green walnut husks(Juglans regia L.)[J].Journal of Pharmaceutical and Biomedical Analysis,2008,48(3):749-753.
[18]苏学友,李疆,师光禄,等.核桃青皮提取物对6种植物病原真菌的抑茵活性研究[J].北京农学院学报,2008,1(1):42-44.
[19]刘丹萍,张力钦,陈安良,等.山核桃外果皮中胡桃醌含量测定及抑菌活性[J].农药,2010,49(9):686-688,701.
[20]李海燕,刘桂萍,刘蕾.壳聚糖复合涂膜常温保鲜草莓的研究[J].食品工业科技,2012,33(1):359-362.
[21]何燕文,韦剑峰.中草药提取物保鲜果蔬的应用研究概述[J].广东农业科学,2005,36(1):85-87.
[22]周建新.植物源天然食品防腐剂的研究现状、存在问题及前景[J].食品科学,2006,27(1):263-268.

