人正常及骨关节炎关节软骨细胞的体外分离培养及鉴定
张庆,翁绳健,陈宝军,闫虎,王艺茹,张子怡,苏友新
(1.福建中医药大学,福建福州350122;2.福州市中西医结合医院,福建福州350007)
骨关节炎(osteoarthritis,OA)又称骨关节病,是以关节软骨退变及破坏为主要病理特征的慢性关节疾病,其病理过程的中心环节是关节软骨的退变[1-2]。关节软骨由软骨细胞和软骨基质组成,软骨细胞是关节软骨的唯一细胞成分,其生物学特征的变化与OA的发生发展密切相关[3]。借助人软骨细胞体外分离培养的方法进行人正常关节及人OA关节软骨细胞生物学特征观察,可为OA的防治提供研究基础[4]。
1 材料与方法
1.1 标本来源从福州市中西医结合医院骨科获得因下肢损毁性创伤手术废弃的髋、膝正常关节软骨标本各2例[男2例,女2例;年龄42~57岁,平均(51.00±6.98)岁],6例原发性膝OA患者行全膝人工关节置换术废弃的退变关节软骨标本[男2例,女4例;年龄58~73岁,平均(67.50±5.24)岁]。原发性膝OA诊断标准参照中华医学会骨科学分会《骨关节炎诊治指南》[5]。以上标本的获取已获得福州市中西医结合医院医学伦理委员会批准并征得患者知情同意。
1.2 实验试剂0.25%胰蛋白酶消化液、高糖DMEM培养基、优等胎牛血清(美国Hyelone公司);II型胶原酶(美国Invitrogen公司);Rabbit Anti-Colla⁃gen II(北京博奥森生物技术有限公司);甲苯胺蓝染色剂(北京鼎国昌盛生物技术有限责任公司);免疫组化试剂盒(SABC法)(武汉博士德生物工程有限公司)。
1.3 实验仪器超净工作台(苏州安泰空气技术公司);倒置显微镜(日本OLYMPUS株式会社);二氧化碳培养箱(香港利康公司);电子天平[奥豪斯仪器(上海)有限公司];全自动高压灭菌锅(山东新华医疗器械股份有限公司)。
1.4 实验方法
1.4.1 原代软骨细胞的分离与培养软骨细胞的分离培养方法参考文献操作[6]。手术取下软骨标本后立刻用生理盐水反复冲洗残留的血液和组织液,低温无菌保存,90 min内转移至实验室超净工作台。用含1%双抗(青霉素100 U/mL、链霉素100 μg/mL)PBS液漂洗3遍后,先用手术刀片薄层削弃关节面外层软骨组织以避开增生骨赘表面的薄层纤维软骨,然后薄层削取关节中心区域的软骨薄片并避开软骨下骨组织,再用含1%双抗PBS液漂洗软骨薄片3遍后用手术刀将软骨切碎至1 mm3大小,再次用含1%双抗PBS液漂洗小软骨粒3遍(见图1)。漂洗后的软骨粒投入0.25%胰蛋白酶消化液中(软骨组织与消化液体积比约为1∶5)37℃消化30 min,吸弃胰蛋白酶消化液,再用0.2%Ⅱ型胶原酶(用含1%双抗的10%FBS/DMEM配制)37℃恒温水浴摇床中震荡消化约16 h,离心,弃上清,细胞经DMEM培养基洗涤3遍后再离心,弃上清,加20%FBS/DMEM培养液5 mL,200目钢网过滤后将细胞悬液稀释成2.5×105/mL密度接种于培养瓶,37℃5%CO2饱和湿度的培养箱中培养。48 h后视细胞贴壁情况更换培养液,每天用倒置显微镜观察细胞生长速度和形态并照相,每3 d更换1次培养液。
1.4.2 软骨细胞的传代培养细胞铺满瓶底约80%时传代,吸弃原培养液,加5 mL PBS漂洗2次,加0.25%的胰蛋白酶消化液2.5 mL,稍振荡培养瓶后放入37℃培养箱中消化3 min,倒置显微镜下观察并稍振荡培养瓶,待软骨细胞大部分悬浮时,加5 mL 20%FBS/DMEM培养液中止消化,反复轻轻吹打培养瓶底壁后将细胞悬液移至15mL离心管,1000r/min离心5 min。弃上清,加入9 mL的20%FBS/DMEM培养液轻轻吹打使细胞均匀悬浮,分别吸取3 mL细胞悬液接种于3个培养瓶中,依次再向每个培养瓶中添加20%FBS/DMEM培养液2 mL。轻轻振荡后将细胞置于37℃5%CO2饱和湿度的培养箱中继续培养,每天用倒置显微镜观察软骨细胞生长情况并照相,每3 d更换1次培养液,细胞长满瓶底约80%时再次传代。
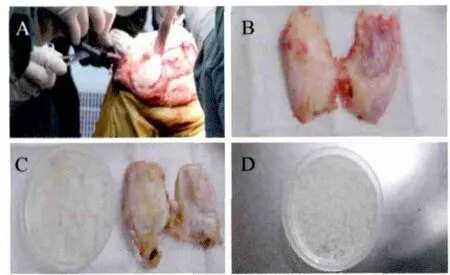
图1 分离软骨组织
1.4.3 形态学观察每天用倒置显微镜分别对原代、第1代、第2代人正常和人OA关节软骨细胞进行观察并照相记录。
1.4.4 甲苯胺蓝染色将第2代人正常和人OA关节软骨细胞分别接种于置有盖玻片(经4%多聚赖氨酸处理)的6孔板中,每孔5×104个细胞,48 h后观察细胞贴壁情况,并更换培养液,以后每3 d更换1次培养液,倒置显微镜下观察并照相记录。当细胞铺满盖玻片约60%时弃培养基,取出盖玻片,PBS缓冲液轻轻漂洗3遍,滴加4%多聚甲醛室温固定30 min,再用PBS缓冲液轻轻漂洗3遍,加入体积分数1%甲苯胺蓝染色液室温放置30 min,然后用蒸馏水冲洗至蓝色大致消失,自然晾干,封片并照相记录。
1.4.5 Ⅱ型胶原免疫组织化学染色严格按照Ⅱ型胶原免疫组化试剂盒说明操作。最后加第二抗体室温孵育30 min,加SABC工作液,室温孵育20 min,PBS漂洗5 min×3次,滴加DAB工作液,室温显色5 min,水洗,自然晾干,封片并照相记录。
2 结果
2.1 关节软骨细胞的形态学观察倒置显微镜下观察,人正常原代关节软骨细胞接种24 h即可贴壁,贴壁后的软骨细胞多呈圆形、椭圆形或短梭形,胞浆丰富,胞核呈圆形,居中,有1~3个核仁,呈“笑脸状”,均匀散在生长,部分细胞融合生长,呈“铺路石状”,约14 d单层即铺满培养瓶底80%;传代后的第1代、第2代软骨细胞生长速度加快,约10 d即可传代,至第3代软骨细胞表型仍稳定。人OA原代关节软骨细胞接种后在24~48 h贴壁,贴壁后的软骨细胞多呈长梭形、不规则形或树突状,呈“铺路石状”细胞群落少见,生长速度较慢,原代细胞接种后20 d才铺满培养瓶底80%。第1、2代软骨细胞传代时间均需14 d,至第3代软骨细胞形态更多样,生长更加缓慢。见图2。

图2 第2代人关节软骨细胞
2.2 甲苯胺蓝染色取第2代人正常和人OA关节软骨细胞经甲苯胺蓝染色,二者均可见蓝紫色异染颗粒,细胞核染成深蓝色,细胞质呈浅蓝色。人正常关节软骨细胞形态规则,体积较大,蓝紫色异染颗粒较多(图3-A)。人OA关节软骨细胞形态不规则,体积较小,蓝紫色异染颗粒较少(图3-B)。
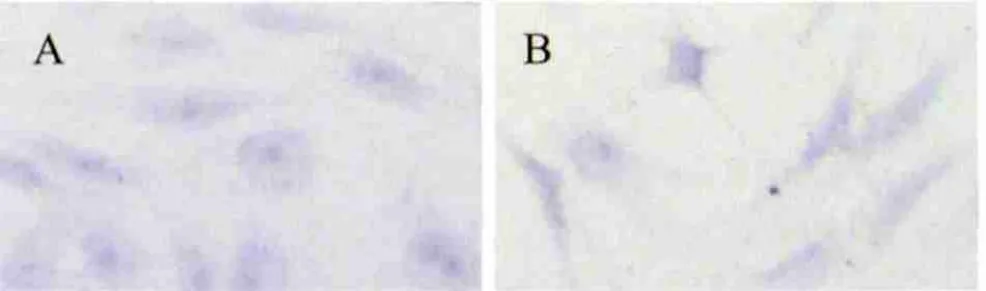
图3 第2代人关节软骨细胞甲苯胺蓝染色(100×)
2.3 Ⅱ型胶原免疫组织化学染色取第2代人正常和人OA关节软骨细胞经Ⅱ型胶原免疫组织化学染色,二者均可见棕黄色异染颗粒,细胞核呈深棕黄色,细胞质呈浅棕黄色。人正常关节软骨细胞形态规则,体积较大,棕黄色异染颗粒较多(图4-A)。人OA关节软骨细胞形态不规则,体积较小,棕黄色异染颗粒较少(图4-B)。

图4 第2代人关节软骨细胞Ⅱ型胶原免疫组织化学染色(100×)
3 讨论
目前研究普遍认为,OA是以关节软骨退变及破坏为主要病理特征的慢性关节疾病,因此体外分离培养人软骨细胞是研究OA复杂病理机制的重要途径。利用酶消化分离原代软骨细胞的方法较多[7-8],本实验采用胰蛋白酶联合Ⅱ型胶原酶两步酶消化法,第一步用胰蛋白酶可以水解软骨基质中的蛋白聚糖,并且可以除去软骨组织中可能混杂的其它组织成分,如结缔组织、滑膜及血细胞等;第二步经过胶原酶的消化及振荡,能针对性地水解软骨基质中的胶原网架,促进软骨细胞周围胶原蛋白的水解,加快软骨细胞的解离速度,大量高纯度的软骨细胞就可以分离出来。实验结果证实两步酶消化法能从人关节软骨中分离获取足够的软骨细胞进行原代、传代培养。
软骨组织由唯一的软骨细胞和其合成并分泌的基质构成,所以软骨细胞的活性对维持细胞外基质代谢平衡和软骨组织的正常功能起重要作用。研究[9-10]表明:OA病理过程与软骨细胞退化、合成分泌基质能力的降低,以及软骨基质的降解加速密切相关。软骨基质中最主要的成分是Ⅱ型胶原和蛋白多糖,其中的蛋白多糖分子由一个核心蛋白和许多附着于其上的糖胺多糖(GAG)组成。GAG包括透明质酸、硫酸软骨素、硫酸角质素和硫酸皮肤素等,均是由软骨细胞合成并分泌。故观察软骨细胞中Ⅱ型胶原及蛋白多糖构成成分GAG等合成的情况,可以判断软骨细胞的功能状态。并且有研究[11-12]证实,OA中晚期伴随着软骨细胞的退化,其合成并分泌Ⅱ型胶原及蛋白多糖的功能逐渐下降。
本实验观察到人正常关节软骨颜色洁白略黄,表面光滑整齐,质地柔软有弹性;人OA关节软骨则为淡黄色,表面粗糙不平整,中间有剥脱与局灶性侵蚀缺损,严重者软骨下骨外露,弹性下降,呈现关节软骨明显的退变破坏病理表现;同时实验中观察到的软骨细胞形态、生长状况显示,人OA关节软骨细胞比正常关节来源的软骨细胞生长缓慢,传代后表型多样且欠稳定。细胞的形态及其功能具有一致性,本研究采用目前常用的甲苯胺蓝染色和免疫组织化学染色方法来观察软骨细胞Ⅱ型胶原和蛋白多糖成分的含量改变[13],显示体外分离培养的人OA关节软骨细胞两种染色法出现的异染颗粒均少于正常关节来源的软骨细胞,提示OA来源的软骨细胞合成Ⅱ型胶原和蛋白多糖的能力降低。因此,本研究从细胞生长状况、形态与相关功能观察均表明,分离自OA患者退变关节软骨并培养的关节软骨细胞符合软骨细胞退变的表现,可为OA的相关实验研究提供细胞来源。
本研究只比较分离自人正常关节软骨和人OA关节软骨的软骨细胞部分生物学特征,未考虑年龄及其它因素对软骨细胞形态与功能的影响。引起原发性OA关节软骨细胞退化的原因尚未完全明确,可能与增龄、应力负荷、性别、遗传等多因素有关,针对相关因素对体外培养软骨细胞影响的研究有待于今后进一步开展。
[1] BIAN Q,WANG Y J,LIU S F,et al.Osteoarthritis:genetic factors,animal models mechanisms,and therapies[J].Front Biosci(Elite Ed),2012(4):74-100.
[2] 邱贵兴,荣国威.骨科学[M].北京:中国协和医科大学出版社,2002:506.
[3] KIM H A,BLANCO F J.Cell death and apoptosis in osteoarthritic cartilage[J].Curr Drug Targets,2007,8(2):333-345.
[4] JIANG Y Z,ZHANG S F,QI Y Y,et al.Cell transplantation for ar⁃ticular cartilage defects:principles of past,present,and future practice[J].Cell Transplant,2011,20(5):593-607.
[5] 中华医学会骨科学分会.骨关节炎诊治指南[S].中国医刊,2007,42(12):30-32.
[6] 胡炯,李笑颜,邓廉夫,等.人正常软骨细胞和骨性关节炎软骨细胞体外培养对照研究[J].中国中医骨伤科杂志,2010,18(10):8-12.
[7] MANNING W K,BONNER WM JR.Isolation and culture of chon⁃drocytes from human adult articular cartilage[J].Arthritis Rheum,1967,10(3):235-239.
[8] Klagsbrun M.Large-scale preparation of chondrocytes[J].Meth⁃ods Enzymol,1979(58):560-564.
[9] ALMONTE-BECERRIL M,NAVARRO-GARCIA F,GONZA⁃LEZ-ROBLES A,et al.Cell death of chondrocytes is a combina⁃tion between apoptosis and autophagy during the pathogenesis of Osteoarthritis within an experimental model[J].Apoptosis,2010,15(5):631-638.
[10] VENN M,MAROUDAS A.Chemical composition and swelling of normal and osteoarthrotic femoral head cartilage.I.Chemical com⁃position[J].Ann Rheum Dis,1977,36(2):121-129.
[11] JALBA B A,JALBA C S,VLADOI A D,et al.Alterations in ex⁃pression of cartilage-specific genes for aggrecan and collagen type II in osteoarthritis[J].Rom J Morphol Embryol,2011,52(2):587-591.
[12] TASKIRAN D,STEFANOVIC-RACIC M,GEORGESCU H,et al.Nitric oxide mediates suppression of cartilage proteoglycan synthe⁃sis by interleukin-1[J].Biochem Biophys Res Commun,1994,200(1):142-148.
[13] SCHWARTZ N B,PIROK EW 3RD,MENSCH JR JR,et al.Do⁃main organization,genomic structure,evolution,and regulation of expression of the aggrecan gene family[J].Prog Nucleic Acid Res Mol Biol,1999(62):177-225.

