中低位局部进展期直肠癌术前放化疗后手术间隔时间对降期及预后的影响
方军 余阳 许涛 张应天
1982年Heald[1]提出全直肠系膜切除(total mesorectal excision,TME)的概念并广泛应用之后,直肠癌的外科治疗效果上了一个台阶。通过TME和双吻合器技术的推广以及手术方式的改进,直肠癌的手术效果有了很大提高,复发率显著降低。患者长期生存率、保肛率和生活质量显著提高。但是,愈来愈多的研究提示,单纯通过手术技术的改进已经很难大幅度地提高直肠癌(特别是中低位直肠癌)的治疗效果,只有通过放化疗等综合治疗才可能使治疗效果得到进一步提高。其中,如何解决中低位局部进展期直肠癌术后复发,提高5年生存率,是令外科医生煞费思量的问题。多学科综合治疗模式日益受到重视,术前放化疗能实现肿瘤降期、降低局部复发率、提高保肛率的目的,美国国立综合癌症网(NCCN)已经将之作为局部进展期直肠癌的标准治疗方法。经过近20年的不断研究,中低位局部进展期直肠癌行术前放化疗现已成为共识,但有关术前放化疗与手术最佳间隔时间目前仍有争论[2]。江汉大学附属医院胃肠外科自2003年开始,对局部进展期中低位直肠癌行术前放化疗后手术,前期病例在放化疗结束4~6周后手术,后期病例则在放化疗结束8周后手术,分别取得了不同效果。现将两组病例的对比观察结果报告如下。
资料与方法
一、病例及选择标准
选取2003年1月至2013年12月中低位局部进展期直肠癌共70例(肿块下缘距离齿状线≤10 cm)。全部病例皆有组织病理学证据,直肠指检和直肠镜检提示肿块固定不易推动,术前常规行直肠腔内B超、盆腔CT或MRI,病变符合T3/T4期或N+。影像学检查确定无肝、肺等远处转移。2003年1月至2008年12月为前期病例(A组),共32例,其中男性19例,女性13例,年龄26~8l岁,中位年龄63岁。2009年1月至2013年12月为后期病例(B组),共38例,其中男性22例,女性16例,年龄32~79岁,中位年龄62岁。放化疗前两组临床分期比较见表1。

表1 放化疗前两组临床分期比较(例)
二、治疗方法
1.术前新辅助放化疗 所有病例采用化疗-放疗-化疗-手术的治疗模式。两组病例术前放疗方案相同,放疗前先行增强CT三维重建定位后进行适形投照。每周放疗5次,每次180cGy,分盆腔和骶尾部两野照射,共5周,总剂量4 500cGy。两组病例化疗方案及肿瘤下缘距齿线距离比较见表2。
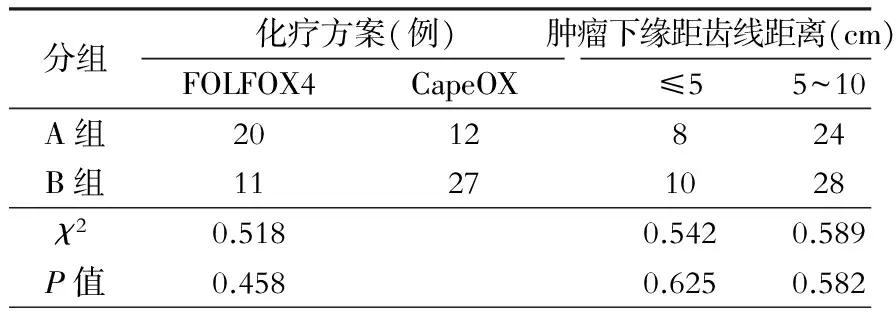
表2 两组病例化疗方案及肿瘤下缘距齿线距离比较
2.术前放化疗与手术间隔时间 前期病例放化疗结束4~6周后手术,后期为放化疗结束8周后手术。
3.手术 手术均为开腹,均按TME操作原则进行。估计远端超过癌肿2 cm断肠无肿瘤残留者,行低位前切除术(Dixon术),否则行经腹会阴联合切除术(Miles术)。术中解剖肠系膜下动脉根部周围及主干两侧淋巴脂肪组织,单独送检查找顶端淋巴结;保留左结肠动脉和乙状结肠动脉,于起始部结扎直肠上动脉,然后于同一平面结扎直肠上静脉。整块切除直肠或中上段直肠及直肠系膜。
4.病理检查 检查原发灶组织学类型、分化程度和侵犯深度,切除直肠标本断端0.5 cm切片,苏木精-伊红染色镜检判断有无肿瘤残留;肠系膜下动脉根部周围及其主干两侧淋巴脂肪组织,以及直肠系膜采用淋巴结显示技术,全数取出标本中的淋巴结,每枚淋巴结分3个平面做6张切片苏木精-伊红染色,1张切片细胞角蛋白免疫组织化学染色镜检,判断有无癌细胞转移。
5.疗效评估 放化疗后肿瘤病理学反应分三类:①完全病理缓解(pathologic complete response,pCR);②部分病理缓解;③无病理缓解。本研究中术后原发灶病理变化按Mandard肿瘤消退分级进行评估[3],Mandard分级病理学特征Ⅰ级:无癌细胞残留; Ⅱ级:散在孤立的癌巢;Ⅲ级:较多癌细胞残留,但仍以纤维化为主(>50%);Ⅳ级:残留癌细胞为主,伴部分纤维化(<50%);Ⅴ级:肿瘤无任何消退表现,无纤维化。与传统描述肿瘤病理学变化方法相对应关系如下:①Mandard Ⅰ级:完全病理缓解;②Mandard Ⅱ级、Ⅲ级、Ⅳ级:部分病理缓解;③Mandard V级:无病理缓解。
6.随访 所有患者术后均继续按术前新辅助化疗方案化疗4个疗程。化疗结束后进行门诊及电话随访。随访内容除常规理学检查外,还包括直肠镜检、肝、肺、盆腔影像学检查及血清癌胚抗原(CEA)监测,以判断有无远处转移及局部复发,随访时间为1~2年每3个月一次,3~5年每6个月一次,5年后每年一次。本组病例随访4~142个月,中位随访时间87个月。
三、研究方法
比较两组病例手术标本原发灶Mandard分级、术后pTNM分期和临床结局。记录所有患者总体生存(overall survival,OS)及无瘤生存(disease-free survival,DFS)时间,用Kaplan-Meier生存曲线计算5年生存率,并进行生存率log-rank检验。为保证两组资料的可比性,两组病例术后病理分期均采用UICC/AJCC第7版TNM分期方案。
四、统计学方法
结 果
所有病例均接受开腹手术,其中Dixon术48例,Miles术22例。均为R0切除,无手术死亡病例。发生吻合口漏2例,A、B两组各1例,均予局部引流后痊愈。
一、放化疗后术前两组临床分期比较
两组病例放化疗后术前再行临床分期比较,见表3。经表3和表1对比发现两组T和N分期较放化疗前均获得明显降期。表3中提示B组较A组获得更明显的降期效果,其中临床完全缓解(cT0N0)率表现尤为突出(5/38,13.1%比0,χ2值=9.788,P=0.001)。
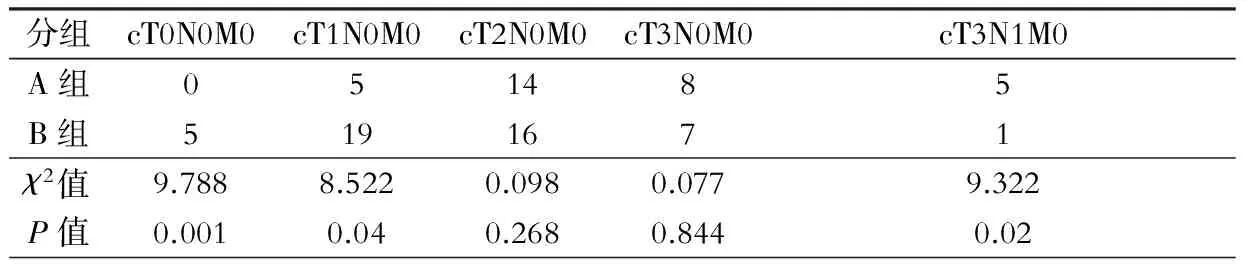
表3 放化疗后术前两组临床分期比较(例)
二、术后病理学Mandard分级及pTNM分期
术后两组Mandard分级及ypTNM分期结果比较见表4。

表4 两组病例术后病理学变化:Mandard分级、ypTNM分期及无细胞黏液池(例)
注:*其中5例为Mandard分级I级(完全病理缓解)
三、保留肛门比例
全组病例施行Dixon术48例,Miles术22例,保留肛门比例为68.6%。A组病例Dixon术与Miles术比例为21∶11,保肛率为65.6%;B组比例为29∶9,保肛率为76.3%。两组比较差异有统计学意义(χ2=9.506,P=0.04)。肿瘤下缘距离齿状线≤5 cm患者,A组共8例,行Dixon术5例,保肛率为62.5%;B组共10例,行Dixon术8例,保肛率为80.0%,两组比较差异亦有统计学意义(χ2=9.621,P=0.02)。
四、两组5年DFS率及OS比较
随访期间,前期病例局部复发2例(6.3%),肝转移4例(12.5%),肺转移3(9.4%),死亡4例(12.5%);后期病例局部复发1例(2.6%),肝转移2例(5.3%),肺转移1例(2.6%),死亡1例(2.6%)。结果示A、B两组间5年DFS及OS分别为75.0%比89.5%(χ2=7.48,P=0.002)及87.5%比97.4%(χ2=8.56,P=0.008)。经亚组分析,B组5例pCR病例中3例存在无细胞黏液池,另外2例不存在,两者5年DFS及OS分别为95.2%比96.3%(χ2=2.36,P=0.884)及97.5%比95.4%(χ2=2.57,P=0.828)。
讨 论
1997年,瑞典一项多中心临床试验第一次证明了术前小剂量短程放疗有助于提高局部进展期直肠癌(T3/T4期)的生存率[4]。
虽然放化疗再手术作为中低位局部进展期直肠癌标准治疗模式现已成为共识。但有关术前放化疗与手术最佳间隔时间仍无定论。
一、术前放化疗与手术间隔时间
1999年,Lyon R90-01试验[5]是首个关于直肠癌术前放化疗与手术间隔时间的研究,其比较间隔2周(短期)与间隔6周(长期)的不同影响,结果示间隔6周可获得更好的肿瘤病理反应及病理降期,但两组并发症率及生存时间并无明显差异。基于此研究结论,故将间隔6周定为当时的治疗标准。
理想的手术间隔时间应是能促进最大的肿瘤退化及病理降期、可接受的组织急性辐射反应及术前局部炎症消退、最低的手术风险及术后并发症率及获得更好的生活质量及更长的生存时间。有研究认为,肿瘤对放化疗的反应呈时间依从性,肿瘤完全退化常需数月[6]。但过长的间隔时间可致肿瘤进展,导致远处转移。此外残余肿瘤细胞快速增殖可导致多重耐药性。另有研究认为,手术间隔时间6~8周增加了手术技术风险,主要因为放疗导致盆腔纤维变性,致手术并发症增加、局部复发率升高[7]。因此这些缺点可解释上述研究结论,即较长时间隔虽获得更好的局部控制,但生存上并未获得优势。
然而,新近的回顾性研究认为,延长手术间隔时间至≥8周,甚至12周可进一步提高肿瘤降期率及pCR,从而提高DFS及OS,且不增加手术难度及并发症率[8]。而最近又有研究发现,对于新辅助治疗后获得pCR病例采用非手术治疗策略,其OS与手术相比差异无统计学意义,故提出“watch and wait”观点[9]。
何为最佳手术间隔时间,仍是今后需要进一步探索的问题。我们前期病例选择在新辅助治疗结束4~6周后手术。期间我们曾遇到一典型病例:此患者放化疗后6周接受Dixon手术,术后分期ypT1N0M0,但提示远端切缘阳性,遂2周后再接受Miles手术,病理检查却未见癌残留。此典型病例提示肿瘤对放化疗的反应,间隔8周较4~6周更好。因此,另据文献报道,我们自2009年1月以后的后期病例,改为在新辅助治疗结束8周后手术。
二、术前放化疗后手术间隔时间与肿瘤降期
术前放化疗后一项重要指标是临床-病理降期。降期是指依据术前影像学临床分期,对比病理检查后的T和N分期,判断是否发生了分期改变。
Lyon R90-01试验[5]已证实与短期间隔(2周)比较,较长间隔时间(6周)可获得更好的肿瘤临床反应率(71.7%比53.1%)及肿瘤病理学反应率(26.0%比10.3%),P<0.05。pCR率(13.8%比7.1%),但差异无统计学意义。此研究还发现对N2病例,较长间隔时间可获得更好的淋巴结病理反应率,即N分期下降。
Sloothaak等[8]一项最近的关于术前放化疗-手术间隔时间与肿瘤退化的公开研究(n=1593),结果示间隔10~11周可获得更高的pCR率。此外对于淋巴结的病理反应结果与Lyon R90-01试验结果一致。
早在9年前即有学者研究发现在食管癌或食管-胃结合部腺癌行术前放化疗再手术的标本中,对原发灶行HE染色病理检查发现有无细胞的黏液池现象(即原发灶中存在大量黏液蛋白池而无癌细胞),特别对于印戒细胞癌或黏液腺癌病例此现象尤为突出,并将出现无细胞黏液池现象等同于完全病理缓解[10]。随后在直肠癌接受新辅助放化疗再手术的研究中也发现相同现象,并逐渐得到普遍公认[11-12]。
本组病例放化疗结束后术前再行临床分期经表3和表1对比,发现两组T和N分期较放化疗前均获得明显降期。另外,我们通过对本组前期与后期病例的对比研究发现,新辅助治疗8周后再手术,较4~6周可获得更为明显的病理降期效果,其中A、B两组ypT0N0M0病例(即pCR)分别为0例、5例(P=0.04,表4)。表4中还提示B组中Mandard分级Ⅰ级、Ⅱ级比例(13/38,34.2%)较A组明显升高(2/32,6.25%),P=0.02。
此外我们在后期5例Mandard Ⅰ级(即pCR)病例标本中也发现3例存在无细胞黏液池现象,而前期病例中无此现象存在。说明无细胞黏液池多存在于pCR病例中,此与文献报道一致。
三、术前放化疗后手术间隔时间与保肛率
理论上,新辅助治疗可使肿瘤细胞变性、纤维组织增生,原发灶不同程度的缩小,肿瘤下缘与齿状线间的距离更为清楚,能够保留一个理想、安全的远端切缘。但关于术前放化疗可增加低位直肠癌的保肛率仍存争议。2004年,德国直肠癌研究组对823例T3/T4期局部进展期直肠癌进行随机对比试验,结果发现术前放化疗使患者保肛率增加1倍[13]。另一系统综述和Meta分析[14]比较术前放疗和术前放化疗的不同影响,结果显示术前放化疗可明显提高pCR率(P<0.001),但两者保肛率差异无统计学意义(P<0.29)。早期的Lyon R90-01试验结果提示延长术前放化疗-手术时间间隔至6周较2周可降低经腹会阴联合切除术率。然而,上述以及目前的有关术前放化疗-手术时间间隔与保肛率关系的研究结论差异均无统计学意义,因此尚无统一定论。
本文前期病例是在放化疗结束4~6周后手术,保肛率为65.6%;后期病例改为放化疗结束8周后手术,保肛率上升到76.3%。差异有统计学意义(P=0.04)。对于肿瘤下缘距离齿状线≤5 cm的低位或超低位患者,保肛率B组较A组亦明显提高(80%比62.5%),差异有统计学意义(P=0.02)。但考虑到病例数较少,故结论还有待后期进一步研究。
四、术前放化疗后手术间隔时间与局部复发率
决定直肠癌手术后局部复发的关键因素是严格执行TME手术原则,从而达到R0切除,其中以环周切缘阴性最为重要。
早在20世纪80年代,国外学者就已证明,术前放疗使直肠癌术后局部复发率下降50%~60%。两项大宗病例RCT研究证实,联合应用新辅助放化疗可使局部进展期直肠癌术后原位复发率进一步下降。de Campos-Lobato等[15]比较术前放化疗-手术时间间隔≥8周与<8周3年局部复发率(1.2%比10.5%),差异有统计学意义。另有对比研究发现,延长新辅助治疗与手术时间间隔(≥8周),可增加R0切除率,使直肠癌术后局部复发率更低[16]。
本组前期病例局部复发率(2/32,6.25%)与后期病例(1/38,2.6%)差异无统计学意义,但结论尚待后期积累病例数后进一步观察。
五、术前放化疗后手术间隔时间及无细胞黏液池对预后的影响
Tulchinsky等[17]比较术前放化疗-手术间隔时间≥7周与<7周的OS率及远处转移率,分别为93%比81%;6%比19%,均有显著性差异。但两组局部复发率无显著差异。Wolthuis等[18]报告延长术前放化疗-手术时间间隔可显著提高5年带瘤生存率(91%比83%)及无瘤生存率(83%比71%)。Pach等[19]随机研究(n=154),比较短期放疗7 d后手术与4~6周后手术结果提示延长手术间隔时间可获得更好的肿瘤降期效果,但两组生存时间无显著差异。Lim等[20]随机研究(n=397)也得到相同结论,术前放化疗-手术间隔时间4~6周与6~8周比较,两组局部复发率及OS率差异无统计学意义。
此外,有关消化道恶性肿瘤接受新辅助放化疗再手术标本中出现无细胞黏液池现象(pCR)现已得到公认,但有关其临床意义目前仍存在争论。Chirieac等[10]发现食管-胃结合部肿瘤放化疗后手术标本出现无细胞黏液池者提示预后较好。上述研究对象仅为食管癌或食管-胃结合部腺癌病例,而在直肠癌研究中结果却存有争议。
Smith等[21]报告,新辅助治疗后再手术直肠癌完全病理缓解病例中,存在无细胞的黏液池组与不存在组7年OS及7年DFS无显著差异。而在另一项研究中de Campos-Lobato等[11]发现,存在无细胞的黏液池组与不存在组DFS率及OS率前者均明显降低,分别为79%比95%、83%比95%,但上述结果差异无统计学意义。以上研究结果说明直肠癌新辅助放化疗术后pCR标本中出现无细胞的黏液池现象对肿瘤局部复发无影响,但可能预示肿瘤更具侵袭性的生物学行为。最近一项研究(2013年)Lim等[12]对217例接受新辅助放化疗再手术的pCR直肠癌病例研究发现:35例(16.1%)存在无细胞黏液池现象,且主要存在于男性患者(男性比女性:20.8%比9.8%,P=0.039),其肿瘤组织学分化黏液蛋白与印戒细胞之比为66.7%比15.1%,P=0.008;平均随访41个月,与未出现无细胞黏液池组比较3年OS率及3年DFS率分别为96.8%比95.9%,P=0.314、97.0%比93%,P=0.131,差异均无统计学意义。此研究结果提示无细胞黏液池现象与患者性别、肿瘤组织学分化类型有关(如黏液腺癌、印戒细胞癌),而与临床结局无关。此外,无细胞黏液池现象可能与术前放化疗后手术间隔时间有关,只是肿瘤对放化疗的一种时间依从性反应而已,并无显著临床意义。
本组病例5年DFS及OS比较,B组较A组均明显改善,差异虽有统计学意义(P<0.05),但仍因病例数偏少,结论有待后期进一步证实。经亚组分析,B组5例pCR病例中3例存在无细胞黏液池者较另外2例不存在者,5年DFS及OS差异均无统计学意义(P<0.05),但限于病例数较少,本研究对于无细胞黏液池对预后的预测价值尚不能得出肯定的结论,有待大宗病例的临床研究确定。
经过数十年的研究,中低位局部进展期直肠癌行术前放化疗再手术的治疗模式现已成为共识。传统的术前放化疗-手术间隔6周治疗标准已持续多年,新近的研究又发现进一步延长手术间隔时间至≥8甚至12周可获得更满意的肿瘤降期及pCR率,而不增加手术难度及并发症率。但这些都是回顾性研究结论,因此何为最佳术前放化疗-手术间隔时间仍有待后期大规模RCT研究确定。瑞典(斯德哥尔摩)一项多中心Ⅲ期试验(n=840,RCT)旨在比较不同术前放化疗-手术间隔时间(1周;4~8周;8~12周)的影响,预计将在2018年完成。另一项始于2009年,英国一项RCT研究(n=218)比较间隔6周和12周的不同影响,目前还在病例收集之中。这些RCT研究结论将对确定何为最佳术前放化疗-手术间隔时间非常重要。此外,有关放化疗后pCR(即ypT0N0)病例标本中出现无细胞黏液池的意义目前仍存争议,有待大样本、多中心RCT研究确定。
1 Heald RJ,Husband EM,Ryall RD.The mesorectum in rectal cancer surgery- the clue to pelvic recurrence? Br J Surg,1982,69:613-616.
2 Foster JD,Jones EL,Falk S,et al.Timing of surgery after long-course neoadjuvant chemoradiotherapy for rectal cancer: a systematic review of the literature. Dis Colon Rectum,2013,56:921-930.
3 Sua rez J,Vera R,Bale n E,et al.Pathologic response assessed by Mandard grade is a better prognostic factor than down staging for disease-free survival after preoperative radiochemotherapy for advanced rectal cancer.Colorectal Dis,2007,10:563-568.
4 Swedish Rectal Cancer Trial.Improved survival with preoperative radiotherapy in resectable rectal cancer.N Engl J Med,1997, 336:980-987.
5 Francois Y,Nemoz CJ,Baulieux J,et al.Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol,1999,17:2396.
6 Wang Y,Cummings B,Catton P,et al.Primary radical external beam radiotherapy of rectal adenocarcinoma: long term outcome of 271 patients. Radiother Oncol,2005,77:126-132.
7 Wong RK,Tandan V,De Silva S,et al.Pre-operative radiotherapy and curative surgery for the management of localized rectal carcinoma.Cochrane Database Syst Rev,2007,(2): CD002102.
8 Sloothaak DA,Geijsen DE,van Leersum NJ,et al.Optimal time interval between neoadjuvant chemoradiotherapy and surgery for rectal cancer. Br J Surg, 2013,100:933-939.
9 Maas M,Beets-Tan RG,Lambregts DM,et al.Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer.J Clin Oncol,2011,29:4633-4640.
10Chirieac LR,Swisher SG,Correa AM,et al.Signet-ring cell or mucinous histology after preoperative chemoradiation and survival in patients with esophageal or esophagogastric junction adenocarcinoma.Clin Cancer Res,2005,11:2229-2236.
11de Campos-Lobato LF,Dietz DW,Stocchi L,et al.Clinical implications of acellular mucin pools in resected rectal cancer with pathological complete response to neoadjuvant chemoradiation. Colorectal Dis,2012,14:62-67.
12Lim SB,Hong SM,Yu CS,et al.Prevalence and clinical significance of acellular mucin in locally advanced rectal cancer patients showing pathologic complete response to preoperative chemoradiotherapy.Am J Surg Pathol,2013,37:47-52.
13Sauer R,Becker H,Hohenberger W,et a1.Preoperative velmus postoperative ehemoradiotherapy for rectal cancer.N EngI J Med,2004,351:1731-1740.
14Ceelen W,Fierens K,Van Nieuwenhove Y,et al.Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer:a systematic review and meta-analysis.Int J Cancer,2009,124: 2966-2972.
15de Campos-Lobato LF,Geisler DP,da Luz Moreira A,et al.Neoadjuvant therapy for rectal cancer: the impact of longer interval between chemoradiation and surgery.J Gastrointest Surg,2011,15:444-450.
16Yeo SG,Kim DY,Kim TH,et al.Local excision following pre-operative chemoradiotherapy-induced downstaging for selected cT3 distal rectal cancer.Jpn J Clin Oncol,2010,40:754.
17Tulchinsky H,Shmueli E,Figer A,et al.An interval & gt; 7 weeks between neoadjuvant therapy and surgery improves pathologic complete response and diseasefree survival in patients with locally advanced rectal cancer.Ann Surg Oncol,2008,15:2661-2667.
18Wolthuis AM,Penninckx F,Haustermans K,et al.Impact of interval between neoadjuvant chemoradiotherapy and TME for locally advanced rectal cancer on pathologic response and oncologic outcome.Ann Surg Oncol,2012,19:2833-2841.
19Pach R,Kulig J,Richter P,et al.Randomized clinical trial on preoperative radiotherapy 25Gy in rectal cancer--treatment results at 5-year follow-up.Langenbecks Arch Surg, 2012,397: 801-807.
20Lim SB,Choi HS,Jeong SY,et al.Optimal surgery time after preoperativechemoradiotherapy for locally advanced rectal cancers.Ann Surg,2008,248: 243-251.
21Smith KD,Tan D,Das P, et al.Clinical significance of acellular mucin in rectal adenocarcinoma patients with a pathologic complete response to preoperative chemoradiation.Ann Surg,2010,251:261-264.

