枯草芽孢杆菌固态发酵菜籽粕生产多肽及降解硫苷的研究
何荣海,蒋 边,朱培培,丁文慧,马海乐
(江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江212013)
枯草芽孢杆菌固态发酵菜籽粕生产多肽及降解硫苷的研究
何荣海,蒋 边,朱培培,丁文慧,马海乐
(江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江212013)
实验以枯草芽孢杆菌(Bacillus subtilis)为发酵菌株、菜籽粕为原料,菜籽多肽得率和硫代葡萄糖苷(硫苷)降解率为发酵菜籽粕品质的主要评价指标,通过单因素实验及Box-Behnken响应面分析法对固态发酵制备菜籽多肽的工艺进行研究,得到最佳发酵工艺条件为:发酵时间为70h,液料比为1.3∶1mL/g,接种量为15%,发酵温度为31℃,此时多肽得率、硫苷降解率可达15.94%、62.14%,两者的综合评分达到最高值,与响应面理论值吻合性良好。
枯草芽孢杆菌,固态发酵,多肽,响应面分析
油菜籽是中国最主要的油料资源之一,近年来其产量在世界上名列前茅[1]。油菜籽榨油之后得到的副产物为菜籽粕,后者富含蛋白质、矿质元素和维生素,氨基酸组成较平衡,是一种营养价值很高的植物蛋白资源[2]。但菜籽粕含有硫苷、芥酸、单宁和植酸等抗营养因子,严重限制了它的应用范围[3-5]。
菜籽肽是以菜籽粕或菜籽蛋白为原料通过降解而得到的一种低分子肽混合物,不但具有一定的营养功能,还具有多种生物活性,如抗氧化,降血压等。目前,以菜籽粕或菜籽蛋白为原料制备菜籽肽的方法主要有酶水解法、微生物发酵法和化学水解法。微生物发酵法可以利用微生物产生的丰富的酶系,将菜籽粕中的大分子蛋白水解成菜籽肽的同时降解菜籽粕中的有毒物质和抗营养因子[6-10],因而备受关注。
固态发酵与其他培养方式相比具有培养基简单且来源广、技术较简单、投资少、能源消耗低、后期处理较简单、发酵过程粗放等优点[11-13]。本实验采用微生物固态发酵法同时生产菜籽肽并降解硫苷,采用响应面分析的方法及多指标实验设计综合加权评分法优化菜籽粕固态发酵工艺,兼顾抗营养因子的脱除和多肽的得率,以获得最优的发酵工艺条件,降低生产成本,缩短发酵周期,提高菜籽粕品质及综合利用率,为菜籽粕的有效开发利用提供参考。
1 材料与方法
1.1 材料与仪器
菜籽粕 w(粗蛋白)≥40.80%,w(水分)≤9.0%,硫苷≥46.51μmol/g,40目过筛,由丹阳市正大油脂有限公司提供;枯草芽孢杆菌(Bacillus subtilis)W1-3 本实验室从镇江恒顺醋醅分离得到,北京诺赛基因公司鉴定;Gly-Gly-Tyr-Arg 购于SIGMA公司;其他试剂 分析纯;基础种子培养基 含蛋白胨1.0%、氯化钠0.5%、牛肉浸膏0.3%、琼脂2%,pH7.0;种子培养基 含蛋白胨1.0%、氯化钠0.5%、牛肉浸膏0.3%,pH为7.0;固态发酵培养基 菜籽粕30g,水依据发酵实验不同的设计要求加入。
BS124S型电子天平 赛多利斯科学仪器有限公司;YX280A型灭菌锅 上海三申医疗器械有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;PHS-25型数显pH计 上海精密科学仪器有限公司;UV-1601型紫外可见分光光度计 北京诺利分析仪器公司;LRH-250型生化培养箱 上海一恒科学仪器有限公司;TGL-16型高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;QYC-200型全温空气摇床 上海福玛实验设备有限公司。
1.2 实验方法
1.2.1 基础种子与种子液制备 将实验室保存的菌种接种基础培养基上,在30℃的生化培养箱中静止培养24h,让菌种活化。挑取活化后的2环菌体接入100mL灭过菌的装有种子培养基的锥形瓶中,8层纱布封口,放在空气摇床中进行扩大培养,温度为30℃,转速180r/min,培养24h。从上述培养好的菌液中按5%的接种量接种到50mL发酵种子培养基中,培养12h,制成发酵种子液。
1.2.2 固态发酵培养 吸取一定体积上述种子液,接种于装有灭好菌的固态发酵培养基的250mL锥形瓶中,用无菌玻璃棒搅拌混匀,锥形瓶用8层纱布封口,一定温度下恒温发酵一定时间后,将样品放入干燥箱中,50℃烘干后,粉碎过40目筛。
1.2.3 菜籽多肽得率的测定 参照文献[14]。取5g粉碎后的固态发酵基质加入蒸馏水,定容到100mL,搅拌30min,5000r/min离心30min。取上述上清液2mL,加入10%的三氯乙酸水溶液2mL,混匀后静置10min,再12000r/min离心15min。取2mL上述溶液于玻璃试管中,加入8mL双缩脲试剂,混匀后静置10min,4000r/min离心10min,于540nm下测定上清液OD值,对照标准曲线求得样品多肽浓度,多肽得率按照以下公式计算:
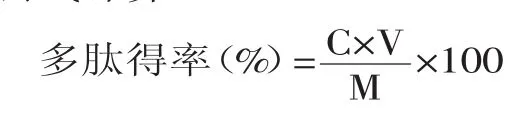
式中:C为发酵液中多肽浓度,mg/mL;V为发酵液总体积,mL;M为菜籽粕质量,mg。
1.2.4 硫苷含量的测定 参照文献[15]。硫苷降解率按照以下公式计算:
硫苷降解率(%)=(原菜籽粕中硫苷含量-发酵菜籽粕中硫苷含量)/原菜籽粕中硫苷含量×100
1.3 实验设计
1.3.1 单因素实验设计 其他因素条件固定,依次分别以发酵时间(36、48、60、72、84、96h),液料比(0.6∶1、0.8∶1、1.0∶1、1.2∶1、1.4∶1、1.6∶1mL/g)、接种量(5%、10%、15%、20%、25%)和发酵温度(25、30、35、40℃)为单因素,考察各因素对多肽得率和硫苷降解率的影响,确定其最佳因素水平。选取前一个单因素的最优水平进行后一个单因素实验的研究,研究第一个单因素(发酵时间)时其他因素水平固定为:发酵温度30℃、接种量10%、液料比1∶1。
1.3.2 响应面实验设计 根据单因素实验,选取对发酵影响较大的发酵时间(A)、液料比(B)和发酵温度(C)三个单因素为研究因素,以多肽得率(Y1)、硫苷降解率(Y2)和两者的综合评分(OD)为评价指标,进行响应面优化实验的中心组合设计。因素及其水平如表1所示,-1、0、1分别代表各因素的低、中、高3个水平。

表1 Box-Behnken中心组合设计的因素和水平表Table 1 Factors and levels of Box-Behnken central composite design
1.4 数据处理与分析
1.4.1 数据进行方差分析的软件为SPSS 16.0;响应面设计与分析的软件为Design-Expert 8.0;实验数据均为3次平行实验的平均值。
1.4.2 综合评分(overall desirability,OD) 在实际生产过程中,既需最大限度地对菜籽粕中的抗营养物质进行降解,又要保证较高的多肽的得率,所以选取多肽得率和硫苷降解率一同作为评价指标进行综合评分,并且将两者权重系数均设为0.5,则:OD=(D1× 0.5+D2×0.5)。在计算综合指标之前,采用极差化法将各指标进行规格化[16]。由于多肽得率和硫苷降解率均要求达到最大化,其规格化方程为:Di=(Yi-Ymin)/(Ymax-Ymin),其中,Ymax和Ymin分别为各指标的最大值与最小值,若某实验的指标值为Ymax时,将Di设为1。反之,某个指标值为Ymin时,Di为0[17]。

图1 发酵时间对多肽得率和硫苷降解率的影响Fig.1 Effect of fermentation time on peptide recovery ratio and glucosinolate degradation rate
2 结果与分析
2.1 单因素发酵实验
2.1.1 发酵时间对多肽得率和硫苷降解率的影响由图1可以看出,发酵时间对多肽得率和硫苷降解率影响显著。发酵时间为60h时,多肽得率达到最高值。这主要原因是:发酵前期,枯草芽孢杆菌产生的蛋白酶将菜籽蛋白水解成菜籽肽,导致多肽含量增加;随着发酵时间的增加,蛋白酶进一步水解部分菜籽蛋白和菜籽肽生成游离的氨基酸,因而多肽含量有所减少[7]。菜籽粕中硫苷降解率随发酵时间延长而提高,在发酵72h后趋于平缓。综上分析,最适合的发酵时间为60~72h。
2.1.2 液料比对多肽得率和硫苷降解率的影响 由图2可以看出,随着液料比的增加,多肽得率和硫苷降解率都是先提高后降低,两者分别在1.2∶1和1.4∶1处达到最大值。水分过低会影响菜籽粕中营养物质的溶解性,影响菌体的生长和代谢;而水分过高,物料粘连,会降低菜籽粕的通透性,影响气体的传递及物料热量的散发,导致菌体氧气的利用下降,不利于发酵。因而水分过低或者过高都会导致多肽得率和硫苷降解率降低。综上分析,最适合的液料比为1.2∶1~1.4∶1。
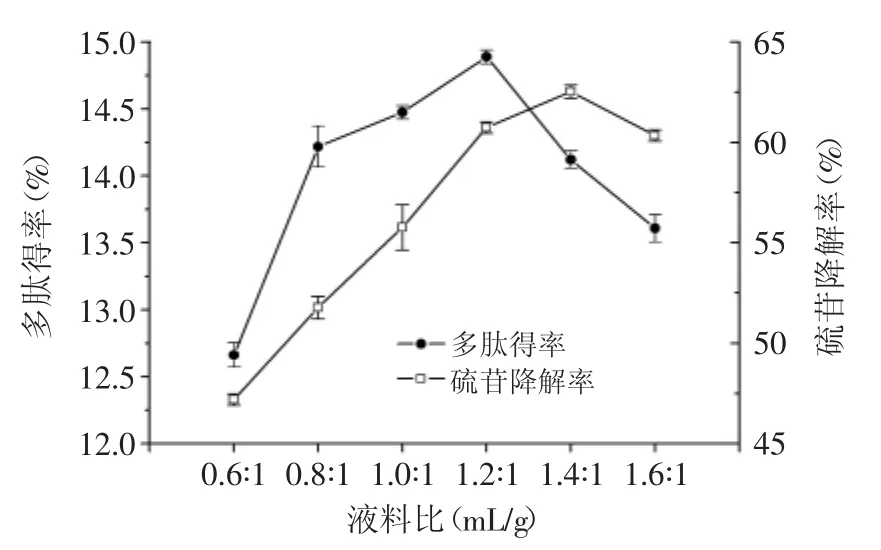
图2 液料比对多肽得率和硫苷降解率的影响Fig.2 Effect of liquid/material ratio on peptide recovery ratioand glucosinolate degradation rate
2.1.3 接种量对多肽得率和硫苷降解率的影响 由图3可以看出,随着接种量的增加,多肽得率和硫苷降解率都是先提高后降低,两者在接种量为15%时均达到最大值。但是接种量对两者的影响并不是很显著,考虑到生产成本,固定接种量为15%。
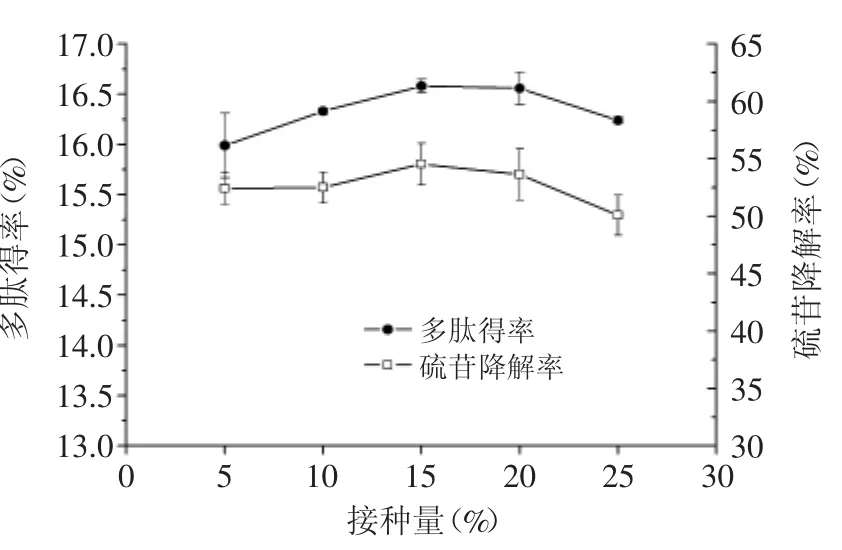
图3 接种量对多肽得率和硫苷降解率的影响Fig.3 Effect of liquid/material ratio on peptide recovery ratio and glucosinolate degradation rate
2.1.4 发酵温度对多肽得率和硫苷降解率的影响发酵温度较低时,微生物的代谢活动较弱,产酶量相对较少;而发酵温度过高对微生物的生长及代谢活动有负面影响,也不利于其产酶。在适宜的温度下,微生物生长代谢活跃,产酶量高,有利于多肽的产生和硫苷的降解。由图4可以看出,随着发酵温度的提高,多肽得率和硫苷降解率都是先提高后降低,两者分别在30℃和35℃处达到最大值。综上分析,最适合的发酵温度为30~35℃。
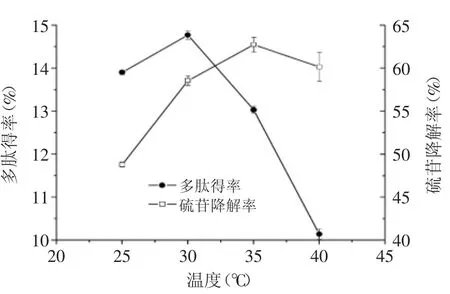
图4 发酵温度对多肽得率和硫苷降解率的影响Fig.4 Effect of fermentation temperature on peptide recovery ratio and glucosinolate degradation rate
2.2 响应面分析法优化发酵条件结果分析
2.2.1 响应面优化方差分析 根据Box-Behnken中心组合设计了17组实验(含5组中心点重复)。实验设计及结果见表2。
采用Design-Expert.8.0软件对表2的数据进行二次多项式回归拟合,得到多肽得率、硫苷降解率和综合评分的二次回归方程分别为:
Y1=-96.866+0.581A+20.556B+5.142C+0.001AB-0.010AC-0.151BC-0.002A2-6.008B2-0.069C2(R2= 0.9818,R2Adj=0.9584);
Y2=-376.86235+1.45039A+159.27832B+17.60280C-0.40526AB-0.011094AC-1.09350BC-0.00335A2-37.29495B2-0.24092C2(R2=0.9817,R2Adj=0.9582);
YOD=-15.605+0.071A+4.522B+0.714C-7.434AB-0.001AC-0.032BC-0.0002A2-1.150B2-0.010C2(R2= 0.9928,R2Adj=0.9836)。
多肽得率、硫苷降解率和综合评分回归方程的回归分析与方差分析结果分别如表3~表5所示。由表3可知,多肽得率模型的F值为42.01大于F0.01(9,4),说明该模型回归显著可靠。其R2=0.9818,R2Adj=0.9584,说明建立的模型和实验拟合良好,因而能用于固态发酵产多肽的分析和预测。依F检验知,各因素对多肽得率的影响由大到小依次为:发酵温度(C)、液料比(B)、发酵时间(A),因素A、B、C、AC、A2、B2和C2的p值均小于0.01,说明其对多肽得率影响极显著,且各实验因素对多肽得率的影响不是简单的线性关系,发酵时间与温度两者有交互作用,如图5所示。
由表4可知,硫苷降解率模型的F值为41.73大于F0.01(9,4),说明该模型回归显著可靠。其R2=0.9817,R2Adj=0.9582,说明建立的模型和实验拟合良好,因而能用于固态发酵降解硫苷的分析和预测。依F检验知,因素A、B和C的p值均小于0.01,说明其对硫苷降解率影响极显著;AB、BC、B2、C2的p值均小于0.05,说明B2、C2对硫苷降解率影响显著,且各实验因素对硫苷降解率的影响不是简单的线性关系,发酵时间和液料比、液料比和发酵温度均有交互作用,如图6所示。

表2 Box-Behnken中心组合的实验设计与结果Table 2 Experimental design and results of Box-Behnken central composite

表3 多肽得率方差分析结果Table 3 Variance analysis results of peptide recovery ratio
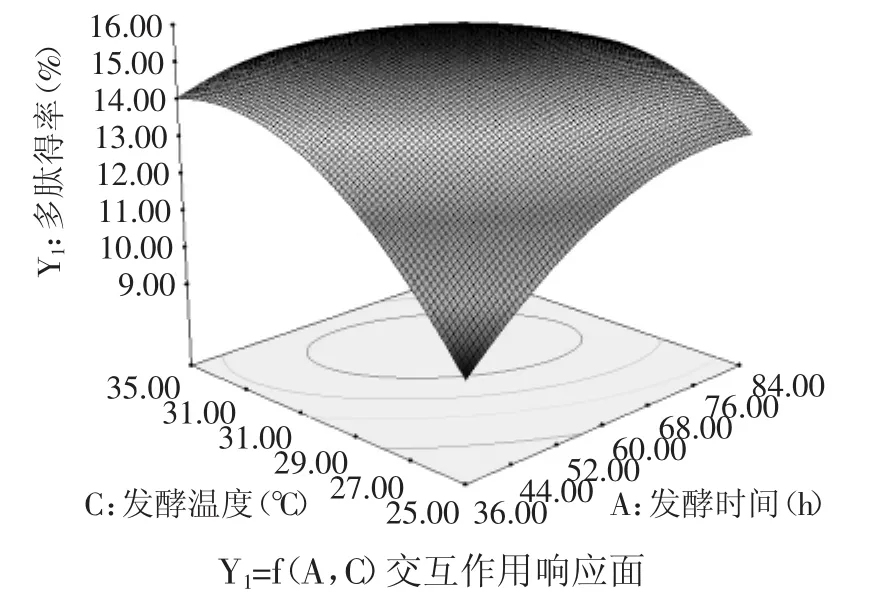
图5 影响多肽得率的因素之间的交互作用Fig.5 The interaction between factors that affect peptide recovery ratio
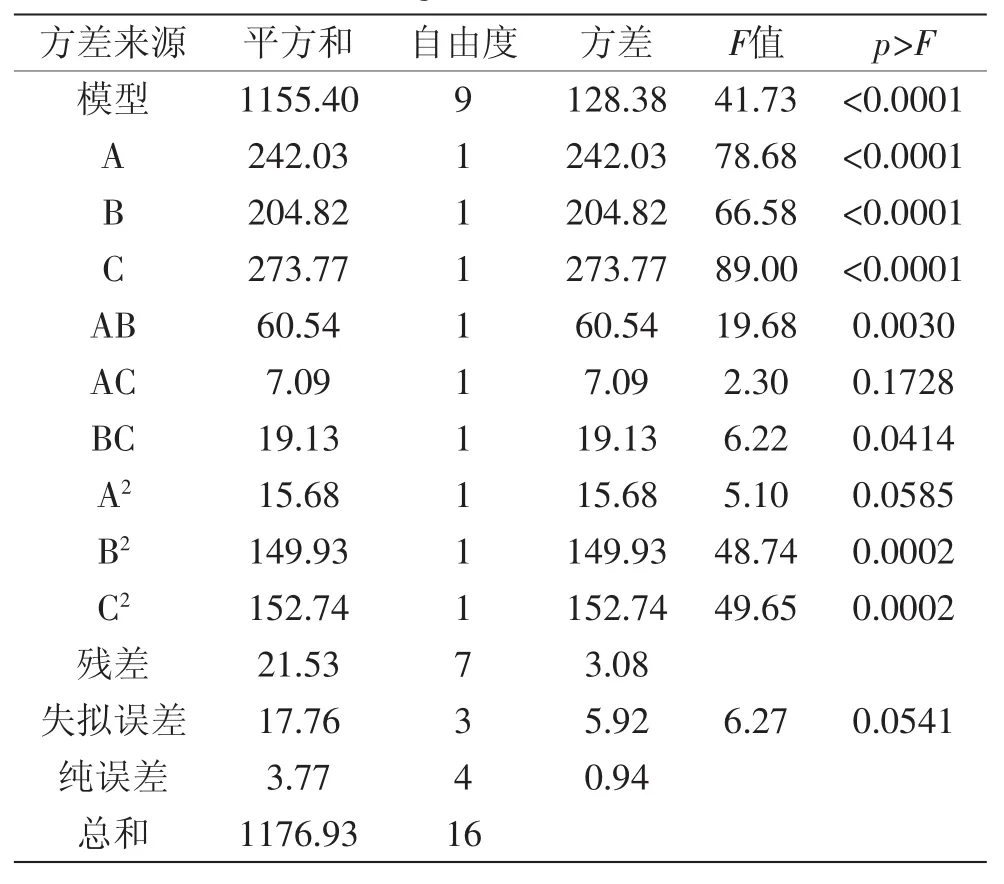
表4 硫苷降解率方差分析结果Table 4 Variance analysis results of glucosinolate degradation rate
由表5可知,综合评价指标模型的F值为107.41大于F0.01(9,4),说明该模型回归显著可靠。其模型R2=0.9928,R2Adj=0.9836,说明建立的模型和实验拟合良好,能用于该反应的理论预测。依F检验知,所有因素的p值均小于0.01,说明其对发酵综合评价指标影响极显著,且各实验因素对综合评分的影响不是简单的线性关系,发酵时间、液料比和发酵温度两两之间均有交互作用,如图7所示。

表5 综合评分方差分析结果Table 5 Variance analysis results of overall desirability
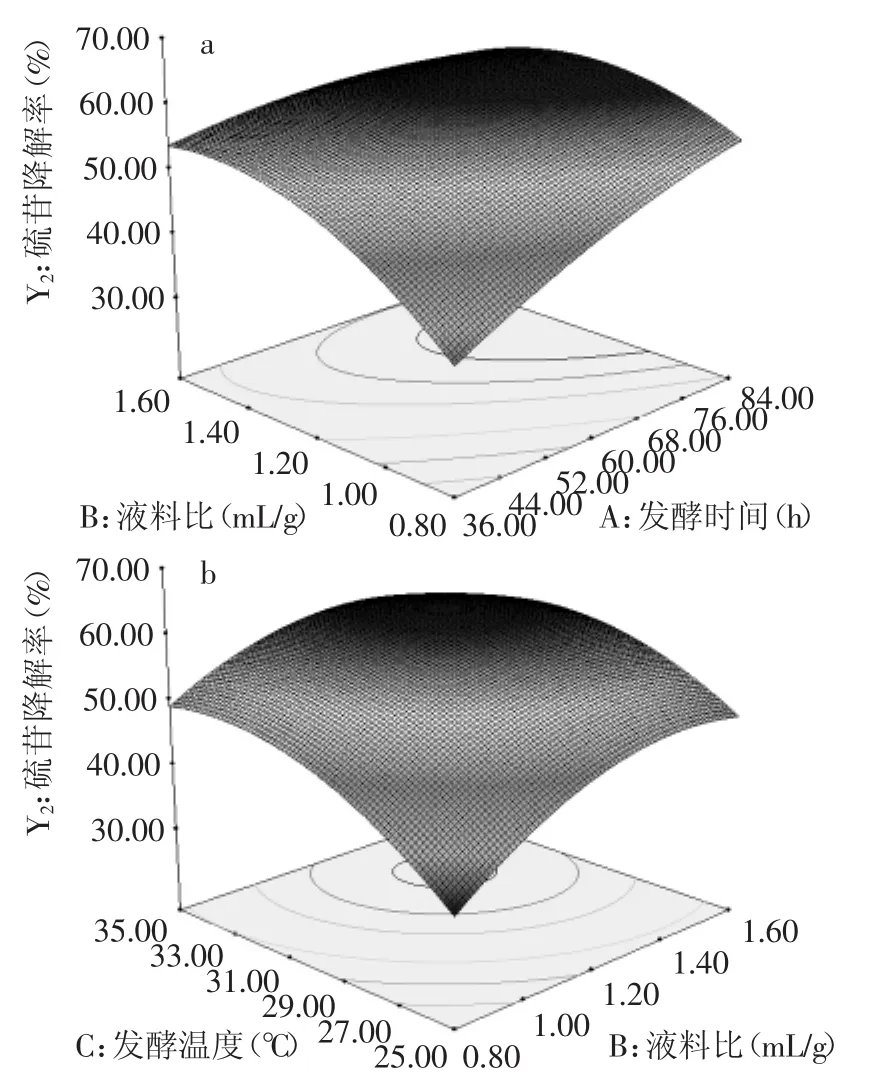
图6 影响硫苷降解率的因素之间的交互作用Fig.6 The interaction between factors that affect glucosinolate degradation rate
2.2.2 响应面最优条件优化、预测和验证 由表6可知,若以多肽得率和硫苷降解率两者作为评价指标,所得的最优发酵条件是不一致的,因而选用两者的综合评价指标进行综合考虑。最终得出最优的发酵条件为发酵时间为69.75h,液料比为1.31∶1mL/g,发酵温度为31.36℃,此时所对应的多肽得率、硫苷降解率理论值分别为15.95%、61.53%。为方便各实验条件的控制,最优的发酵条件修正为:发酵时间为70h,液料比1.3∶1mL/g,发酵温度为31℃。
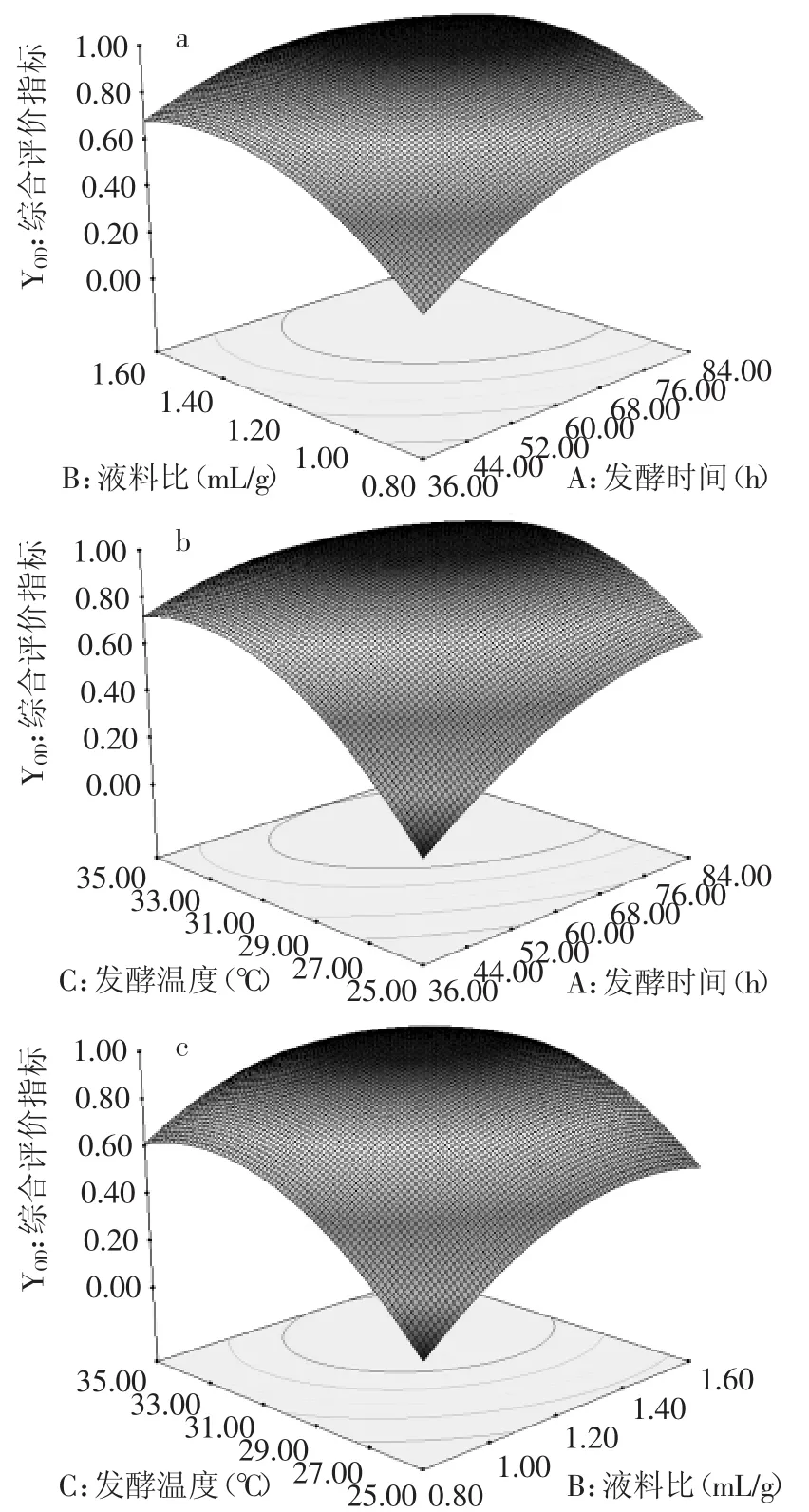
图7 影响综合评分的因素之间的交互作用Fig.7 The interaction between factors that affect overall desirability
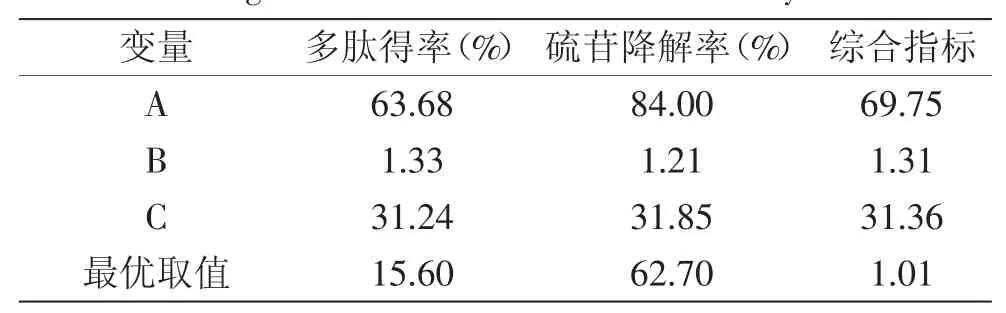
表6 多肽得率、硫苷降解率和综合评分的最佳水平表Table 6 Optimal level of peptide recovery ratio,glucosinolate degradation rate and overall desirability
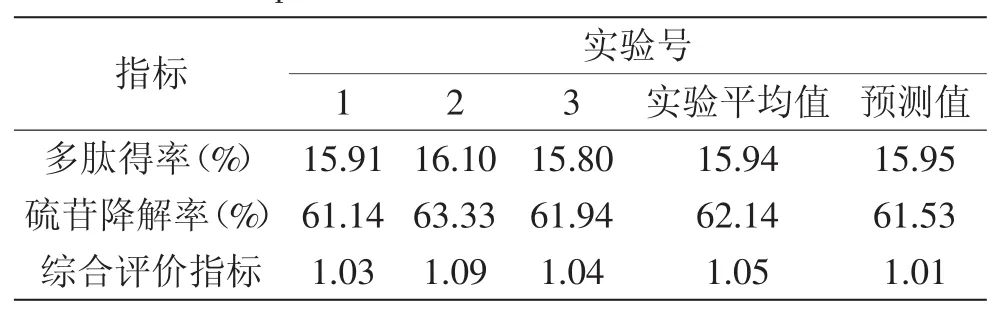
表7 最优发酵条件验证实验结果Table 7 Validate experiment result of optimum fermentation conditions
为了验证优化结果的可靠性,在修正后的最优发酵条件下进行3次平行实验,结果由表7所示。理论预测值与验证实验的平均值相接近,说明该模型可以较好地预测菜籽多肽得率和硫苷的降解率。
3 结论
通过单因素实验和响应面分析,采用多指标综合评分法研究多肽得率和硫苷降解率对发酵后菜籽粕品质的影响,得到最优的发酵工艺为:发酵时间为70h,液料比为1.3∶1,发酵温度为31℃,此时多肽得率、硫苷降解率理论值分别为15.95%、61.53%,两者的综合评分达到最高值。验证实验结果分别为15.94%、62.14%,与理论值吻合性良好。
[1]Liu Dachuan,Shen Nana.A recent review on rapeseed processing and comprehensive utilization in China[Z].14th ICC Cereal and Bread Congress and Forum on Fats and Oils,Beijing International Expo Center,2012.
[2]席鹏彬,马永喜,李德发,等.中国菜籽饼粕化学组成特点及其影响因素的研究[J].中国畜牧杂志,2004,4(10):12-15.
[3]RJ Mailer,A McFadden.Anti-nutritional components,fibre,sinapine and glucosinolate content,in australian canola(Brassica napus L.)meal[J].Journal of the American Oil Chemists’Society,2008,85:937-944.
[4]李建凡,高振川.中国菜籽饼的营养成分和抗营养因子[J].畜牧兽医学报,1995,26(3):193-199.
[5]陈刚,彭健,刘振利.中国菜籽饼粕品质特征及其影响因素研究[J].中国粮油学报,2006,21(1):95-98.
[6]顾斌,马海乐,刘斌,等.菜籽粕混菌固态发酵制备多肽饲料的研究[J].中国粮油学报,2011,26(1):83-87.
[7]顾斌,马海乐,刘斌,等.混菌发酵菜籽粕制备多肽技术的研究[J].食品工业科技,2011,32(5):190-192,196.
[8]何荣海,刘磊,蒋边,等.枯草芽孢杆菌液态发酵菜籽粕制备抗氧化肽[J].中国食品学报,2013,13(12):12-20.
[9]金晶,徐志宏,魏振承,等.菜籽粕中抗营养因子及其去除方法的研究进展[J].中国油脂,2009,34(7):18-21.
[10]A Pandey,P Selvakumar,Carlos R Soccol,et al.Solid state fermentation for the production of industrial enzymes[J].Current Science,1999,77(1):149-162.
[11]孙森,宋俊梅,张长山.固态发酵技术的研究应用现状[J].中国食品添加剂,2010(4):54-58.
[12]JP Smits,A Rinzema,J Tramper,et al.The influence of temperature on kinetics in solid-state fermentation[J].Enzyme and Microbial Technology,1998,22(1):50-57.
[13]何荣,鞠兴荣,袁建,等.固态发酵生产菜籽肽及其清除自由基能力的研究[J].食品科学,2009,30(19):259-262.
[14]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[15]汪正华,魏晶石,沈检.对菜籽饼中硫葡萄糖苷有高效降解作用的菌种筛选研究[J].微生物学杂志,2000,20(1):57-59.
[16]张立军,袁能文.线性综合评价模型中指标标准化方法的比较与选择[J].统计与信息论坛,2010,25(8):10-15.
[17]吴建民,陶菊春.用综合加权评分法优化钻井泥浆配方的研究[J].农业工程学报,2002,18(2):45-48.
Study on solid-state fermentation of rapeseed meal for preparation of peptides and degradation of glucosinolates by Bacillus subtilis
HE Rong-hai,JIANG Bian,ZHU Pei-pei,DING Wen-hui,MA Hai-le
(School of Food and Bioengineering,Jiangsu University,Jiangsu Key Laboratory of Agricultural Product Physical Processing,Zhenjiang 212013,China)
With rapeseed meals as raw material,together with peptide recovery ratio and glucosinolate degradation rate as main quality evaluation indexes in this solid-state fermentation,then based on single factor experiment and the Box-Behnken response surface analysis,the craft that rapeseed peptide was produced with Bacillus subtilis.The results showed that the best fermentation conditions were as follows:fermentation time 70h,ratio of water to material 1.3∶1mL/g,fermentation temperature 31℃.Under these conditions,the rapeseed peptide recovery ratio and glucosinolate degradation rate were 15.94%and 62.14%respectively.Their overall desirability was maximum.The experimental vaule was basically agreed with the theoretical value of response surface analysis.
Bacillus subtilis;solid-state fermentation;polypeptides;response surface analysis
TS201.1
A
1002-0306(2014)10-0228-06
10.13386/j.issn1002-0306.2014.10.043
2013-08-27
何荣海(1971-),男,博士、副教授,主要从事农产品深加工技术方面的研究。
国家十二五科技支撑计划(2013BAD10B03);江苏省农业科技支撑计划(BE2011401);江苏省自然科学基金项目(BK2012708);江苏高校优势学科建设工程资助项目。

