高危型HPV亚型及亚型组合检测宫颈癌及高级别宫颈上皮内瘤变的比较研究
万晓春 杨慧娟 周晓燕 向礼兵 杨文涛 蔡旭
陆永明1 陈颖1 平波1
1.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032
高危型HPV亚型及亚型组合检测宫颈癌及高级别宫颈上皮内瘤变的比较研究
万晓春1 杨慧娟2 周晓燕1 向礼兵2 杨文涛1 蔡旭1
陆永明1 陈颖1 平波1
1.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:高危型人乳头状瘤病毒(high risk human papillomavirus,hrHPV)感染对于浸润性宫颈癌(invasive cervical carcinoma,ICC)及其癌前病变的致病性存在亚型及地区差异。本研究通过分析本地区30岁及以上女性宫颈病变患者中HPV亚型分布特点,进一步识别罹患包含ICC的高级别宫颈上皮内瘤变(cervical intraepithelial neoplasia grade 2 or worse,CIN2+)风险更高的亚型,并比较这些高风险亚型及亚型组合检测CIN2+病变的有效性。方法:收集来自复旦大学附属肿瘤医院就诊患者具备组织学随访结果的宫颈标本,行PCR-反向点杂交法(PCR-reverse dot blot,PCR-RDB)HPV基因分型检测,利用Logistic回归模型分析hrHPV亚型与CIN2+病变的风险关系,并构建ROC曲线(receiver operating characteristic curve,ROC curve)评价不同亚型及亚型组合检测CIN2+病变的准确性。结果:符合研究要求患者413例,含38例CIN1,184例CIN2/3,126例ICC和65例阴性对照人群。HPV16、58、33和18依次为致CIN2+最常见的4种HPV亚型,仅HPV16(P<0.000 1)、58(P=0.002)及33(P=0.015)为罹患CIN2+病变的高风险亚型。联合检测HPV16/18/33/58诊断CIN2+病变的ROC曲线下面积(the area under the ROC curve,AUC)显著高于HPV16/18亚型组合(P=0.006 6)。结论:HPV16/18/33/58亚型组合用于辅助本地区CIN2+病变的检测可能更为有效。
浸润性宫颈癌;宫颈上皮内瘤变;人乳头状瘤病毒;基因分型
大量流行病学研究表明高危型人乳头状瘤病毒(high risk human papillomavirus,hrHPV)感染与宫颈癌及其癌前病变发生关系密切,99.7%的宫颈癌可检出hrHPV DNA[1]。对于诊断高级别宫颈上皮内瘤变(cervical intraepithelial neoplasia grade 2 or worse,CIN2+)病变,即浸润性宫颈癌和CIN2及以上的患者,hrHPV DNA检测灵敏度远高于宫颈细胞学检查[2-3],阴性预测值可达100%[3]。然而80%以上的hrHPV感染不会引起CIN2+[4],联合检测13或14种hrHPV DNA诊断CIN2+病变特异性过低[5],可能导致过度诊治和医疗损伤[6]。选择性检测其中致病性更高的亚型有望筛选出罹患CIN2+风险更高的患者[7-9]。例如美国食品和药物管理局(Food and Drug Administration,FDA)认可的商品化HPV16/18和HPV16/18/45亚型组合检测,已用于辅助30岁及以上女性的宫颈细胞学检查,对hrHPV阳性者进行分流。鉴于HPV亚型分布存在地区差异,本研究通过检测本地区30岁及以上女性宫颈病变HPV亚型分布,识别更易引起CIN2+病变的hrHPV亚型,并初步评价这些高风险亚型或亚型组合的检测用于临床诊断CIN2+病变的有效性。
1 资料和方法
1.1 患者收集
经过复旦大学附属肿瘤医院医学伦理委员会审核,收集复旦大学附属肿瘤医院病理科2010年6月—2011年1月的HPV亚型患者的检测档案。患者入组标准:年龄≥30岁;阴性(正常或炎性反应)患者既往无组织学证实的宫颈癌及癌前病变病史,且无宫颈细胞学异常病史;所有患者均无其他恶性肿瘤病史;所有标本需有病理诊断结果;所有脱落细胞标本需有组织学随访对照结果;正常或CIN患者经6个月随访,未出现更高级别病变;获得患者或家属签署的知情同意书。
1.2 HPV DNA检测
从组织学切片及宫颈脱落细胞中提取DNA,选取DNA内参阳性者,使用国家食品药品监督管理局(State Food and Drug Administration,SFDA认证的PCR-反向点杂交法(PCR-reverse dot blot,PCR-RDB)HPV基因分型检测试剂盒(购自深圳亚能生物技术有限公司)。膜条上探针与PCR产物杂交显色后可形成深蓝色斑点,根据斑点出现的位点可以判断有无HPV感染以及感染的亚型。每个膜条含内对照质控点PC,除PC点以外无任何蓝色斑点着色,即为HPV阴性。PC点以外的点阳性视作HPV阳性(图1)。可检测23种HPV亚型,包括HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、83、MM4、6、11、42、43和44。
1.3 统计学处理
采用SPSS 16.0统计软件对数据进行分析。利用多因素Logistic回归模型计算HPV亚型感染与CIN2+病变的风险关系;通过构建ROC曲线,计算AUC、灵敏度和特异度,评价不同亚型及亚型组合检测诊断CIN2+病变的能力。P<0.05为差异有统计学意义。
2 结 果
2.1 临床病理资料
符合入组条件宫颈标本共460例,其中经宫颈活检、锥切或子宫切除术获得石蜡包埋组织180例,连续切片后仍有目标组织且DNA内参阳性者155例。其余为280例宫颈脱落细胞标本,DNA内参阳性者258例。最终符合研究条件的DNA内参阳性者413例,包括38例CIN1,184例CIN2/3,126例浸润性宫颈癌(invasive cervical
carcinoma,ICC,含114例鳞癌、8例腺癌和4例腺鳞癌)和65例阴性对照。年龄范围30~77岁,中位年龄44岁,平均年龄44.61岁。
2.2 不同类型宫颈病变中HPV亚型分布
使用PCR-RDB检出HPV亚型共计20种(表1),HPV总阳性率为85.23%(352/413),<CIN2(即阴性和CIN1)组和CIN2+组阳性率分别为51.46%(53/103)和96.45%(299/310)。其中14种hrHPV亚型(16、18、31、33、35、39、 45、51、52、56、58、59、66、68)总阳性率为84.50%(349/413)。HPV16在<CIN2、CIN2/3和ICC组中均最常见,分别占71.70%、74.16%和85.12%。虽然HPV18在<CIN2组(20.75%)和ICC组(16.53%)均为第2常见hrHPV亚型,但在CIN2/3组中却仅列第5位(7.30%)。HPV58和33在3组病变中均排名第2~4位,且HPV58比HPV33更常见(图1)。

图1 不同类型宫颈病变中前8种最常见的hrHPV亚型Fig. 1 Eight most common hrHPV types in cervical lesions according to severity
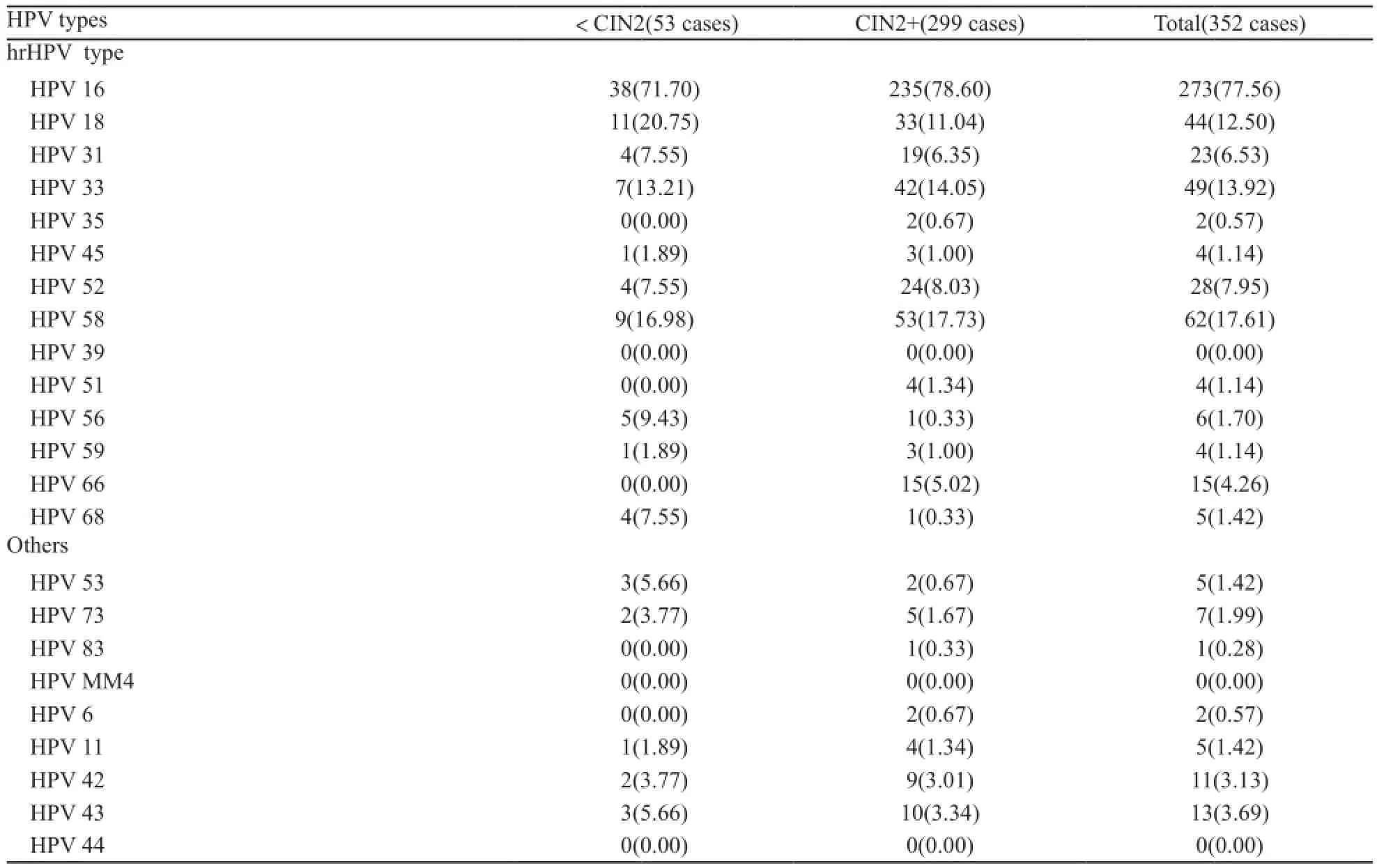
表1 352例HPV阳性标本中HPV亚型分布情况Tab. 1 The distribution of HPV genotypes in 352 HPV-positive cases[n(%)]
在浸润性宫颈癌中,H P V阳性率为96.03%(121/126),hrHPV阳性率为95.24%(120/126),鳞癌、腺癌和腺鳞癌中hrHPV阳性率分别为99.12%(113/114)、62.50%(5/8)和50.00%(2/4)。鳞癌中前4位最常见亚型依次为HPV16(85.09%,97/114)、18(16.67%,19/114)、58(7.89%,9/114)和33(7.02%,8/114)。腺癌中检出的亚型仅为HPV16(80.00%,4/5)和18(20.00%,1/5),而HPV阳性的腺鳞癌均为HPV16感染(100.00%,2/2)。
2.3 不同HPV亚型感染与CIN2+病变的风险关系评价
利用多因素Logistic回归模型分析hrHPV亚型与CIN2+病变的风险关系(表2)。比较各个HPV亚型的阳性与阴性患者(后者包括非此亚型的HPV感染者以及HPV阴性者),对于CIN2+病变,OR值>1的亚型为HPV16、18、31、33、52、58和59,但仅HPV16、58及33相比差异有统计学意义(P<0.000 1、P=0.002、P=0.015)。提示该3种亚型在本研究中为罹患CIN2+病变的高风险亚型。其余包括HPV18和HPV45在内的亚型感染与CIN2+病变发生未见明显相关性。
2.4 不同hrHPV亚型及亚型组合诊断CIN2+病变的准确性评价
本研究提示,HPV16、33、58为罹患CIN2+病变的高风险亚型。此外HPV16和18不仅是鳞癌中最常见亚型,也为宫颈腺癌中仅查及的两种亚型,且腺癌HPV阳性者20%感染HPV18(表3),表明ICC中HPV18为HPV16之外的最为重要的亚型。因此,本研究进一步利用ROC曲线评价3种高风险亚型和HPV18,以及HPV16/18/33/58亚型组合诊断CIN2+的准确性,并与目前已有商品化试剂的HPV16/18和16/18/45亚型组合比较(表4)。其中ROC曲线下面积值最高者为HPV16/18/33/58组合,而且与各单亚型和其他亚型组合之间差异均有统计学意义(P均<0.05),提示检测HPV16/18/33/58亚型组合可能对CIN2+病变的诊断更为准确。
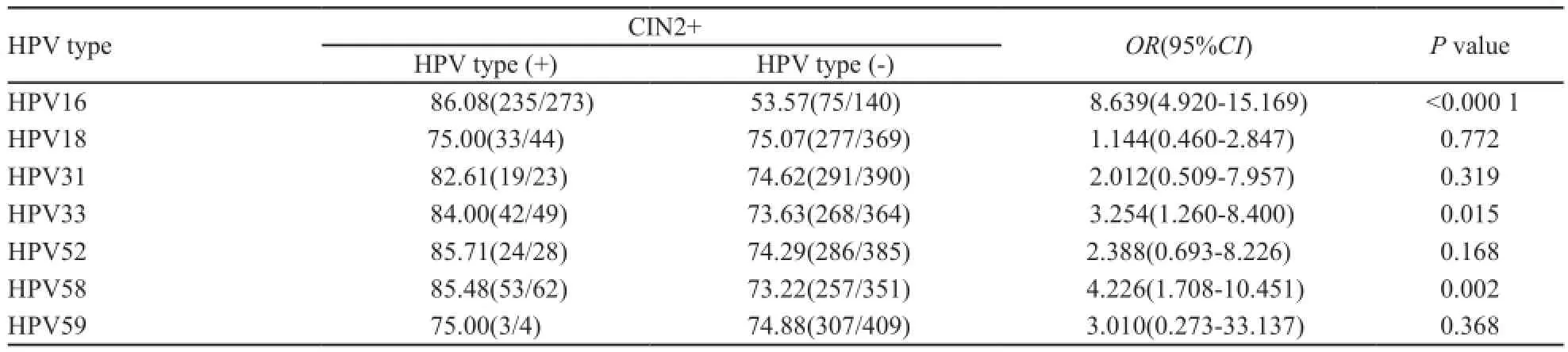
表2 不同HPV亚型感染与CIN2+病变的风险关系Tab. 2 The risk association between various types of HPV infection and CIN2+ lesions[n(%)]

表3 121例HPV阳性的浸润性宫颈癌中的HPV亚型分布情况Tab. 3 The distribution of HPV genotypes in 121 HPV-positive invasive cervical carcinomas[n(%)]

表4 不同HPV亚型及亚型组合诊断CIN2+的准确性比较Tab. 4 The diagnostic performance of HPV genotyping for CIN2+: A comparison of single type and type combinations
3 讨 论
美国阴道镜及宫颈病理学协会(American Society for Coloscopy and Cervical Pathology,ASCCP)发布的宫颈癌及癌前病变普查异常结果处理指南中表明,对30岁及以上细胞学阴性而hrHPV DNA阳性的患者可行HPV16/18亚型组合检测,后者阳性应行阴道镜检查,阴性则可于12个月后通过重复细胞学和hrHPV DNA检测随访[10-12]。该决策主要依据为几项具备长期随访结果的大规模前瞻性研究,研究对象为美国、巴西和丹麦等国女性,结论主要为HPV16和(或)HPV18感染者具有更高的CIN2+的发生风险[10,13-17]。确实,HPV16和18被全球公认为ICC最常见的感染亚型[18-19],本研究亦获同样结果。然而在发现后也需治疗的CIN2/3中,虽然HPV16感染仍最常见,然而亚型分布却在世界范围内存在地区差异。荟萃分析结果显示,HPV18在北美洲患者中为第2常见的hrHPV亚型,而在其他大洲HPV31、33、58或52等却比HPV18更常见[18-19]。本研究患者均来自上海,HPV18在CIN2/3病变中比HPV16、58、33和52更少见。其他国内研究也显示,CIN2/3病变中HPV18可能比HPV16、58、33、31和52等亚型更为少见[20-21]。甚至ASCCP指南也指出其他地区人群研究结果也曾发现HPV31和58的致病风险与HPV18相似[16],包括我国台湾省一项随访期长达16年的大规模前瞻性研究[22]。
因此,除HPV16之外的hrHPV亚型在CIN2+病变发生、发展过程中的重要性目前尚未明确[19,23],地区差异性可能是影响因素之一。虽然在各地开展针对不同HPV亚型的长期、大规模的前瞻性研究是了解HPV16之外hrHPV亚
型致病风险的最可靠手段,但此类研究往往因耗时长、资源消耗大而开展困难,且易受医学伦理限制。对收集于某一时间点,来自特定人群的不同严重程度宫颈病变中HPV亚型分布的横断面研究是对hrHPV亚型致病风险分析的极有益的补充,例如挪威一项横断面研究采用Logistic回归模型,发现HPV16和33感染比其他亚型使女性更具罹患CIN3+的致病风险[19]。本研究为开展于上海市的横断面研究,选择CIN2+为研究终点,对具备组织学随访结果的不同病理级别的413例宫颈标本进行HPV基因型检测,发现310例CIN2+病变中前四位最常见亚型依次为HPV16、58、33和18,而且多因素Logistic回归模型分析表明,HPV16、33和58为发生CIN2+的高风险亚型,其余包括HPV18和45在内的亚型感染与CIN2+病变的发生未见明显相关性。故用于辅助本地区女性宫颈癌筛查的HPV亚型检测方案可据此调整,可考虑将高致病风险的HPV16、58、33列入联合检测方案,此外鉴于本研究和既往文献均提示ICC中HPV18为HPV16之外最重要的亚型[18,24-25],仍需将其列入检测方案。
事实上,HPV16/18亚型组合检测能获美国FDA认证,被ASCCP推荐用于辅助宫颈癌筛查,除需开展致病风险研究外,也需开展以组织学结果为金标准的CIN2+诊断灵敏度和特异性的临床研究[26]。因而本研究进一步利用ROC曲线来比较不同亚型及亚型组合检测用于CIN2+病变诊断的准确性。如同预期,HPV 16/18/33/58组合检测可能对CIN2+病变的诊断更有帮助,所获AUC值最高且与各单亚型、HPV 16/18及16/18/45之间的差异均存在统计学意义(P均<0.05)。
本研究不足之处在于患者来自非普通筛查人群,且出自单家医院,研究规模相对较小,然而复旦大学附属肿瘤医院为三级甲等肿瘤专科医院,患者来自全国各地,仍不失其代表性。此外,每例患者均有可靠组织学随访对照结果,其中CIN2+患者达310例(75.06%),尤其ICC例数高达126例(30.51%),并含8例腺癌和4例腺鳞癌,可弥补普通人群HPV亚型分布研究中CIN2+特别是ICC患者较难收集以致例数极少的缺点。进一步验证关于何种hrHPV亚型组合更适用于我国宫颈癌及其癌前病变筛查,必然有待于拓展研究规模,扩大患者来源,并开展具有长期随访结果的前瞻性研究。
[1]WALBOOMERS J M, JACOBS M V, MANOS M M, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol, 1999, 189(1): 12-19.
[2]WRIGHT T J, MASSAD L S, DUNTON C J, et al. 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests[J]. Am J Obstet Gynecol, 2007, 197(4): 346-355.
[3]PETRY K U, MENTON S, MENTON M, et al. Inclusion of HPV testing in routine cervical cancer screening for women above 29 years in Germany: results for 8466 patients[J]. Br J Cancer, 2003, 88(10): 1570-1577.
[4]MEIJER C J, SNIJDERS P J, VEN DEN BRULE A J. Screening for cervical cancer: should we test for infection with high-risk HPV?[J]. CMAJ, 2000, 163(5): 535-538.
[5]RIJKAART D C, BERKHOF J, VAN KEMENADE F J, et al. Evaluation of 14 triage strategies for HPV DNA-positive women in population-based cervical screening[J]. Int J Cancer, 2012, 130(3): 602-610.
[6]MUÑOZ N, BOSCH F X, CASTELLSAGUÉ X, et al. Against which human papillomavirus types shall we vaccinate and screen? The international perspective[J]. Int J Cancer, 2004, 111(2): 278-285.
[7]SCHIFFMAN M, KHAN M J, SOLOMON D, et al. A study of the impact of adding HPV types to cervical cancer screening and triage tests[J]. J Natl Cancer Inst, 2005, 97(2): 147-150.
[8]GUO M, LIN C Y, GONG Y, et al. Human papillomavirus genotyping for the eight oncogenic types can improve specificity of HPV testing in women with mildly abnormal Pap results[J]. Mod Pathol, 2008, 21(8): 1037-1043.
[9]GUO M, SNEIGE N, SILVA E G, et al. Distribution and viral load of eight oncogenic types of human papillomavirus (HPV) and HPV 16 integration status in cervical intraepithelial neoplasia and carcinoma[J]. Mod Pathol, 2007, 20(2): 256-266.
[10]WRIGHT T J, MASSAD L S, DUNTON C J, et al. 2006 consensus guidelines for the management of women with abnormal cervical screening tests[J]. J Low Genit Tract Dis, 2007, 11(4): 201-222.
[11]HPV Genotyping Clinical Update[EB/OL]. http://www. asccp.org/[Z]. 2009.
[12]MASSAD L S, EINSTEIN M H, HUH W K, et al. 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors[J]. Obstet Gynecol, 2013, 121(4): 829-846.
[13]SCHLECHT N F, KULAGA S, ROBITAILLE J, et al. Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia[J]. JAMA, 2001, 286(24): 3106-3114.
[14]KHAN M J, CASTLE P E, LORINCZ A T, et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice[J]. J Natl Cancer Inst, 2005, 97(14): 1072-1079.
[15]WRIGHT T J, STOLER M H, SHARMA A, et al. Evaluation of HPV-16 and HPV-18 genotyping for the triage of women with high-risk HPV+ cytology-negative results[J]. Am J Clin Pathol, 2011, 136(4): 578-586.
[16]SASLOW D, SOLOMON D, LAWSON H W, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer[J]. Am J Clin Pathol, 2012, 137(4): 516-542.
[17]KJAER S K, FREDERIKSEN K, MUNK C, et al. Longterm absolute risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection: role of persistence[J]. J Natl Cancer Inst, 2010, 102(19): 1478-1488.
[18]CLIFFORD G, FRANCESCHI S, DIAZ M, et al. Chapter 3: HPV type-distribution in women with and without cervical neoplastic diseases[J]. Vaccine, 2006, 24(Suppl 3): 3-26.
[19]SJOEBORG K D, TROPE A, LIE A K, et al. HPV genotype distribution according to severity of cervical neoplasia[J]. Gynecol Oncol, 2010, 118(1): 29-34.
[20]LIU X, ZHANG S, RUAN Q, et al. Prevalence and type distribution of human papillomavirus in women with cervical lesions in Liaoning Province, China[J]. Int J Gynecol Cancer, 2010, 20(1): 147-153.
[21]CHAN P K, CHEUNG T H, LI W H, et al. Attribution of human papillomavirus types to cervical intraepithelial neoplasia and invasive cancers in Southern China[J]. Int J Cancer, 2012, 131(3): 692-705.
[22]CHEN H C, SCHIFFMAN M, LIN C Y, et al. Persistence of type-specific human papillomavirus infection and increased long-term risk of cervical cancer[J]. J Natl Cancer Inst, 2011, 103(18): 1387-1396.
[23]LI C, WU M, WANG J, et al. A population-based study on the risks of cervical lesion and human papillomavirus infection among women in Beijing, People’s Republic of China[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(10): 2655-2664.
[24]SMITH J S, LINDSAY L, HOOTS B, et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: a meta-analysis update[J]. Int J Cancer, 2007, 121(3): 621-632.
[25]LI N, FRANCESCHI S, HOWELL-JONES R, et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication[J]. Int J Cancer, 2011, 128(4): 927-935.
[26]SCHUTZBANK T E, GINOCCHIO C C. Assessment of clinical and analytical performance characteristics of an HPV genotyping test[J]. Diagn Cytopathol, 2012, 40(4): 367-373.
High-risk HPV genotyping for cervical intraepithelial neoplasia grade 2 or worse: A comparison of single types and type combinations
WAN Xiao-chun1, YANG Hui-juan2, ZHOU Xiao-yan1, XIANG Libing2, YANG Wen-tao1, CAI Xu1, LU Yong-ming1, CHEN Ying1, PING Bo1(1. Department of Pathology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Gynecologic Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Background and purpose:Risk of invasive cervical carcinoma (ICC) and its precancerous lesions following high risk human papillomavirus (hrHPV) infection may vary according to HPV types and geographic regions. Analyzing HPV-type distribution in cervical samples from local women aged 30 years and older, this study aimed to identify HPV types with higher risk of developing CIN2+, and to compare diagnostic performance for CIN2+ using these types and type combinations.Methods:Cervical samples with histology follow-up from patients of a tertiary cancer center in Shanghai were collected for HPV genotyping by PCR-RDB. The risk associations of HPV types with CIN2+ were estimated by logistic regression analysis, and ROC curves were plotted for diagnostic performance evaluation.Results:A total number of 413 specimens were obtained, including 38 CIN1, 184 CIN2/3, 126 ICC patients and 65 negative control people. The 4 most common HPV types in CIN2+ were HPV16, 58, 33 and 18, in descending
Invasive uterine cervical carcinoma; Cervical intraepithelial neoplasia; Human papillomavirus; Genotyping
10.3969/j.issn.1007-3969.2014.05.004
R737.33
A
1007-3639(2014)05-0342-07
2014-02-09
2014-03-28)
国家自然科学基金青年科学基金项目(No:81101956/H1621);上海市自然科学基金(No:13ZR1408000)。
平波 E-mail:bping@shca.org.cn
order. And only HPV16 (P<0.000 1), 58 (P=0.002), 33 (P=0.015) were signi fi cantly associated with CIN2+ lesions. Besides, the area under the ROC curve of the HPV16/18/33/58 test scored statistically higher than the HPV16/18 test did (P=0.006 6).Conclusion:A combined test of HPV16/18/33/58 may offer better performance for detecting CIN2+ lesions in our geographic region.

