马鹿茸水溶性蛋白的提取与体外模拟消化研究
王 旋,赵 磊,王成涛(北京工商大学北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京100048)
马鹿茸水溶性蛋白的提取与体外模拟消化研究
王 旋,赵 磊*,王成涛
(北京工商大学北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京100048)
以鲜马鹿茸为原料,对比六种蛋白提取方法,依据提取蛋白量及SDS-PAGE电泳图谱确定鹿茸水溶性蛋白有效提取方法;模拟胃肠环境对提取的蛋白进行体外模拟消化研究,测定其体外胃肠消化稳定性及消化过程中游离氨基含量变化。结果表明:组成为100mmol/L Tris、6mol/L盐酸胍、0.02mol/L EDTA-2Na和1%胃蛋白酶抑制剂的提取液提取蛋白量最高,电泳条带多且清晰;蛋白在体外模拟胃、肠环境下消化5min后即迅速被分解,消化60min后即被分解为20ku以下的小分子量蛋白或多肽,消化2.5h后分子量主要分布在7823u及以下范围,在肠和胃肠连续消化过程中游离氨基含量随时间的延长而显著增加,这表明鹿茸水溶性蛋白较易被分解;模拟肠消化2.5h后游离氨基含量增加了一倍,显著大于胃消化中的增加量(p<0.01),这暗示着鹿茸水溶性蛋白更有利于肠消化。
马鹿茸,水溶性蛋白,电泳,体外模拟消化,游离氨基
鹿茸为脊索动物门哺乳纲鹿科的动物梅花鹿或马鹿的雄鹿未骨化密生绒毛的幼角,与人参、灵芝、冬虫夏草和阿胶共称为中华养生五大圣品。鹿茸化学成分复杂,含有蛋白质、糖胺聚糖、磷脂、脂肪酸、激素样物质、核酸、多胺及各种无机物质[1],其中鹿茸蛋白是最主要的化学成分,占干重的52%以上[2]。近年来一系列研究发现,鹿茸具有免疫调节、抗炎、抗氧化、抗衰老等多种生物学功能[3-6],有广泛的应用前景和巨大的市场价值。蛋白质和多肽在生命活动中起着重要的作用,研究表明鹿茸蛋白质和多肽在鹿茸的保健功能中占着极其重要的地位[7]。潘晓光[8]通过淋巴细胞增殖、细胞因子产生等实验确定鹿茸多肽对机体具有免疫增强作用。路来金等[9]研究发现鹿茸多肽可明显促进神经干细胞向神经元分化,提高分化细胞数量,从而促进神经系统损伤后的修复和再生。李振华等[10]报道鹿茸多肽对骨关节炎软骨细胞的氧化损伤有逆转作用,且在一定范围内呈现剂量依赖性。然而,现有对于鹿茸的研究多集中于其脂溶性成分及天然存在的生物活性肽,而高含量的蛋白质常被忽视,其消化吸收性质尚鲜有报道。动物异源蛋白在理论上存在免疫排斥反应等问题,这也是开发利用鹿茸蛋白产品的重要研究和控制点。现有对鹿茸蛋白及多肽的研究多集中于活性成分分析和保健作用的研究[11],市场上亦开始流行鹿茸蛋白保健品,而作为我国传统滋补良品,鹿茸的价格也比较昂贵,那么对高效提取鹿茸蛋白及其在体内的消化吸收情况的研究显得尤为重要。
本实验采用不同方法提取鹿茸蛋白,根据蛋白提取量和SDS-PAGE电泳图谱优化鹿茸水溶性蛋白提取方法;通过模拟胃肠道消化过程,分析鹿茸水溶性蛋白的消化稳定性以及消化过程中游离氨基含量变化,评价鹿茸水溶性蛋白的消化特性和营养价值,为进一步研究和开发鹿茸产品提供科学依据。
1 材料与方法
1.1 材料与仪器
鲜马鹿茸 由大兴安岭区科技局提供;牛血清蛋白Ⅴ组分、EDTA-2Na、盐酸胍 Amresco公司;胃蛋白酶(酶活力为2500U/mg pro)、胰酶、胃蛋白酶抑制剂Pepstatin A、Tricine Sigma公司;Protein Marker
北京全式金生物技术有限公司;二硫苏糖醇(DTT) Inalco公司;其他试剂 均为国产分析纯。
FD-1B-80型冷冻干燥机 南京普森仪器;TGL-10C型高速台式离心机 上海智城分析仪器制造有限公司;Sorvall Legend Micro 17R型微量离心机 Thermo公司;UV-2450型紫外可见光分光光度计 日本岛津;Bio-Rad型电泳仪 北京伯乐生命科学发展有限公司;HH-4型数显恒温水浴锅 金坛市科兴仪器厂;HQ45型恒温摇床 中国科学院武汉科学仪器厂;ATN-300型全自动凯氏定氮仪 上海洪纪仪器设备有限公司。
1.2 实验方法
1.2.1 鹿茸水溶性蛋白的制备 取新鲜马鹿茸经冷冻干燥后低温粉碎制成鹿茸粉末。称取1g鹿茸粉末放入50mL离心管中,分别加入8mL 4℃预冷的六种不同蛋白提取液(表1),4℃浸提36h,4500r/min离心30min,取上清液。经梯度盐析、透析、冷冻干燥得鹿茸水溶性蛋白,低温密封保存。根据蛋白提取量及电泳图谱确定有效提取方法。
1.2.1.1 样品蛋白含量测定 取上述浸提蛋白的上清液,采用考马斯亮蓝(Bradford)法[12]测定样品蛋白含量。
1.2.1.2 SDS-PAGE电泳法测蛋白质分子量分布 配制12%分离胶和5%浓缩胶,取1mg/mL蛋白溶液与样品缓冲液混合,100℃加热5min,上样前12000r/min离心1min,上样量为10μL。刚开始设置电压为80V,当溴酚蓝到达分离胶时电压设置为120V,当溴酚蓝到达分离胶底部时结束电泳。电泳后进行考马斯亮蓝R-250染色(染色液:1.0g考马斯亮蓝R-250,450mL甲醇,450mL蒸馏水,100mL冰醋酸)20min,脱色(10%甲醇;10%冰醋酸)3h。
1.2.2 蛋白质稳定性的测定 根据美国药典配制模拟胃肠消化液[13],模拟胃液(SGF):0.2g NaCl,0.32g胃蛋白酶,700μL浓盐酸,70mL蒸馏水,用盐酸调pH为
1.2 ,加蒸馏水定容至100mL。
模拟肠液(SIF):0.7g磷酸二氢钾溶于25mL蒸馏水,加入19mL 0.2mol/L氢氧化钠溶液和40mL蒸馏水,加入1.0g胰酶,用0.2mol/L氢氧化钠溶液调pH至7.5,加蒸馏水定容至100mL。
采用SDS-PAGE电泳测蛋白质模拟胃消化过程中分子量的变化,同1.2.1.2。同时,利用Tricine-SDSPAGE电泳共同分析低分子量蛋白质和多肽的分布。根据资料[14]配制16.5%分离胶、10%夹层胶、4%浓缩胶及阴极、阳极缓冲液,取1mg/mL蛋白溶液与样品缓冲液混合100℃加热5min,上样量为10μL。电泳初始电压设为70V,当样品到达分离胶时电压设为100V,当溴酚蓝到达分离胶底部时结束电泳。取出凝胶浸泡在固定液(50%乙醇,10%冰醋酸)中固定30min,然后染色20min,最后脱色至凝胶上背景脱净为止。
1.2.3 游离氨基含量的测定 采用茚三酮法[15]测定鹿茸水溶性蛋白模拟胃肠消化过程中的游离氨基含量变化,表征蛋白胃肠消化率。取干燥的亮氨酸(Leu)溶于蒸馏水配制成20mg/mL的溶液,稀释成含量为4、8、12、16、20μg/mL的溶液用于标准曲线绘制。每管加入2mL标准溶液和1mL新鲜配制的茚三酮溶液(0.5%茚三酮,11.2%Na2HPO4·12H2O,6%KH2PO4和0.3%果糖),混匀后于沸水浴中加热15min,然后冷水冷却。冷却后加入5mL 40%(v/v)乙醇溶液混匀,放置15min,同时作空白对照,用1cm比色杯以空白管调零于570nm处测定吸光值。用样品代替Leu标准溶液,其余操作同上,利用标准曲线计算水解蛋白液中-NH2基含量(mmol/g)。

表1 蛋白提取液的组成Table 1 The compositions of protein extracts
1.2.4 统计分析 每个实验至少重复三次,数据采用SPSS18.0软件分析,结果以均值±标准偏差(Mean± SD)表示,组间数据比较用单因素方差分析,p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 鹿茸水溶性蛋白提取方法比较
利用Bradford法测定不同提取方法的蛋白质浓度,结果如表2所示。将六种提取产物进行SDS-PAGE电泳,电泳图谱见图1。表2显示,方法3和4所提取的蛋白量显著高于其他四种方法,分别为(0.345±0.023)g和(0.342±0.015)g,但两者无显著性差异(p>0.05)。SDS-PAGE电泳(图1)呈现了六种不同提取液所提取的蛋白质分子量分布情况,显然方法3和4条带较清晰且分布较广。方法3所提取的蛋白分子量主要分布在45~120ku之间,与方法4的条带相比颜色较浅;方法4所提取的蛋白在40~120ku分子量范围内有多条条带分布,颜色深且清晰,在25~30ku范围内也有较宽的条带分布,在14ku左右亦有条带分布,显然该方法提取的成分更复杂。综合蛋白提取量和蛋白分子量分布情况分析,方法4(100mmol/L Tris+6mol/L盐酸胍+0.02mol/L EDTA-2Na+1%胃蛋白酶抑制剂)为本实验提取鹿茸中水溶性蛋白的有效提取方法。

图1 不同方法提取的鹿茸蛋白SDS-PAGE图谱Fig.1 SDS-PAGE electrophoretogram of velvet antler protein with different extracts
2.2 鹿茸水溶性蛋白在体外模拟消化中的稳定性
现有研究表明,鹿茸蛋白和多肽具有免疫增强、神经保护、抗骨质疏松、抗炎抗衰老等药理作用[16],在开发功能性食品方面有广泛的应用前景。而作为滋补良品,鹿茸蛋白的消化特性和致敏性尚鲜有报道。对于食品消化性能和致敏性评估的具体方案,其中一项就是评估目的蛋白在模拟胃肠中的消化稳定性。食物中若含有不易消化的致敏性蛋白,则极易引起人体的过敏反应。不能被胃蛋白酶降解的蛋白质或降解片段大于3.5ku的蛋白质可能是致敏蛋白[17-18]。本实验通过分析鹿茸蛋白体外模拟消化过程中分子量变化评价其消化稳定性。
2.2.1 蛋白质在模拟胃液中的稳定性 采用方法4获得鹿茸水溶性蛋白,进行体外模拟消化检测其在模拟胃液中的稳定性,凝胶电泳图谱如图2所示。鹿茸水溶性蛋白主要分布在40~120ku之间(图2A),在14.4~20.1ku处也有清晰条带分布(图2B)。加胃蛋白酶开始消化5min后蛋白质迅速分解,40ku以上大分子量蛋白基本消失(图2A),40ku处存在一清晰条带与泳道1中胃蛋白酶位置相一致,该条带始终存在于消化不同时间的模拟胃消化物中,推测其为胃蛋白酶条带。在模拟胃消化的时间内(10min~2.5h),分布在14~30ku之间的蛋白条带颜色逐渐变浅(图2A),而低于20.1ku的低分子量蛋白条带增加且颜色逐渐加深,在14.4ku附近新出现两个条带,样品蛋白消化1h以后7.8ku以下蛋白条带颜色明显加深(图2B)。由图2可以看出,大分子量的蛋白质可以在较短时间内被胃蛋白酶消化分解成为较小分子量的蛋白质和多肽,但在消化2.5h后仍有分解物分子量在14.4ku左右。
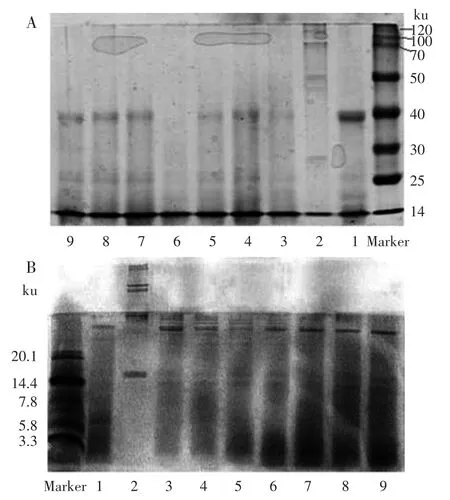
图2 鹿茸水溶性蛋白及其模拟胃消化的电泳图谱Fig.2 Electrophoretogram of velvet antler water soluble protein and its simulated gastric digests
2.2.2 蛋白质在模拟肠液中的稳定性 模拟肠消化过程中鹿茸水溶性蛋白质分子量变化的凝胶电泳图谱如图3所示。

表2 不同方法提取的鹿茸水溶性蛋白含量Table 2 The contents of velvet antler water soluble protein with different extracts
综合分析图3,开始消化5min后鹿茸水溶性蛋白中的大分子蛋白迅速被分解,蛋白条带主要分布于40ku以下(图3A),14ku以下亦有模糊条带出现(图3B)。在样品消化过程中,分子量在25、30ku附近及40ku下方一直存在微弱条带,并与胰酶的电泳条带相对应,推测其为消化酶。随着消化时间的延长,25ku上方的蛋白条带颜色逐渐变浅并模糊(图3A),在消化30min之后,蛋白条带主要集中于14ku以下。消化1.5h后,5.8ku以下蛋白条带颜色加深,样品蛋白已基本被分解为小分子蛋白质和多肽。

图3 鹿茸水溶性蛋白及其模拟肠消化的电泳图谱Fig.3 Electrophoretogram of velvet antler water soluble protein and its simulated intestinal digests
2.2.3 模拟胃肠道连续消化前后鹿茸蛋白的分子量变化 凝胶电泳分析鹿茸水溶性蛋白在模拟胃肠连续消化过程中分子量变化,见图4。在图4A中一直存在于30ku附近的条带以及图4B标注出的条带为消化酶。图4A显示,胃消化30min,蛋白样品中大分子蛋白减少,蛋白质分子量主要集中于40ku以下;加入胰酶消化后,大分子蛋白消失,在SDS-PAGE图谱中已看不到条带。从图4B可以看出,在开始继续肠消化10min后,14.4ku以下的条带分布增多、颜色加深;在消化2h后,原来位于20.1ku上方的条带消失,鹿茸水溶性蛋白模拟胃肠消化物的分子量主要集中在14.4ku以下,7.8ku及以下条带颜色加深。
综合分析电泳结果,在模拟胃肠连续消化过程中,随着消化时间的延长鹿茸水溶性蛋白的水解程度增加,大分子蛋白易被分解为小分子蛋白质和多肽。但在消化2h后,鹿茸水溶性蛋白模拟胃、肠独立消化产物和连续消化产物在7.8ku及以上仍有分布。王金梅等[19]研究表示大豆蛋白在消化2h后仍有分子量在25ku的蛋白未分解,而菜籽蛋白则全部被降解形成分子量更小的多肽。这表明鹿茸水溶性蛋白比大豆蛋白更易被水解,但其并不易被彻底消化直接吸收,这也有可能是体外模拟消化环境较简单、消化时间较短所致。FAO/WHO专家咨询委员会指出:对外源蛋白,不能被胃蛋白酶降解的蛋白质或降解片段大于3.5ku的蛋白质可能是致敏蛋白[18]。因为模拟胃肠液的成分、消化酶活性、目的蛋白与消化酶比例等均是影响结果的重要因素,且与胃肠实际环境差别较大,因此,鹿茸水溶性蛋白是否具有一定的致敏性,仍需进一步探讨。

图4 鹿茸水溶性蛋白及其模拟胃肠消化的电泳图谱Fig.4 Electrophoretogram of velvet antler water soluble protein and its simulated gastrointestinal digests
2.3 鹿茸水溶性蛋白游离氨基含量在模拟胃肠消化过程中的变化
蛋白质消化率是指一种食物蛋白质可被消化酶分解的程度,是评价食物营养价值的重要指标之一。蛋白质消化率越高,被人体吸收利用的可能性也就越大[20]。鹿茸作为我国传统的滋补良品,测定其蛋白质的消化率有助于提高原料的利用率、减少浪费、降低成本,且为今后鹿茸的营养成分的研究奠定基础。
本实验对鹿茸水溶性蛋白进行体外模拟胃、肠消化实验,根据消化过程中游离氨基含量变化表征胃肠消化率评价其消化特性。在胃和肠消化环境下鹿茸蛋白游离氨基含量变化情况如图5所示。鹿茸水溶性蛋白中游离氨基含量约为(0.53±0.02)mmol/g,在体外模拟胃消化0.5h后达到(0.66±0.01)mmol/g,游离氨基含量显著增加(p<0.01)。在消化至1.5h和2.5h时游离氨基的含量分别为(0.74±0.02)mmol/g和(0.75± 0.01)mmol/g,两者无显著差异(p>0.05),说明在1.5h后消化趋于稳定,但仍在较低水平,这表明鹿茸水溶性蛋白不易被胃蛋白酶水解。在模拟肠消化过程中游离氨基的量随时间的延长而显著增加,在消化2.5h后到达(1.09±0.02)mmol/g,较消化前增加了一倍,且仍呈上升趋势,并显著高于胃消化稳定后的游离氨基含量(p<0.01),这表明鹿茸水溶性蛋白在模拟肠消化中的水解度高于胃消化。
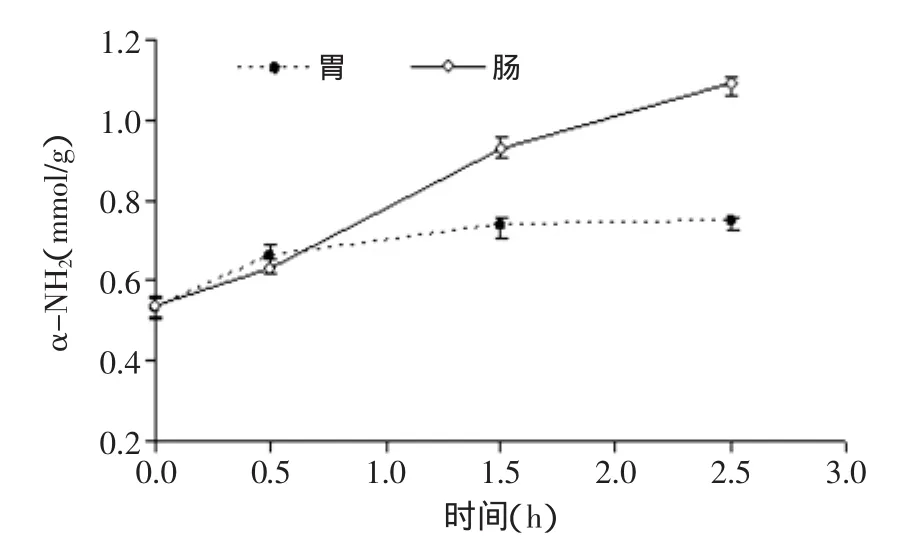
图5 鹿茸水溶性蛋白中游离氨基含量在模拟胃和肠消化过程中的变化Fig.5 Changes in the content of α-NH2during simulated gastric and intestinal digestion of velvet antler water soluble protein
在模拟胃肠连续消化过程中游离氨基含量变化如图6所示。游离氨基的量在胃消化阶段变化较小,而在进入肠消化阶段的1h内迅速由(0.74±0.02)mmol/g增加至(1.27±0.05)mmol/g。继续肠消化游离氨基含量持续增加,在消化5.5h后达到(1.56±0.03)mmol/g,并保持稳定。分析模拟消化过程中游离氨基含量的变化表明,在相同消化时间下,鹿茸蛋白在模拟胃肠连续消化中的水解程度高于单一的胃和肠消化;蛋白质在胃中消化程度较低,主要是将大分子蛋白质高级结构解链分解为较低分子量的蛋白质和多肽;蛋白质的消化主要是在后续的小肠中进行,该结果暗示着鹿茸水溶性蛋白更有利于体内肠消化。

图6 鹿茸水溶性蛋白中游离氨基含量在模拟胃肠连续消化过程中的变化Fig.6 Changes in the content of α-NH2during simulated gastrointestinal digestion of velvet antler water soluble protein
3 结论
本研究通过多种蛋白提取方法对比实验和体外模拟蛋白消化模型,确定最优马鹿茸水溶性蛋白的提取方法及蛋白的消化特性。结果表明,鹿茸水溶性蛋白的优化的提取液组成为:100mmol/L Tris+6mol/L盐酸胍+0.02mol/L EDTA-2Na+1%胃蛋白酶抑制剂,提取蛋白量为(0.342±0.015)g/g干鹿茸。样品大分子量蛋白在胃和肠消化中5min后即迅速被分解,消化60min后蛋白质主要分布在20ku以下,5.8ku以下的多肽迅速增加。鹿茸水溶性蛋白在胃中被消化程度较低,加入胰酶后水解程度变大,更易于肠消化。但在消化2.5h后鹿茸水溶性蛋白质模拟胃肠消化物分子量在7.8ku及以上仍有分布,分子量较大,直接口服鹿茸水溶性蛋白可能不易被充分吸收。
目前对鹿茸水溶性蛋白研究开发还较少,本文对其提取方法及体外模拟消化特性进行了初步探索,为鹿茸的进一步研究开发提供理论基础。鹿茸作为我国传统的滋补良品,将实验结果结合已证实的功能作用和良好的消化特性,将具有更广的利用空间和价值。
[1]郑虎占,董泽宏,余靖.中药现代研究与应用[M].北京:学苑出版社,2003.
[2]佟鑫,刘玉侠,吴荻,等.鹿茸多肽组分药理作用的研究进展[J].中国医药技术经济与管理,2009,3(4):60-62.
[3]Percival R S.Examining the Effects of Deer Antler Velvet Supplementation on Muscular Strength,Performance,and Markers of Delayed Onset Muscle Soreness[D].Nashville:East Tennessee State University,2001.
[4]刘瑜,王振宇,周丽萍.鹿茸提取物对糖尿病小鼠血糖及衰老的影响[J].东北林业大学学报,2010,38(5):97-98,113.
[5]林冬云,黄晓南,柯李晶,等.鹿茸中促大鼠成骨样细胞增殖活性组分的纯化与表征[J].中国中药杂志,2005,30(11):851-855.
[6]Zhao L,Luo YC,Wang CT,et al.Antioxidant activity of protein hydrolysates extract of velvet antler(Cervus elaphus)as molecular weight and enzymes[J].Natural Product Communications,2011(6):1683-1688.
[7]刘琳玲.鹿茸多肽功能的研究进展[J].特产研究,2009(2):67-70.
[8]潘风光,孙威,周玉,等.梅花鹿鹿茸活性多肽的提取及免疫功效的初步研究[J].中国生物制品学杂志,2007,20(9):669-673.
[9]Lu Laijin,Chen Lei,Meng Xiaoting,et al.Biological effect of velvet antler polypeptides on neural stem cells from embryonic rat brain[J].Chinese Medical Journal,2005,118(1):38-42.
[10]李振华,赵文海,周秋丽.鹿茸多肽对抗骨关节炎软骨细胞氧化损伤作用的实验研究[J].中国骨伤,2011,24(3):245-248.
[11]吴菲菲,金礼吉,李晓宇,等.鹿茸中天然活性成分的药理学功能的研究进展[A].2011中国鹿业进展,2011.
[12]南亚,李宏高.考马斯亮蓝G-250法快速测定牛乳中的蛋白质[J].饮料工业,2007,10(12):41-44.
[13]Pharmacopoeia U S,the National Formulary.Simulated gastric fluid and simulated intestinal fluid,TS[Z].The United States Pharmacopeia,1995,23:2053.
[14]Schägger H,Von Jagow G.Tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J].Analytical biochemistry,1987,166(2):368-379.
[15]Panasiuk R,Amarowicz R,Kostyra H,et al.Determination of α-amino nitrogen in pea protein hydrolysates:a comparison of three analytical methods[J].Food Chemistry,1998,62(3):363-367.
[16]柯雷芬,白海英.鹿茸多肽药理作用的研究进展[J].吉林医药学院学报,2013,34(2):138-140.
[17]FAO,WHO.WHO Expert consultation on allergenicity of food derived from biotechnology[R].Geneva:WHO,2001:12-13,2001.
[18]李英华,董杰,李剑虹,等.外源蛋白在模拟肠胃环境中稳定性测定模型初探[J].卫生研究,2004,33(4):433-436.
[19]王金梅,张占琴,王学军,等.菜籽蛋白的制备及其体外模拟消化[J].中国油脂,2008,33(9):10-15.
[20]孙敏杰,木泰华.蛋白质消化率测定方法的研究进展[J].食品工业科技,2011,32(2):382-385.

图8 有机磷农药抑制率曲线Fig.8 Curve of inhibition rate of organophosphate
2.3.2 酶电极的重现性和稳定性 选择一个酶电极,测定其对相同底液的响应电流,每隔20min测定一次,连续测6次,得出其响应电流,其相对标准偏差为7.8%。说明该酶传感器具有良好的重现性。另外选择一个修饰好的酶电极于PBS溶液内,置于4℃冰箱中保存,10d后再次测定其响应电流,可以达到原响应电流的87%,说明该酶电极具有较好的稳定性。
2.3.3 酶电极对实际样品的回收率测定 取洗净的样品(不含有机磷农药的白菜和胡萝卜),用刀切成小片,在其上滴适量一定浓度的乐果农药,置于小烧杯中,并加入适量的丙酮溶液浸泡,密封静置12h。以上述配制的溶液为待测的实际样品,在0.1mol/L PBS缓冲溶液中采用三电极系统对样品进行回收率测定。本实验分别对白菜和胡萝卜进行了平行五次测定,由表1可知,该方法的回收率分别为94.74%、101.68%,说明该有机磷生物农药传感器对样品中农药残留含量的测定具有良好的准确度。

表1 蔬菜样品回收率实验结果Table 1 Results of vegetable sample recovery
3 结论
本研究将硫堇聚合于玻碳电极表面制备了可用于蔬菜中有机磷残留检测的电化学酶传感器,该传感器具有响应快、灵敏度高,并具有较好的稳定性。将该传感器用于蔬菜样品中有机磷农药乐果的快速检测,显示出较高的准确性。
参考文献
[1]刘绍主编.食品分析与检验[M].武汉:华中科技大学出版社,2011:258-260.
[2]王永生,李贵荣,吕昌银,等.甘油三酯酶传感器的研制及应用[J].生物化学与生物物理进展,1999,26(2):144-145.
[3]刘真真,张敏,姚海军,等.酶生物传感器的研究进展[J].东莞理工学院学报,2007,14(3):98-99.
[4]AleidaS,HernándezC,MaríaA.Hyjpoxanthine-based enymatic sensor for determination of pork meat freshness[J].Food Chemistry,2010,123(3):949-954.
[5]刘润,郝玉翠,康天放.基于碳纳米管修饰电极检测有机磷农药的生物传感器[J].分析实验室,2007,26(9):10-12.
[6]宋昭,黄加栋,胡敏,等.快速检测敌百虫浓度传感器酶电极的研究[J].传感器技术,2005,24(7):16-18.
[7]周华,王辉宪,刘登友,等.基于碳纳米管修饰的酶生物传感器检测有机磷农药[J].传感器世界,2008,(8):23-26.
[8]孙春燕,李宏坤,平红,等.AuNPs/Sol-gel复合膜法固定乙酰胆碱酯酶生物传感器检测有机磷农药[J].高等学校化学学报,2011,32(11):2533-2538.
[9]孔冰,穆绍林.硫堇的电化学聚合及聚硫堇的性质[J].物理化学学报,2001,17(4):295-299.
[10]吴芸,陈昌云,赵波,等.基于聚硫堇/多壁碳纳米管共修饰沙丁胺醇电化学传感器构建[J].食品科学,2009,30(19):40-43.
[11]李春香,曾云龙.基于原位电聚合硫堇的双酶型葡萄糖传感器的研究[J].分析科学学报,2006(3):243-247.
[12]蔡称心,鞠熀先,陈洪渊.聚硫堇修饰微带金电极的性质及对NADH的催化氧化[J].高等学校化学学报,1995,16(3):369-371.
[13]丁建英,韩剑众,冯志梅,等.基于聚硫堇的一次性过氧化氢生物传感器的研究[J].食品科技,2010,35(4):265-268.
[14]魏福祥,韩菊.乙酰胆碱酯酶酶电极反应机理[J].河北科技大学学报,2005,26(2):106-209.
[15]Nidhi C,Chandra S.An amperometric acetylcholinesterase sensor based on Fe3O4nanoparticle/multi-walled carbon nanotubemodified ITO-coated glass plate for the detection of pesticides [J].Electrochimica Acta,2012,67:79-86.
Extraction and in vitro simulated gastrointestinal digestion of velvet antler water-soluble protein
WANG Xuan,ZHAO Lei*,WANG Cheng-tao
(Beijing Engineering and Technology Research Center of Food Additives,Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
The optimal extract method of velvet antler water-soluble protein was determined in this study according to the protein content and SDS-PAGE electrophoresis of six extracts./n vitro simulated gastrointestinal digestion of velvet antler water-soluble protein was investigated in terms of digestibility and free α-amino nitrogen content.Results showed that the extract obtained with the solution composed of 100mmol/L Tris,6mol/L guanidine hydrochloride,0.02mol/L EDTA-2Na and 1%Pepstatin A had the largest protein content and clearest electrophoresis bands.The protein was rapidly hydrolyzed in 5min by in vitro simulated gastrointestinal digestion,and then it was broken into small proteins and peptides less than 20ku in 60min.The hydrolysate mainlydistributed below 7823u after2.5h,and the free α-amino nitrogen contentwasincreased significantly during both intestinal and gastrointestinal digestion.The content of free α-amino nitrogen had doubled after simulating intestinal digestion for 2.5h,and was significantly higher than the increment in gastric digestion(p<0.01).The results indicated that water-soluble protein of velvet antler was easily hydrolyzed and more suitable for intestinal digestion.
velvet antler;water-soluble protein;electrophoresis;in vitro simulated gastrointestinal digestion;free α-amino nitrogen
TS201.4
A
1002-0306(2014)12-0081-06
10.13386/j.issn1002-0306.2014.12.008
2013-09-26 *通讯联系人
王旋(1991-),女,硕士研究生,研究方向:功能性食品。
国家自然科学基金青年科学基金项目(31201324);北京市教育委员会科技计划面上项目(KM201210011008)。

