生物转化法产D-阿洛糖的分离纯化
冯再平,沐万孟,江 波,*,张 涛,薛 冬
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.兰州理工大学生命科学与工程学院,甘肃兰州 730050;3.太极集团浙江东方制药有限公司,浙江绍兴 312000)
生物转化法产D-阿洛糖的分离纯化
冯再平1,2,沐万孟1,江 波1,*,张 涛1,薛 冬3
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.兰州理工大学生命科学与工程学院,甘肃兰州 730050;3.太极集团浙江东方制药有限公司,浙江绍兴 312000)
利用重组菌E.coli BL21/pET-22b-tl-rpib,将原料D-阿洛酮糖生物转化为具有抑癌效果的稀有糖D-阿洛糖。经液相色谱和串联质谱联用技术(LC-MS/MS)鉴定,反应混合液中25%的D-阿洛酮糖转化成了D-阿洛糖。等电聚焦法测定了重组蛋白的等电点为6.3,并成功运用到产物混合液的去蛋白沉淀中。经过预处理的混合糖液,通过DTFCa2+型离子交换树脂实现了分离纯化。最佳分离条件为:柱温60℃,进样量4mL,流速1mL/min。
D-阿洛糖,生物转化,等电点沉淀,纯化
稀有糖(Rare sugar)是一类重要的碳水化合物,在膳食、保健、医药等领域中发挥着非常重要的功能。根据国际糖协会(ISRS)定义,已知的己糖和戊糖中,除了葡萄糖、半乳糖、甘露糖、果糖、木糖、核糖和L-阿拉伯糖等7种单糖在自然界大量存在以外,其余20种己糖和9种戊糖都属于在自然界含量极少的稀有糖[1]。稀有糖一般具有低热量、低吸收的特点,如D-塔格糖、D-阿洛酮糖等。D-阿洛糖由于具有广泛的生理功能[2],特别是具有优异的抑癌作用[3]和辅助癌症放[4]、化疗[5]的作用,而成为稀有糖功能性及生物转化研究中的热点。
D-阿洛糖是D-葡萄糖的C-3位差向异构体,属于稀有糖,可利用化学合成和生物转化法生产。相对于化学法,生物转化法具有反应专一性强、副产物少、污染小等优点。D-阿洛糖的生物转化可以通过两步反应实现[6]:首先由较便宜的D-果糖出发,通过D-塔格糖-3-差向异构酶(D-tagatose-3-epimerase,DTE)家族转化生产D-阿洛酮糖[7];D-阿洛酮糖再由L-鼠李糖异构酶(L-Rhamnose isomerase,L-RhI)[8]或者核糖-5-磷酸异构酶B(ribose-5-phosphate isomerase,RpiB)[9]等酶类催化酮醛糖异构化反应从而获得D-阿洛糖。生物转化法生产稀有糖时,产物和底物通常以一定平衡比例混合存在于混合液中,因此解决产物分离的问题是稀有糖生产中必须面对的难题。通过Ca2+型阳离子树脂配位交换可实现单糖的分离[10],D-阿洛酮糖与D-果糖的分离方法已有文献报道[11],而D-阿洛糖与D-阿洛酮糖的分离尚未见报道。要实现D-阿洛糖在食品、制药等领域的大规模应用,先要解决生物转化法生产得到的混合糖液的分离纯化问题。
1 材料与方法
1.1 材料与仪器
D-阿洛糖、D-阿洛酮糖 Sigma公司,(≥95%);DTF-Ca2+色谱分离树脂 江苏苏青集团;IPG预制胶条 、 水 化 上 样 缓 冲 液 美 国 Bio-Rad 公 司 ;CaCl2、DTT、丙酮、盐酸等试剂 均为分析纯。
Agilent 1260高效液相色谱 Agilent公司;Sugar-PakTM1糖柱、UPLC/ES-QTOF-MS液相色谱串联四极杆飞行时间质谱仪、ACQUITY UPLC色谱仪 Waters公司;HL-2B型数显恒流泵、DBS-100自动部分收集器 上 海 沪 西 分 析 仪 器 厂 ;PowerPac Basic电 泳 设备 美国Bio-Rad公司。
1.2 实验方法
1.2.1 D-阿洛糖的生物转化[9]RpiB酶因具有广泛的底物特异性,可催化与磷酸糖相类似的单糖底物发生酮醛异构化,而被应用于D-阿洛糖的酶法生产。本实验室构建了可以表达Thermotoga lettingae TMO RpiB酶的重组菌E.coli BL21/pET-22b-tl-rpib,诱导表达后获得冻干菌体备用。在pH8.0,55℃条件下,适量冻干菌体振荡转化100g/L的D-阿洛酮糖底物24h。
1.2.2 转化产物的LC-MS/MS鉴定 LC-MS/MS检测含D-阿洛酮糖和D-阿洛糖的产物混合糖液。色谱条件为:ACQUITY UPLC色谱仪,TSK-gel Amide-80氨基柱,流动相65%乙腈,柱温35℃,流速0.3mL/min,进样量1μL。质谱条件为:电喷雾离子(ESI)源;毛细管电压3.0kV;锥孔电压30V;离子源温度100℃。将D-阿洛糖、D-阿洛酮糖标样及反应产物分别上样,测定分析,对照标样和样品峰的出峰时间及质谱碎片,分析样品成分。
1.2.3 重组酶蛋白等电点测定[12]采用离心配合等电点沉淀的方法除去混合糖液中大量存在的RpiB蛋白,需要先测定重组蛋白的等电点。纯化得到电泳纯度95%以上的重组蛋白,重悬于含0.2%DTT的预冷丙酮中,-20℃沉淀过夜。4℃,12000r/min离心30min,沉淀重悬于含0.2%DTT的预冷丙酮中,-20℃放置1h。4℃,12000r/min离心30min,在通风橱中让丙酮充分挥发,得到干燥的沉淀。500μL水化上样缓冲液充分溶解适当量的蛋白粉末。在装有预制胶条的水化盘中加入蛋白水化液,4℃水化过夜后进行等点聚焦电泳、考马斯亮蓝染色。
1.2.4 D-阿洛糖样品预处理 经过生物转化得到的产物混合液,8000r/min离心30min除去菌体。调节溶液pH至等电点后煮沸,保持5min使产物混合液中的酶蛋白变性沉淀,12000r/min离心30min除去溶液中蛋白质。采用阴阳离子色谱法脱盐脱色[11],得到含D-阿洛酮糖和D-阿洛糖的混合糖液。
1.2.5 DTF-Ca2+离子交换层析[13]DTF-Ca2+色谱分离树脂的处理再生:180mL树脂装填到长1m,内径1.6cm的带有恒温夹套的层析柱,5%的盐酸溶液冲洗至进出口酸度相同后,浸泡4h,纯水冲洗至中性;10%CaCl2溶液冲洗至流出液pH7.30后,浸泡4h,纯水冲洗树脂至中性。上样一定量的混合糖液,以去离子水作为流动相,分别控制夹套温度为55、60、65℃,进样量为4、8、12mL,流速为0.5、1、2mL/min进行洗脱,部分收集器收集洗脱样品。
1.2.6 收集部分的HPLC检测 HPLC测定各收集部分中D-阿洛糖和D-阿洛酮糖的浓度[13],计算分离度。分离度的计算公式为[11]:
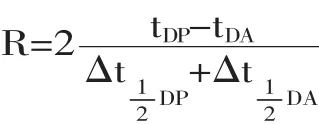
式中,tDP为D-阿洛酮糖保留时间,tDA为D-阿洛糖保留时间,为D-阿洛酮糖色谱峰的半峰宽度,为D-阿洛糖半峰宽,以上单位均为min。
2 结果与讨论
2.1 D-阿洛糖产物的定性、定量检测
以含RpiB酶的菌体催化D-阿洛酮糖的生物转化,获得含有D-阿洛糖的产物混合液。对转化产物进行LC-MS-MS定性,对比转化产物和标准品的液相出峰时间及质谱图谱,分析反应产物成分。如图1所示,在(e)产物色谱图中,有两个峰分别与(a)中的D-阿洛糖标样及(c)中的D-阿洛酮糖标样色谱出峰时间 相 对 应 ;且 对 应 时 间 出 峰 处 的 MS-MS 图 谱 ,(f)与(b)中D-阿洛糖标样、(g)与(d)中D-阿洛酮糖标样的MS-MS谱图碎片相一致。因此,可以判定转化产物中确实存在D-阿洛糖、D-阿洛酮糖两种组分,即生物转化法生产D-阿洛糖的产物与底物,且根据色谱定量结果表明,转化产物中两者的比例是25∶75,与其他文献[3]报道的RpiB催化D-阿洛糖生成的酶反应产物平衡比例较为接近。
2.2 等电点测定及产物预处理
重组RpiB等电点的计算值为6.49,而根据IPG预制胶条的线性梯度计算出来的RpiB的等电点为6.3,说明该酶的等电点在中性偏酸的位置。在等电点沉淀去蛋白的时候,以盐酸调节产物混合液的pH至6.3~6.5之间时出现明显混浊,加热处理后出现大量沉淀;与同不调节pH并直接进行加热处理的产物混合液相比,蛋白沉淀增加显著。本转化反应中运用的RpiB酶耐热性较好,转化反应可以在较高温度下进行,提高了转化效率且不易受微生物污染。因此,不同于其他酶高温处理后即可变性沉淀,在产物处理的时候,必须结合等电点沉淀和高温处理,才能达到满意的蛋白去除效果。同时,调节反应产物pH到中性偏酸后再进行加热处理,也可避免单糖在偏碱性环境中加热生成较多的副产物。
2.3 糖液的离子交换树脂分离
2.3.1 温度对分离效果的影响 根据HPLC测定结果,D-阿洛糖先于D-阿洛酮糖洗脱下来。糖液浓度与洗脱体积进行Gause拟合,计算两者的分离度。如图2所 示 ,进 样 量 为 12mL,流 速 为1mL/min,柱 温 为55、60、65℃时,分离度分别为1.01、1.09和1.01,可见60℃时D-阿洛糖和D-阿洛酮糖分离效果较好,在后续实验中采用此柱温条件。
2.3.2 进样量对分离效果的影响 采用流速1mL/min,柱温60℃的分离条件,考察进样量对分离效果的影响。由图3可知,进样量为4、8、12mL时对应的分离度分别为1.76、1.51和1.13。在固定填料体积的情况下,进样为4mL时的分离效果较好,上样量增加,加大了分离柱的负荷,糖之间的分离度下降。进样体积8mL时,分离效果稍有下降,但是一次进样量提高了1倍,产品量较多而对纯度要求不高时可以考虑使用该条件。
2.3.3 洗脱速率对分离效果的影响 柱温为60℃、进样体积为4mL时,不同洗脱速率下D-阿洛糖和D-阿洛酮糖分离曲线如图4所示。结果显示,洗脱速率为0.5、1、2mL/min时,分离度分别为1.45、1.76和1.37,1mL/min为最佳洗脱速率,在此条件下可以分离得到纯度90%以上的D-阿洛糖。
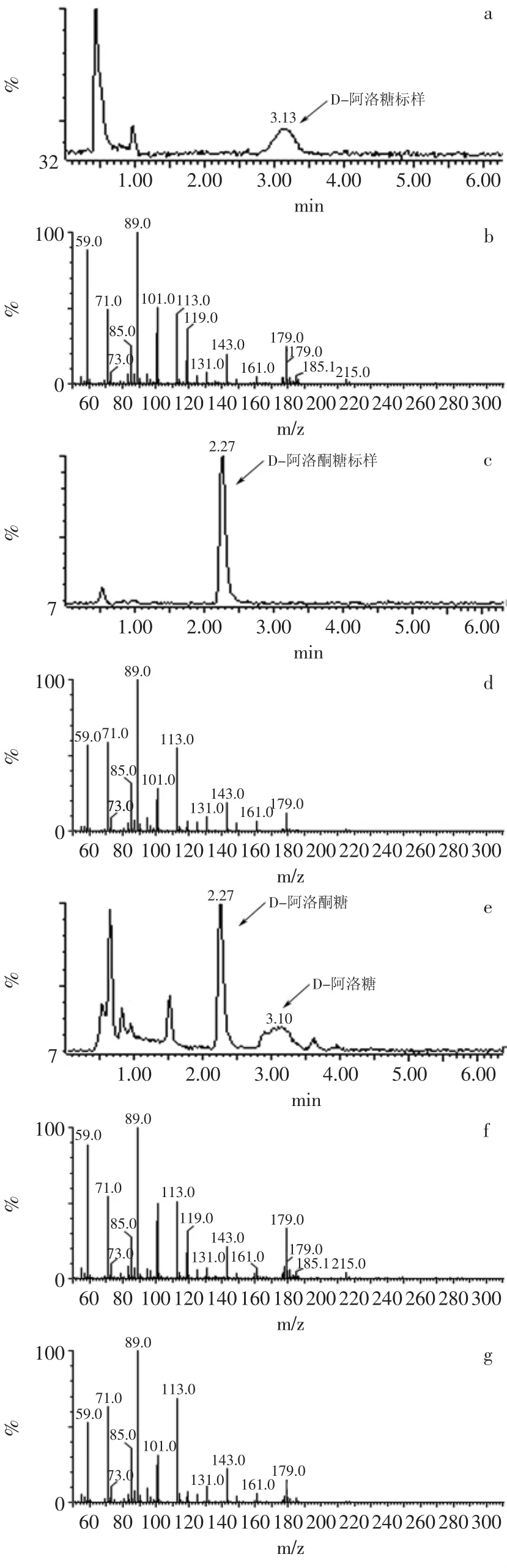
图1 生物转化产物的LC-MS-MS图谱Fig.1 LC-MS-MS profile of main products in the reaction mixture
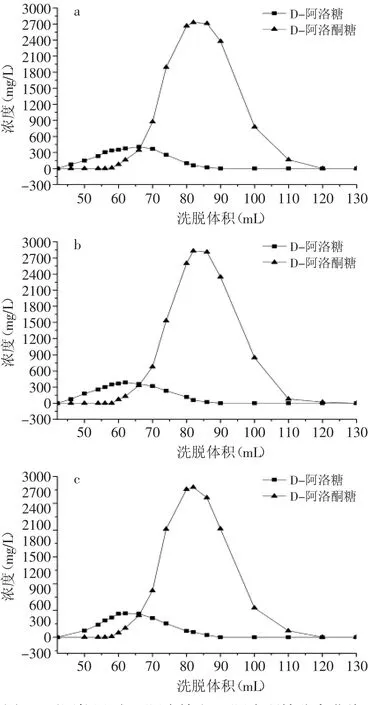
图2 不同柱温时D-阿洛糖和D-阿洛酮糖分离曲线Fig.2 Seperation curve of D-allose and D-psicose at different temparatures
3 结论
利用重组菌E.coli BL21/pET-22b-tl-rpib,以D-阿洛酮糖为底物进行生物转化,LC-MS-MS检测,获得了D-阿洛糖、D-阿洛酮糖两者比例为25∶75的产物混合液。针对重组RpiB耐热性好,仅用高温处理反应液去蛋白效果不理想的情况,本研究通过等电聚焦电泳测得重组酶的等电点为6.3,在此基础上实现了等电点沉淀结合热处理法去除反应液里的蛋白,取得了较好的效果。建立了DTF-Ca2+型离子交换树脂分离D-阿洛糖、D-阿洛酮糖的方法,分离得到了纯度90%以上的D-阿洛糖,为大规模生物转化法产D-阿洛糖提供了技术支持。DTF-Ca2+型离子交换树脂分离D-阿洛糖的具体条件为:填料180mL,带恒温夹套的层析柱长1m,内径1.6cm,去离子水为流动相,进样量为4mL,洗脱速率为1mL/min流速,柱温为60℃。

图3 不同上样体积时D-阿洛糖和D-阿洛酮糖分离曲线Fig.3 Seperation curve of D-allose and D-psicose with different loading volume

图4 不同洗脱速率时D-阿洛糖和D-阿洛酮糖分离曲线Fig.4 Seperation curve of D-allose and D-psicose at different flow rate
[1]Granstrom T B,Takata G,Tokuda M,et al.Izumoring:A novel and complete strategy for bioproduction of rare sugars[J]. Journal of Bioscience and Bioengineering,2004,97(2):89-94.
[2]沐万孟,张龙涛,江波,等.D-阿洛糖的功能及生物转化生产研究进展[J]. 安徽农业科学 ,2007,35(32):10192-10193,10200.
[3]Lim Y R,Oh D K.Microbial metabolism and biotechnological production of D-allose[J].Applied Microbiology and Biotechnology,2011,91(2):229-235.
[4]Hoshikawa H,Indo K,Mori T,et al.Enhancement of the radiation effects by D-allose in head and neck cancer cells[J]. Cancer Letters,2011,306(1):60-66.
[5]Yamaguchi F,Kamitori K,Sanada K,et al.Rare sugar D-allose enhances anti-tumor effect of 5-fluorouracil on the human hepatocellular carcinoma cellline HuH-7[J].Journalof Bioscience and Bioengineering,2008,106(3):248-252.
[6]柏玮,朱玥明,门燕,等.以D-果糖为原料利用新型异构酶转化生产D-阿洛糖[J]. 生物工程学报,2012,28(4):457-465.
[7]Mu W M,Zhang W L,Feng Y H,et al.Recent advances on applications and biotechnological production of D-psicose[J]. Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[8]Lin C J, Tseng W C,Fang T Y.Characterization of a thermophilic L-rhamnose isomerase from caldicellulosiruptor saccharolyticus atcc 43494[J].Journal of Agricultural and Food Chemistry,2011,59(16):8702-8708.
[9]Feng Z P,Mu W M,Jiang B.Characterization of ribose-5-phosphate isomerase converting D-psicose to D-allose from Thermotoga lettingae TMO[J].Biotechnology Letters,2013,35(5):719-724.
[10]钱永,戴军,彭奇,等.离子交换树脂层析法分离木糖醇结晶母液[J].离子交换与吸附,2005,21(2):112-120.
[11] 邢庆超,沐万孟,江波,等.D-阿洛酮糖的分离纯化[J]. 食品工业科技,2011,32(9):236-238.
[12] 郭尧君. 蛋白 质 电 泳 实 验 技 术[M]. 北 京 :科 学 出 版 社 ,2001:262-283.
[13]赵萌,张涛,沐万孟,等.阳离子交换树脂分离纯化酶法合成 的 双 果 糖 酐 Ⅲ[J]. 食 品 与 发 酵 工 业 ,2009,35(9):134-136,141.
Separation and purification of D-allose produced by biotransformation
FENG Zai-ping1,2,MU Wan-meng1,JIANG Bo1,*,ZHANG Tao1,XUE Dong3
(1.The State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China;3.Taiji Group Zhejiang Dongfang Pharmaceutical Co.,Ltd.,Shaoxing 312000,China)
The anticancer rare sugar D-allose was converted from D-psicose by E.coli BL21/pET-22b-tl-rpib. The LC-MS/MS results showed that 25%of D-psicose was converted to D-allose in the reaction product mixture.The pI of the recombinant protein was 6.3 determined by isoelectrofocusing and was successfully applied in isoelectric precipitation.The methods of separation and purification of D-allose was established according to DTF-Ca2+cation exchange chromatography with a flow rate of 1mL/min,column temperature at 60℃ and the loading volume of 4mL.
D-allose;biotransformation;isoelectric precipitation;purification
TS202
A
1002-0306(2014)22-0304-05
10.13386/j.issn1002-0306.2014.22.058
2014-02-27
冯再平(1978-),女,博士研究生,讲师,研究方向:食品生物技术。
* 通讯作者:江波(1962-),男,博士,教授,研究方向:酶在食品生物制造中的应用。
国家自然科学基金项目(21276001,31171705);绍兴市科技计划项目(2013A23002)。

