结肠癌微环境对骨髓间充质干细胞形态、增殖及CD13、CD133表达的影响
景 明,陈正君,王雅莉,张艳霞,刘雪枫
(1.甘肃中医学院,甘肃兰州730000;2.甘肃省中药药理与毒理学重点实验室,甘肃兰州730000)
·实验研究·
结肠癌微环境对骨髓间充质干细胞形态、增殖及CD13、CD133表达的影响
景 明1,2,陈正君1,王雅莉1,张艳霞1,2,刘雪枫1
(1.甘肃中医学院,甘肃兰州730000;2.甘肃省中药药理与毒理学重点实验室,甘肃兰州730000)
目的观察结肠癌微环境对骨髓间充质干细胞(BMSCs)形态、增殖及CD13、CD133表达的影响。方法对照组为BMSCs单独培养,实验组采用Transwell小室建立BMSCs与结肠癌SW480细胞非接触、共培养的微环境。显微镜观察BMSCs的形态变化,四氮唑兰比色法(MTT)检测BMSCs增殖情况,流式细胞仪检测其周期及表面抗原的表达。结果与对照组比较,实验组BMSCs的形态具备了恶性肿瘤细胞的特点,增殖速度增高,其S期细胞含量(41.1%)较对照组(9.67%)明显增加;实验组BMSCs的CD13的表达为89.7%±9.5%,明显高于对照组的67.1% ±8.1%(P<0.01);实验组BMSCs的CD133的表达为90.5%±6.4%,明显高于对照组的4.3%±1.2%(P<0.01)。结论应用Transwell小室可实现结肠癌SW480细胞和BMSCs非接触共培养,并能诱导BMSCs细胞发生恶性转化,其机制与引起细胞形态、增殖能力及细胞表面标记物等生物学特性的改变有关。
结肠癌微环境;骨髓间充质干细胞;细胞周期;CD13和CD133
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一群来源于骨髓组织中的多能干细胞,具有多向分化潜能,易于体外分离并培养,具有极好的迁移能力及肿瘤趋向性和低免疫原性,是理想的组织工程种子细胞[1,2]。然而,随着近年来对BMSCs生理特性和肿瘤研究的不断深入,却发现BMSCs经长期培养,尤其在肿瘤微环境中可能发生恶性转化,从而进一步促进肿瘤的发生、发展[3,4]。为此,本实验采用Transwell小室建立BMSCs与结肠癌细胞SW480非接触共培养的模拟肿瘤微环境,对微环境中BMSCs形态、增殖及细胞表型等相关生物学特性进行研究,为进一步了解BMSCs在重塑的肿瘤微环境中生物学行为的变化提供参考依据。
1 实验材料
1.1 动物 健康雄性SPF级Wistar大鼠,体重(180±20)g,由甘肃中医学院科研实验中心提供,动物合格证号:SCXK(甘)2001-0001-0001332,动物实验设施使用证号:SYXK(甘)2001-0001-0000390。
1.2 细胞株 结肠癌SW480细胞株购自江苏江阴齐氏生物科技有限公司。
1.3 主要试剂 胎牛血清、DMEM培养基和0.25%胰蛋白酶(trypsin,Hyclone公司);二甲亚砜(DMSO,美国Amresco公司);碘化丙啶(PI,美国Sigma公司),四甲基偶氮唑蓝(MTT,美国Sigma公司)。
1.4 主要仪器 细胞培养箱(日本三洋电机公司),倒置相差显微镜(日本Olympus公司),流式细胞仪(美国Becton Dickin-son公司),荧光显微镜及摄像系统(日本Nekon90I公司),Transwell插入式培养皿(美国Millicell公司),细胞计数板(南京建成生物工程研究所),酶标仪(美国Thermo公司)。
2 方法
2.1 BMSCs的分离培养 Wistar大鼠经颈椎脱臼法处死后,无菌条件下剥离肌肉,分离股骨及胫骨,剪去两端软骨暴露出骨髓腔,随后用注射器吸取DMEM培养液冲洗骨髓腔2~3次,收集冲洗液至离心管。1 000 rpm离心10 min,弃上清,制成细胞悬液,接种于50 mL培养瓶,置于37℃、饱和湿度、5% CO2孵箱中培养。48 h后换液,去除未黏附的细胞,以后每3天更换培养液一次。
待细胞生长至80%~90%融合时,按照1∶2比例传代,培养液为含10%胎牛血清和青、链霉素各100 U·mL-1的DMEM培养液,2~3日更换培养液一次,根据生长情况传至3~4代,用台盼蓝测定细胞活力在95%以上时进行下一步实验。
2.2 分组
2.2.1 对照组 第4代的BMSCs置于37℃、5% CO2孵箱中用含10%胎牛血清和青、链霉素各100 U·mL-1的DMEM培养液单独培养。
2.2.2 实验组 BMSCs与SW480非接触共培养。采用有PET膜的Transwell悬挂式培养小室结合6孔板进行培养,将第4代BMSCs细胞接种于放有小室的6孔板内,小室内种植SW480细胞,调整两种细胞的比例为1∶1,培养液为含10%胎牛血清和青、链霉素各100 U·mL-1的DMEM培养液,每24 h更换培养液一次。培养环境为37℃、5%CO2孵箱。以上两组处于对数生长期的BMSCs细胞,用含0.25%胰蛋白酶消化,制成l×106个·mL-1左右单细胞悬液检测指标。
2.3 指标检测
2.3.1 MTT法检测细胞增殖 用计数板计数,将细胞悬液浓度调整为1×104个·mL-1,接种于96孔板,每孔200μL,置恒温培养箱中培养,每3天换液。在一周内每天每组取1孔进行计数,另外每组各取3孔分别加入20μLMTT(5 mg·mL-1),继续孵育4 h后小心弃去液体,每孔内加入150μL DMSO,摇床上低速震荡10 min。在490 nm处用酶标仪测定各孔的吸光度(A)值,再根据吸光度和细胞计数的关系,绘制细胞生长曲线,并计算结肠癌微环境对BMSCs生长的增殖率,增殖率(%)=(实验-对照)/对照×100%。
2.3.2 流式细胞仪检测细胞表面抗原 取洁净的塑料试管,分别加入荧光标记小鼠抗人单克隆抗体CD13和CD133各20μL,每管加入细胞悬液100μL,混合均匀,室温下孵育30 min。每管加入1.5 mL PBS,充分混匀,1 800 rpm离心5 min后弃上清,每管加200μL PBS。混匀后,流式细胞仪检测,用Apple随机软件进行分析,每个样本分析10 000个细胞。
2.3.3 细胞周期检测 将细胞悬液转移至预装2 mL DMEM培养液的离心管中,以5 000 rpm转速离心3 min。弃弃去上清液,用2 mL PBS洗涤细胞沉淀,以0.8 mL预冷PBS制备单细胞悬液(2×106个·mL-1),边振荡边逐滴加入2.4 mL预冷至4℃的无水乙醇进行细胞固定。4℃冰箱固定24 h,再用冷PBS液洗涤细胞两次去除固定液,加300~500 μL碘化丙啶染液,在室温下避光放置20 min以上。用流式细胞仪进行细胞周期检测。
2.4 统计学分析 应用SPSS 17.0统计软件分析结果。计量资料结果采用均数±标准差±s)表示,组间比较用配对样本的t检验,P<0.05为差异有统计学意义。
3 结果
3.1 BMSCs形态鉴定 骨髓间充质干细胞在贴壁培养48 h后细胞的形态表现为:可见散在贴壁细胞,细胞排列紊乱,呈长梭形或多角形,细胞之间通过突起相连接,细胞的两极朝向不规律;7~10 d后,呈梭形或长多边形,贴壁细胞体积增大,细胞数目明显增多,形态不完全均一,但细胞排列整齐,边界清晰,在培养瓶中分布及生长均匀。原代培养10~14 d细胞可达80%~90%融合,经过3代后骨髓间充质干细胞形态大体相似(见图1、2)。

图1 第三代骨髓间充质干细胞(×100)

图2 第三代骨髓间充质干细胞(×200)
3.2 共培养后BMSCs的细胞形态 共培养后骨髓间充质干细胞中有部分细胞出现圆形的形态改变(见图3)。用限制稀释法继续培养后,骨髓间充质干细胞形态不一,细胞较大,胞核增大,核大小、形状和染色不一,并可见巨核、双核、异型核、多核等,具备了恶性肿瘤细胞的特点(见图4)。

图3 共培养后骨髓间充质干细胞的形态(Bar,100μm)
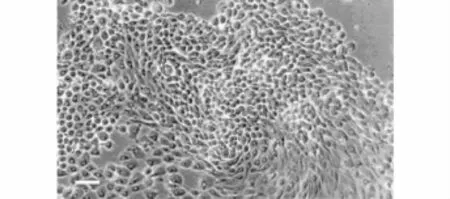
图4 继续共培养后骨髓间充质干细胞(Bar,200μm)
3.3 BMSCs表面抗原检测 流式细胞技术检测BMSCs表面标记物,结果表明,实验组BMSCs的CD13和CD133的阳性表达均高于对照组(见表1)。
表1 结肠癌微环境对骨髓间充质干细胞CD13和CD133表达的影响(±s)

表1 结肠癌微环境对骨髓间充质干细胞CD13和CD133表达的影响(±s)
注:与对照组比较,*P<0.01
表面抗原 CD13 CD133对照组(%)67.12±8.10 4.33±1.24实验组(%) 89.73±9.51* 90.50±6.42*
3.4 BMSCs生长曲线和细胞周期 MTT结果显示,BMSCs和结肠癌SW480细胞共培养后,其增殖速度明显高于对照组(见表2、图5)。
表2 结肠癌微环境对骨髓间充质干细胞增殖率的影响(%,±s)

表2 结肠癌微环境对骨髓间充质干细胞增殖率的影响(%,±s)
注:与对照组同时间增长率比较,*P<0.01
时间(d)1 2 3 4 5 6 7对照组(%) 8.57±2.26 48.57±3.88 71.43±4.10 85.71±6.66 91.43±7.71 111.43±8.22 117.14±8.01实验组(%) 17.14±2.10* 62.86±3.35*100.00±5.66*122.86±5.20*148.57±4.85*157.14±7.84*182.86±7.92*
3.5 BMSCs细胞周期 流式细胞仪检测结果显示,对照组BMSCs各周期比例分别为G0/G1:78.65%±1.12%,G2/M:11.68%±0.34%,S:9.67% ±0.20%;与SW480细胞共培养后,BMSCs各周期比例分别为G0/G1:48.82%±0.47%,G2/M:10.08%± 0.13%,S:41.1%±0.26%。实验组BMSCs处于静止期(G0/G1)的细胞比例低于对照组(P<0.01),而处于增殖期(G2/M、S)的细胞比例明显高于对照组(P<0.01)(见图6、7)。
4 讨论
随着对间充质干细胞(marrow mesenchymalstem cells,MSCs)研究的不断深入,越来越多的干细胞成瘤的现象被报道[5,6]。Rubio等[7]报道将体外培养8个月内、分裂90~140次的间充质干细胞移植入动物体内会引起肿瘤产生。他们也发现体外扩增6~8周的人MSCs是安全的,但经过4~5月长时间培养后,间充质干细胞可发生恶性转化。Miura等[8]将鼠骨髓间充质干细胞经过一年以上连续传代后,获得无限群体倍增数,发生恶性转化,形成纤维肉瘤,进一步通过尾静脉注射入裸鼠体内后形成肿瘤;但同样的条件下培养的人间充质干细胞却没有发生恶性转化。因此,MSCs的恶性转化,目前尚存在争议。

图5 结肠癌微环境对BMSCs增殖率的影响(±s)
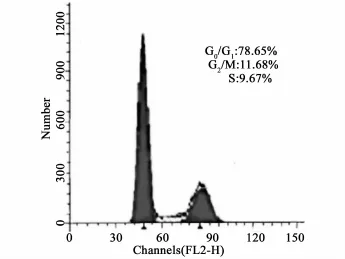
图6 单独培养后对照组各细胞周期(±s)

图7 共培养后实验组各细胞周期(±s)
肿瘤微环境能调控肿瘤细胞和骨髓间充质干细胞的增殖、分化等多种生物学行为[9],但对其相互作用规律及其机理,目前还缺乏系统的认识。本实验利用Transwell小室建立骨髓间充质干细胞与结肠癌细胞非接触共培养体系,以此系统模拟结肠癌微环境,来探讨结肠癌微环境对BMSCs生物学特性的影响。CD13又称为氨肽酶N,表达于肿瘤干细胞,在肿瘤细胞的生长、浸润和转移等过程中发挥重要作用[10];CD133是分子量为120 kD的糖蛋白,近年来,越来越多的证据表明,CD133可能是肿瘤干细胞表面的特异性分子,并且极有可能成为治疗肿瘤的一个有效的靶点[11]。
本实验研究表明,结肠癌细胞SW480和BMSCs共培养后,BMSCs细胞形态不一,体积增大,胞核也增大,并可见巨核、双核、多核、异型核等细胞,具备了恶性肿瘤细胞的形态特点。进一步研究表明,实验组BMSCs的CD13和CD133的阳性表达均高于对照组,同时实验组BMSCs的增殖能力也明显强于对照组,S期(增殖期)细胞比例明显高于对照组。提示肿瘤微环境可诱导BMSCs分化,发生恶性转化,其机制可能与引起增殖能力、细胞表面标记物及细胞形态等生物学特性的改变有关。
[1]Nakamizo A,Marini F,Amano T,et al.Human bonemarrow-derived mesenchymal stem cell in the treatment of gliomas[J].Cancer Res,2005,65(8):3307-3318.
[2]Maitra B,Szekely E,Gjini K,et al.Human mesenchymal stem cells support unrelated donor hematopoietic stem cells and suppress T-cellactivation[J].Bone Marrow Transplant,2004,33(6):597-604.
[3]Miura M,Miura Y,Padilla-Nash HM,et al.Accumulated chromosomal instability inmurine bonemarrow mesenchymal stem cells leads tomalignant transformation[J].Stem Cells,2006,24(4):1095-1103.
[4]Rosland GV,Svendsen A,Torsvik A,et al.Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation[J].Cancer Res,2009,69(13):5331-5339.
[5]Anderson DJ,Gage FH,Weissman IL.Can stem cells cross lineage boundaries[J].Nat Med,2001,7(4):393-395.
[6]Potten CS,Loeffler M.Stem cells:attriibutes,cycles,spirals,pitfalls and uncertainties.Lessonsfor and from the crypt[J].Development,1990,110(4):1001-1020.
[7]Rubio D,Garcia-Castro J,Martin MC,et al.Spontaneous human adult stem cell transformation[J].Cancer Res,2005,65(8):3035-3039.
[8]Miura M,MiuraY,Padilla-Nash HM,et al.Accumulated chromosomal instability in murine bone marrow mesenehymal stem cells leads to malignant transformation[J].Stem Cells,2006,24(4):1095-1103.
[9]Bergfeld SA,DeClerck YA.Bonemarrow-derivedmesenchymal stem cells and the tumor microenvironment[J].Cancer Metastasis Rev.2010,29(2):249-261.
[10]万丽娟,吴楠,尚丽新,等.CD13在宫颈癌中的表达及意义[J].现代妇产科进展,2012,21(8):626-628.
[11]叶萍,马丽君,范恒,等.CD133+结直肠肿瘤干细胞中ABC转运蛋白的表达[J].中国现代医学杂志,2011,21(17):1962-1966.
Influence of colon carcinoma m icroenvironment on cellmorphology,proliferation and expressions of CD13and CD133of bonemarrow mesenchymal stem cells
JINGMing1,2,CHEN Zheng-jun1,WANG Ya-li1,ZHANG Yan-xia1,2,LIU Xue-feng1
(1.Gansu College of Traditional Chinese Medicine,Lanzhou 730000,China;2.China Key Laboratory of Traditional Chinese Medicine Pharmacology and Toxicology of Gansu Province,Lanzhou 730000,China)
ObjectiveTo investigate the effect of Colon carcinomamicroenvironment on cellmorphology,proliferation and expressions of CD13and CD133of bonemarrow mesenchymal stem cells.MethodsControl group was bonemarrow derived stroma cells cultured in DMEM medium,experimentalgroup was(BMSCs)SW480 cells and bonemarrow derived stroma cell(BMSCs)co-cultured in transwell chamber.The cellmorphology of BMSCs was observed by microscope,and the generation of BMSCswere detected by MTTmethod.Cell cycle and expressions of CD13and CD133were analyzed by flow cytometry(FCM).ResultsCompared with control group,BMSCs in experimental group had the feature ofmalignant tumor cells,the generation speed significantly quicker and the percentage of Sphasewas significantlymore than control group,The expressions of CD13in experimental group(89.7%±9.5%)were significantly higher than control group(67.1%±8.1%)(P<0.01),and the expressions of CD133in experimental group(90.5%±6.4%)were significantly higher than control group(4.3%±1.2%)(P<0.01).ConclusionThese findings suggested that transwell chamber can help to achieve cocultivation of SW480 cells and BMSCs and inducemalignant transformation of BMSCs cell,themechanism could be related to the changes of bionomics such as cellmorphology,reproductive activity and cell surfacemarker.
Colon carcinomamicroenvironment;BMSCs;Cell cycle;CD13and CD133
R730.23
A
2095-5375(2014)09-0497-005
国家自然科学基金项目(No.81360522)
景明,男,教授,研究方向:中藏药新制剂研究,E-mail:jm@gszy.edu.cn
陈正君,男,研究方向:中藏药新制剂研究,Tel:0931-8765458,E-mail:547649265@qq.com

