海洋放线菌Y18的分子鉴定、生物活性及其抗菌物质发酵条件优化
苑孟 俞勇 李会荣 董宁 张晓华
(1中国海洋大学海洋生命学院,山东青岛266003;2国家海洋局极地科学重点实验室,中国极地研究中心,上海200136)
0 引言
放线菌是非常重要的生物活性物质来源,目前为止大约三分之二的天然抗生素分离自放线菌[1],且绝大多数来自于链霉菌属和小单孢菌属。近年来,人们在筛选活性物质的过程中,发现从陆地来源放线菌中获取新型天然活性物质的几率越来越小,于是,人们开始探索其他生境来源的放线菌,希望从中筛选出新型生物活性物质。海洋占地球表面积的70%以上,它的高盐、高压、寡营养的特点,使海洋放线菌进化出来与陆地放线菌所不同的代谢途径,可能产生大量的新颖的生物活性物质[2]。近年来,人们从海洋环境中分离出大量不同种类的放线菌[3],同时,也从这些海洋放线菌中发现了许多结构新颖的生物活性次级代谢产物[4-5]。北冰洋气候寒冷,水温大部分时间在0℃以下,环境十分恶劣,面对如此极端环境,放线菌必须产生与之相适应的生理生化特征及代谢途径。因而北冰洋的放线菌可能会产生结构新颖,生物活性特殊的生物活性物质。
菌株Y18是一株分离自北冰洋楚科奇海沉积物具有较高抗菌活性的稀有放线菌,其良好生长需要海水。本文对该菌株的分子鉴定、抗菌活性、活性物质发酵条件及其发酵产物的稳定性进行了初步研究,为Y18菌株的进一步开发利用提供了理论和实践基础。
1 材料和方法
1.1 材料
1.1.1 菌株来源
放线菌Y18分离自2010年中国第4次北极科学考察队采集于北冰洋楚科奇海的海洋沉积物(70°45.60′N,164°43.70′W;水深 26m)。
供试菌株:金黄葡萄球菌(Staphylococcus aureus),枯草芽孢杆菌(Bacillus subtilis),大肠杆菌(Escherichia coli),铜绿 假 单胞菌 (Pseudomonas aeruginosa)以及白色念珠菌(Candida albicans),由中国极地研究中心微生物实验室保存。
1.1.2 培养基
ISPⅡ培养基[6](用于 Y18的基本培养):酵母浸出粉4 g,麦芽浸出物10 g,葡萄糖4 g,琼脂15 g,无菌楚科奇海海水(天然海水,盐度3%)1 L,pH 7.0;
PM3培养基[7](用于 Y18的固体发酵):燕麦粉20 g,甘油 2.5 g,FeSO4·7H2O 0.1 mg,MnCl2·4H2O 0.1 mg,ZnSO4·7H2O 0.1 mg,琼脂 15 g,无菌天然海水1 L;
沙氏培养基(用于供试菌白色念珠菌的培养):蛋白胨 10 g,葡萄糖 40 g,琼脂 15 g,无菌水1 L,pH 5.6;
营养琼脂培养基(用于供试菌枯草芽孢杆菌、铜绿假单胞菌、大肠杆菌、金黄葡萄球菌的培养):牛肉膏 1 g,酵母膏 2 g,蛋白胨 5 g,NaCl 5 g,琼脂15 g,无菌水 1 L;
LB培养基(用于DH5α感受态培养):胰蛋白胨 10 g,酵母膏 5 g,NaCl 10 g,琼脂 15 g,无菌水1 L;
发酵培养基[7-11]:M1(大豆粉 20 g,蛋白胨 2 g,葡萄糖 20 g,淀粉 5 g,酵母膏 2 g,海水 1 L pH 7.5);M2(淀粉 10 g,蔗糖 10 g,黄豆粉 6 g,MgSO40.5 g,海水1 L);M3(蛋白胨 2 g,酪素水解物 2 g,酵母膏2 g,葡萄糖1 g,海水1 L);M4(蔗糖20 g,黄豆粉15 g,酵母膏 1.5 g,甘油 2 g,海水 1 L);M5(PM3液体)(燕麦粉20 g,甘油2.5 g,FeSO4·7H2O 0.1mg,MnCl2·4H2O 0.1mg,ZnSO4·7H2O 0.1mg,海水1 L)。
1.2 菌株分子鉴定
Y18基因组DNA的提取采用细菌基因组DNA抽提试剂盒(天根生化科技有限公司,北京)。用细菌 16SrDNA通用引物[12]27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R (5′-GGTTACCTTGTTACGACTT-3′)进行扩增。PCR反应体系为50μl:模板 DNA 2μl,10×buffer 5μl,BSA(1 mg/ml)4μl,dNTP(2.5mM)1μl,引物(10μM)各 1μl,Taq DNA聚合酶3.5U。扩增程序为6 min at 94℃预变性 6 min,94℃变性 45 s,55℃退火 45 s,72℃延伸1.5 min,共35个循环,最后72℃延伸8 min。取两次PCR后产物100μl用Genclean琼脂糖凝胶DNA回收试剂盒(上海捷瑞生物工程有限公司),进行16S rDNA的回收纯化,纯化后的DNA片段用TaKaRa(大连宝生物工程有限公司)的 pMD18-T Vector试剂盒进行连接,将连接产物转化进大肠杆菌DH5α感受态细胞(天根生化科技有限公司,北京),于含有100μg/ml氨苄青霉素的LB固体培养基上进行蓝白斑筛选。挑取白色菌落用T载体通用引物M13+、M13-进行菌落PCR,获得阳性克隆,送往上海美吉生物医药科技有限公司测序,并提交GenBank注册。将所测序列与GenBank数据库进行Blast相似性比较,选取与选定菌株亲缘关系较近的菌株用 Mega4软件[13]采用邻接法(neighbor-joining method)进行系统发育树的构建。
1.3 需海水及耐盐性试验
挑取Y18单菌落分别点种在ISPⅡ天然海水培养基、ISPⅡ人工海水培养基(3%的海盐,Sigma)、及含有0%、3%、6%、10%、15%NaCl的 ISPⅡ去离子水培养基的平板上,培养1—4周,观察菌落的生长情况。
1.4 抗菌活性研究
1.4.1 次级代谢产物合成酶基因的筛选
次级代谢产物合成酶基因的引物[14-17]:PKSⅠ:KSMA-F(5′-TSGCSATGGACCCSCAGCAG-3′),KSMBR(5′-CCSGTSCCGTGSGCCTCSAC-3′);PKSⅡ:540F(5′-GGITGCACSTCIGGIMTSGAC-3′),1100R(5′-CC-GATSGCICCSAGIGAGTG-3′);NRPS:A3F(5′-GCSTACSYSATSTACACSTCSGG-3′),A7R(5′-SASGTCVCCSGTSCGGTAS-3′);CYP:PEH-1(5′-TGGATCGGCGACGACCGSVYCGT-3′),PEH-2(5′-CCGWASAGSAYSCCGTCGTACTT-3′)。引物由上海英潍捷基生物技术有限公司合成。四种基因的PCR反应体系都为50μl,扩增条件分别按照文献7、文献15、文献16、文献17进行。取5μl PCR扩增产物用0.8%的琼脂糖凝胶电泳检测,电压为120 V。
1.4.2 抗菌活性检测
将Y18的单菌落接种于PM3固体培养基中,培养一周以上,将含有菌的直径8 mm的琼脂块转移到涂有100μl供试菌枯草芽孢杆菌、白色念珠菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的培养基上,28℃,16 h后观察抑菌圈。以不含菌的琼脂块作为对照。
1.5 Y18发酵条件的研究
挑取Y18单菌落接种于5 ml ISPⅡ天然海水培养基中,180 rpm,28℃条件下培养5天,按1%的接种量接到100 ml ISPⅡ海水培养基中,加入10颗左右玻璃珠,180 rpm,28℃条件下培养6天作为种子液进行后续试验。
对Y18抗菌物质发酵条件进行了初步研究,分别测定发酵培养基、发酵温度、发酵时间、种子液接种量、培养基的初始pH值、培养基的装液量对发酵液抗菌活性的影响,从而选择合适的发酵条件。采用牛津杯法通过测定抑菌圈大小来判断其对枯草芽孢杆菌的抗菌活性,以高温灭活的发酵液作为对照。每组试验设三个重复。
1.6 发酵液的稳定性试验
菌株Y18在优化后的条件下发酵,发酵液进行室温和低温贮藏稳定性、热稳定性和酸碱稳定性试验,每组实验设三个重复。
1.6.1 发酵液贮藏稳定性测试
取发酵液30 ml分成两份,分别放置在室温和4℃冰箱中保存,在保存的第1、3、5、7、15、30天使用牛津杯方法检测其抑菌活性,与初始的抑菌活性做比较。以高温失活的发酵液作为对照。
1.6.2 发酵液热稳定性测试
取发酵上清液分装到2 ml离心管中,每管1 ml,分别置于 50℃、60℃、70℃、80℃、100℃、121℃中处理30分钟,冷却到室温后,以未处理的发酵液做对照,采用牛津杯法检测其抗菌活性的变化。
1.6.3 发酵液酸碱稳定性测试
取发酵上清液分装到5 ml离心管中,每管3 ml,用 1 mol/L的 HCl或 1 mol/L的 NaOH溶液将pH分别调至 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,室温放置2小时后,将 pH调回初始 pH,以相同条件处理的高温失活发酵液和未处理的发酵液做对照,采用牛津杯法检测其抗菌活性的变化。
2 结果与分析
2.1 Y18菌株的分子鉴定
将菌株Y18的16S rDNA基因片段进行克隆测序后,获得1 491 bp的16S rDNA序列,提交Gen-Bank注册后,获得登录号 KF306354。将序列与GenBank数据库进行blast比对后,选取与Y18相近的模式菌株构建系统发育树(图1)。结果表明菌株Y18归属于拟诺卡氏菌属(Nocardiopsis),与模式菌株 Nocardiopsis dassonvillei subsp.dassonvillei DSM 43111T同属一个进化分支,其相似度高达99.8%,1 491个碱基中只有3个碱基的差异。因此,将该菌株暂命名为Nocardiopsis sp.Y18。
2.2 需海水及耐盐性
Y18在ISPⅡ海水培养基(SW)和ISPⅡ人工海水培养基(ASW)上生长良好;在含有0%和6%NaCl的培养基中可以生长,但生长速度较慢,且气生菌丝体与生长良好状态下相比不够发达。在10%、15%NaCl的ISPⅡ去离子水培养基的平板上不能生长。
2.3 生物活性研究结果
对Y18的次级代谢产物合成酶基因及抗菌活性筛选结果见表1。从结果可以看出Y18含有两种次级代谢产物合成酶基因:PKSⅡ和NRPS;可以抑制枯草芽孢杆菌和白色念珠菌的生长,其抑菌圈大小分别为:20mm和15 mm,这说明Y18具有较好的抗菌活性。
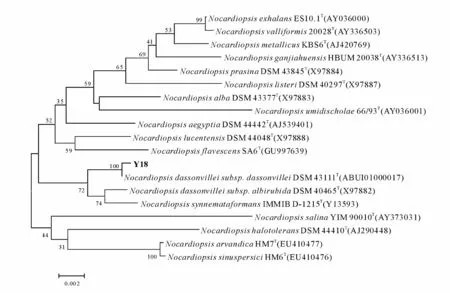
图1 根据16S rDNA基因序列构建的系统进化树Fig.1.Neighbor-joining tree based on 16S rDNA gene sequences showing bootstrap values(1 000 replications).Bar:0.02 substitutions per nucleotide position

表1 次级代谢产物合成基因和抗菌活性筛选Table 1.Biosynthetic genes and antimicrobial activities
2.4 Y18发酵条件研究结果
2.4.1 发酵培养基的选择结果
将Y18按1%的接种量接到选定的5种培养基中,28℃,180 rpm的条件下发酵6天,用牛津杯法检测各自的抑菌活性。M1、M2、M4、M5都没有检测出抑菌活性,M3号培养基的抑菌圈直径平均为18 mm,因此选用M3号培养基作为Y18的发酵培养基。
2.4.2 发酵时间及种子液接种量的确定
将种子液分别按1%、4%和8%的接种量接于100 ml发酵培养基中,每天同一时间检测抑菌活性(图2)。可以看出1%接种量的抗菌活性较低,4%和8%接种量都在第六天表现出了最大的抑菌活性,抑菌圈直径达到22.5 mm。第六天之后抗菌活性开始下降,因此将发酵天数定为6天。8%接种量虽然表现出抗菌活性的时间比较早,但第六天后其抑菌活性下降较快,因此将种子液的接种量定为4%。
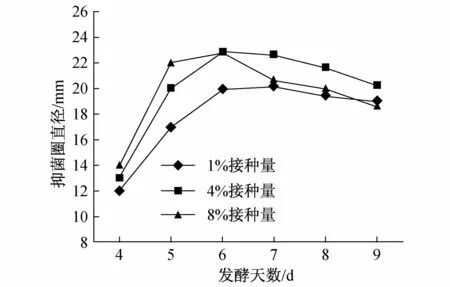
图2 不同接种量及不同发酵时间对发酵产物抑菌活性的影响Fig.2.Effect of inoculation dose and fermentation time on antibiotic activity
2.4.3 培养基装液量的确定
用1 000 ml的锥形瓶分别测定 20%、30%40%、50%装液量的抑菌活性,将种子液以4%的接种量接入发酵培养基中,28℃,180 rpm的条件下发酵6天。结果表明20%装液量的抑菌活性较好,抑菌圈直径平均为23 mm,30%装液量的抑菌圈直径平均为16 mm,40%的装液量抑菌效果较差,为13 mm,50%的装液量几乎没有抑菌效果,因此将1 000 m l锥形瓶的装液量定为20%。
2.4.4 发酵温度的确定
将种子液以4%的接种量接入发酵培养基中,分别置于15℃、28℃、37℃培养6天,发现当发酵温度为28℃时,抑菌效果最好,抑菌圈直径平均为21 mm;当发酵温度为15℃时,菌体生长缓慢,代谢产物量很少,没有观察到抑菌圈;当发酵温度为37℃时,抑菌效果比较差,抑菌圈直径仅为12 mm。因此确定发酵温度为28℃。
2.4.5 发酵培养基初始pH值的确定
分别将发酵培养基的初始pH值调至6.0、7.0、8.0和9.0,培养7天后检测其抑菌效果得到图3。可以看出初始pH在7—8之间时,发酵液的抑菌效果都比较好,当初始pH值为8.0时,效果最好,抑菌圈直径平均为20.5 mm。因此将初始pH值定为8.0。

图3 发酵液初始pH值对菌株抑菌活性的影响Fig.3.Effect of initial pH value on antibiotic activity
2.5 发酵液稳定性研究结果
2.5.1 发酵液贮藏稳定性
发酵液的随时间变化的抗菌活性如图4所示,可以看出发酵液在4℃中贮藏更有利于维持高的抗菌活性。在贮藏的第30天,4℃的活性仅下降了10%,而室温条件下贮藏活性下降了38%,因此该菌株产生的活性物质在低温储藏效果较好。
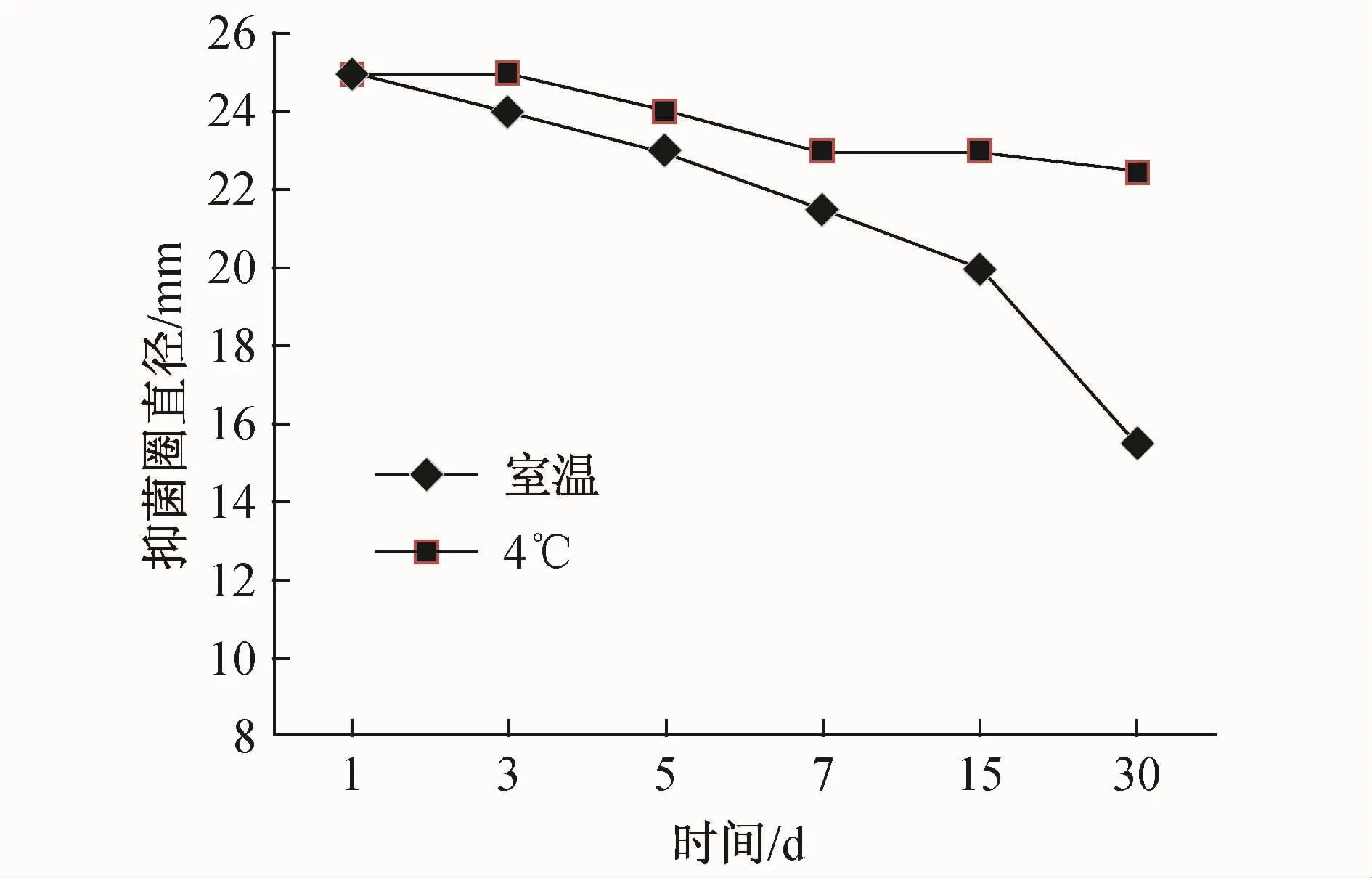
图4 不同贮藏条件对菌株抗菌活性的影响Fig.4.Effect of different storage conditions on antibiotic activity
2.5.2 发酵液酸碱稳定性
发酵液酸碱稳定性如图5所示,以相同pH条件处理的高温失活发酵液无抗菌活性。从图中可以看出发酵液在碱性条件下有较好的抑菌活性,在pH11的强碱环境下仍保持对照发酵液的94%的活性。在酸性条件下抑菌活性也较高,在pH3的强酸条件下其抑菌活性为对照的92%。因此可以看出Y18菌株发酵液有较宽的酸碱适合范围,在pH8—9条件下活性最好,随着pH升高或降低,其抑菌活性均有下降,所以在对Y18菌株处理时,尽量控制pH值,减少抑菌活性物质的损失。

图5 pH对抗菌活性的影响Fig.5.Stability of fermentation liquid against different pH
2.5.3 发酵液热稳定性
由图6可以看出Y18发酵液具有较高的热稳定性,在50℃中处理30 min,其抑菌活性没有变化;发酵液在80℃中处理30 min后,抑菌活性为对照的80%,下降了20%;在100℃和121℃处理30 min后,发酵液丧失了抗菌活性。该结果说明,发酵液在低于80℃时,热稳定性较好,但高于80℃热稳定性下降较快。

图6 温度对抑菌活性的影响Fig.6.Stability of fermentation liquid against different temperature
3 讨论
北冰洋气候寒冷,水温大部分时间在0℃以下,2/3的洋面常年被海冰覆盖,因此其海洋环境样品采集相对困难,涉及北冰洋海洋放线菌的研究工作也相对较少。近几年来随着对海洋及极端环境微生物的关注度的提升,研究工作取得了很大的进展。2007年Bredholt等[7]从挪威海特隆赫姆峡湾力道3 200多株海洋放线菌,除了链霉菌属和小单孢菌属外还有很多的稀有放线菌,且分离到的链霉菌中有80%的菌株具有抗菌活性。俞勇等[18]从楚科奇海和加拿大海盆分离到61株放线菌,其中的28株菌分别属于迪茨氏菌属、红球菌属等6个属。上述结果表明北冰洋放线菌物种多样性丰富,是微生物资源的重要新来源。同时,面对严酷的环境条件,放线菌必须进化出相应的生理、生化特征才能在其中生存。挪威海特隆赫姆峡湾海洋放线菌的研究证明了这一点。2010年,Jørgensen等从峡湾的450 m水深海底沉积物中分离到的一株链霉菌中分得一个大环内脂酰胺类化合物,该化合物对白色念珠菌、光滑念珠菌和藤黄微球菌都有抑制作用[19]。Engelhardt等从峡湾24.6 m水深的海洋沉积物来源的拟诺卡氏菌菌株中发现一个含硫多肽类化合物,可以抑制革兰氏阳性细菌的生长[20]。本文对一株来自北冰洋楚科奇海海洋沉积物的海洋放线菌Y18进行了一系列的研究,包括其分类鉴定、抗菌活性,并对其活性物质的发酵条件进行了优化,同时也研究了其发酵液的稳定性。
通过16S rDNA序列分析,发现与其亲缘关系最近的种为Nocardiopsis dassonvillei subsp.dassonvillei DSM 43111T,相似性高达99.8%。其NaCl耐受范围为0%—6%,对盐度的耐受范围比较广泛。该菌株可以在不含盐的培养基中生长,但其在海水培养基中生长得更好,因此,该菌株可能是由陆地进入海洋并已开始适应海洋环境。
海洋微生物次级代谢产物主要以聚酮类化合物和非核糖体肽类化合物为主,负责合成这两类化合物的酶分别属于多聚酮合酶(Polyketidesynthetase,PKS)和非核糖体肽合成酶(Non-ribosomal peptide synthetase,NRPS)[16]。聚酮类化合物又分为芳香环聚酮类化合物(四环素、阿霉素)和大环内酯类化合物(雷帕霉素、阿维霉素),分别由PKSⅡ和PKSⅠ途径合成。细胞色素P450羟化酶基因(CYP)可以合成多烯类物质,对真菌有抑制效果[21]。从基因筛选的结果看该菌株可能会产芳香环聚酮类化合物和非核糖体肽类化合物。抗菌活性筛选的结果为该菌株可以抑制枯草芽孢杆菌和白色念珠菌的生长,尤其对枯草芽孢杆菌有很好的抑制作用,因此有较高的研究价值。
本研究表明,适合Y18发酵产抗芽孢杆菌活性产物的培养基配方为:蛋白胨2 g,酪素水解物2 g,酵母膏2 g,葡萄糖1 g,海水1 L;发酵条件为:发酵培养基初始pH值8.0,种子液接种量4%,发酵温度28℃,发酵时间6天,1 000 mL三角瓶装液量20%。经优化后该菌株发酵液对枯草芽孢杆菌的抑菌圈直径从最初的18 mm上升到了25 mm,在发酵条件优化后抗菌活性大大提高,抑菌圈直径增加了38.9%。
对发酵液的稳定性研究表明,发酵液对温度具有较好的稳定性,对酸碱环境适应性较强,低温贮藏性较好。这为Y18菌株发酵液抗菌活性成分进一步分离纯化提供了理论依据,为该菌株进一步研究开发奠定了基础。
1 Kin S L.Discovery of novelmetabolites from marine actinomycete.Curr Opin Microbiol,2006,9:245—251.
2 方金瑞.海洋微生物:开发海洋药物的重要资源.中国海洋药物,1998,17(3):53—56.
3 Goodfellow M,Fiedler H P.A guide to successful bioprospecting:informed by actinobacterial systematic.Antonie van Leeuwenhoek,2010,98(2):119—142.
4 Olano C,Méndez C,Salas JA.Antitumor Compounds from Marine Actinomycetes.Mar Drugs,2009,7(2):210—248.
5 Rahman H,Austin B,MitchellW J,et al.Novel anti-infective compounds from marine bacteria.Mar Drugs,2010,8(3):498—518.
6 Shirling E B,Gottlieb D.Methods for characterization of Streptomyces species.Int JSystBacteriol,1996,16:317—327.
7 Bredholdt H,Galatenko O A,Engelhardt K,et al.Rare actinomycete bacteria from the shallow water sediments of the Trondheim fjord,Norway:isolation,diversity and biological activity.Environ Microbiol,2007,9(11):2756—2764.
8 杨晓军.拟诺卡氏菌次级代谢产物的研究.安徽农业科学,2011,39(13):7672—7673.
9 吴少杰,朱丽华,杨志娟.不同培养基对海洋放线菌抗微生物活性的影响.华北煤炭医学院学报,2006,8(5):600—602.
10 詹萍.产抗真菌活性物质海洋细菌的研究.广西大学:硕士学位论文,2006.
11 廖文彬,鲍时翔.红树林放线菌产抗菌活性物质的分离纯化研究.药物生物技术,2004,11(6):376—380.
12 Heuer H,Krsek M,Baker P,et al.Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients.Appl Environ Microbiol,1997,63:3233—3241.
13 Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4.0.Mol Biol Evolut,2007,24:1596—1599.
14 Izumikawa M,Murata M,Tachibana K,etal.Cloning ofmodular type Ipolyketide synthase genes from salinomycin producing strain of Streptomyces albus.Bioorg Med Chem,2003,11:3401—3405.
15 Wawrik B,Kerkhof L,Zylstra G J,et al.Identification of unique type II polyketide synthase genes in soil.Appl Environ Microbiol,2005,71:2232—2238.
16 Ayuso-Sacido A,Genilloud O.New PCR primers for the screening of NRPSand PKS-Isystems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups.Microb Ecol,2005,49:10—24.
17 Lee M Y,Myeong JS,Park H J,et al.Isolation and partial characterization of a cryptic polyene gene cluster in Pseudonocardia autotrophica.JInd Microbiol Biotechnol,2006,33:84—87.
18 Yu Y,Li H R,Zeng Y X,et al.Isolation and phylogenetic assignation of actinomycetes in the marine sediments from the Arctic Ocean.Acta Oceanologica Sinica,2005,24(6):135—142.
19 Jørgensen H,Degnes K F,Dikiy A,et al.Insights into the evolution ofmacrolactam through cloning and comparative analysis of the biosynthetic gene cluster for a novelmacrocyclic lactam,ML-449.Appl Environ Microbiol,2010,76(1):283—293.
20 Engelhardt K,Degnes K F,Kemmler M,et al.Production of a new thiopeptide antibiotic,TP-1161,by amarine Nocardiopsis species.Appl Environ Microbiol,2010,76(15):4969—4976.
21 曹艳茹,姜怡,陈义光,等.武陵山放线菌多样性.微生物学报,2008,48(7):952—958.

