金黄色葡萄球菌基因组DNA提取方法的优化
张涛涛,王兰,*,龚频,陈福欣
(1.陕西科技大学生命与工程学院,陕西西安710021;2.西安科技大学化学与化工学院,陕西西安710054)
金黄色葡萄球菌基因组DNA提取方法的优化
张涛涛1,王兰1,*,龚频1,陈福欣2
(1.陕西科技大学生命与工程学院,陕西西安710021;2.西安科技大学化学与化工学院,陕西西安710054)
实验分别采用CTAB法、碱法、改良型碱法、改良型SDS法等提取金黄色葡萄球菌基因组DNA,比较其提取质量,对金黄色葡萄球菌总DNA提取方法进行优化,以便高效、节约的应用于聚合酶链式反应(PCR)等分子生物学研究。结果表明:改良型SDS法稳定性好,能够有效破壁,DNA的质量高,A260/A280为1.76,介于1.75~1.85之间。提取所需时间较少,仅需40min,有利于金黄色葡萄球菌总DNA高效、快捷的提取。
金黄色葡萄球菌;基因组DNA提取;改良型SDS
金黄色葡萄球菌是食品中三大致病菌之一,在自然界中分布广泛,其毒力因子为葡萄球菌肠毒素SE和侵袭性酶等,在条件适宜时,即可在很短的时间内产生肠毒素[1],因此,快速、准确、简便地检测金黄色葡萄球菌,对食品安全质量控制及食品链中致病性细菌的溯源追踪具有重要作用。目前,分子生物学检测技术因其高灵敏度、高特异性及操作简单、迅速等特点,被广泛的应用于食源性致病菌检测的研究及开发,而DNA的提取质量直接关系到PCR及其他分子生物学实验的结果,进而影响其灵敏性,特异性,检测限等,因此,亟需建立一种高效、快速的金黄色葡萄球菌基因组DNA提取方法。
金黄色葡萄球菌为革兰氏阳性菌,具有较厚的细胞壁,而且90%的金黄色葡萄球菌细胞表面都含有蛋白A,并与细胞壁中的肽聚糖结合成致密的共价交联结构,增加了提取该基因组DNA的难度。传统的提取该基因组DNA方法有免疫磁珠法[2]、CTAB法[3]、SDS法[4]以及常用碱法[5],但是以上方法具有破壁不彻底、提取量少、纯度不高等缺点,不利于分子生物学进一步研究,从而不能满足金黄色葡萄球菌快速检测的需求。因此,本实验通过比较4种不同的DNA提取方法,优化了金黄色葡萄球菌DNA的提取方法,最终确立改良型SDS法是一种较为理想的金黄色葡萄球菌DNA的提取方法,为该菌的进一步分子生物学检测提供便利。
1 材料与方法
1.1 菌种来源
金黄色葡萄球菌(由陕西科技大学环境化学与生态毒理学国家重点实验室保存)。
1.2 主要试剂
营养琼脂、酵母膏、牛肉膏等(北京奥博星生物技术有限公司);Tris-base(SIGMA);乙二胺四乙酸钠(天津市巴斯夫化工有限公司);SDS(天津福晨化学试剂厂);蛋白酶K、RnaseE、溶菌酶、CTAB(生工生物有限公司);异丙醇(天津天力化工试剂有限公司)。
溶液1:TrisHCl(pH8.0)25mmol/L;EDTA(pH8.0)10mmol/L;葡萄糖50mmol/L;溶菌酶(现加)5mg/mL。
溶液2:(现用现配)NaOH0.2mol/L;SDS10%(w/v)。
溶液3:25mmol/LKAc 60mL;冰醋酸11.5mL;超纯水28.5mL。
1.3 试验仪器
微量移液器(eppendorf);TGL-16G高速离心机:上海安亭科学仪器厂;DDC-10C型水平电泳仪器:北京君意东方电泳设备有限公司;UV9100-AC220V紫外分光光度计:北京瑞丽分析仪器有限公司;YXQSG46-280S灭菌锅:上海博讯实业有限公司。
1.4 菌种培养法及其菌种鉴定
将金黄色葡萄球菌经过斜面活化、平皿划线分离培养,然后接种于5mL的营养肉汤培养基中,37℃培养过夜。取出培养液,并对其进行革兰氏染色检验,若其为紫色,则证明其为革兰氏阳性细菌。
1.5 基因组DNA提取法
取上述培养得到的菌液1.5mL于eppendorf管中,4℃、12 000 r/min离心2min,弃上清,得到菌体细胞,然后用200μLTE悬浮一管中的沉淀,并将其吸入第二管中。(将两管中的沉淀合并为一管,并尽量的小心吹打,使细菌悬浮,溶液变浑浊。)对该细胞悬浮液分别利用以下几种方法进行DNA提取。
方法1:CTAB法[6]。取上述4℃离心后得到的菌体细胞,进行液氮研磨,依次加入10%SDS 30μL、高盐缓冲液(Tris-Cl 50 mmol/L,pH8.0;EDTA10 mmol/L;NaCl0.7mol/L;CTAB1.5%)150μL,80μLCTAB/NaCl,并分装到1.5mL的eppendorf管中,60℃水浴40min;加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),轻轻混匀,4℃、12 000 r/min离心5min;取上清液,加入400μL异丙醇,混匀,4℃、12 000 r/min离心5min;弃上清,加入70%的乙醇洗涤沉淀,自然晾干后,用30μL~50μL含有胰RNA酶(20mg/mL)的TE溶解DNA,-20℃冷冻保存备用。
方法2:碱法1[5]。取200μL菌悬液,加入100μL溶液1,剧烈振荡;加入200μL溶液2,颠倒混匀,冰上静置5min;加150μL的溶液3,颠倒混匀,冰上静置5min;12 000 r/min离心5min,取上清液;加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),混匀,5 000 r/min离心10min,取上清;加入2倍体积的无水乙醇,室温静置2min,10 000 r/min离心5min,弃上清;取1mL 70%的乙醇洗涤沉淀,自然晾干后,加入50μL含有胰RNA酶(20mg/mL)的TE,-20℃冷冻保存备用。
方法3:改良碱法1。取200μL菌悬液,加入200μL溶液1混匀;加入300μL新配制的溶液2,静置5 min;加入300μL预冷的溶液3,上下颠倒5次,混匀,充分混匀后,出现白色絮状沉淀,冰上放置5min;5 000 r/min离心10min,吸上清;加入等体积的氯仿,混匀后,12 000 r/min离心10min;弃上清,加入0.7倍体积的异丙醇,混匀,12 000 r/min离心10min;弃上清,用70%的乙醇洗涤沉淀,自然晾干后,加入50μL含有胰RNA酶(20mg/mL)的TE,-20℃冷冻保存备用。
方法4:对传统的SDS法[7]进行改良。取200μL菌悬液,加入40μL溶菌酶(20mg/mL);加30μL 10%的SDS,10μL蛋白酶K(浓度为20mg/mL),混匀,37℃保温30min;加入250μL 5mol/LNaCl,混匀;取等体积的酚∶氯仿∶异戊醇(25∶24∶1)抽提,静置,5 000 r/min离心10min,移上清液至新离心管;用等体积的氯仿∶异戊醇(24∶1)再次抽提,5 000 r/min离心5min,移上清液至新离心管;加2倍体积的无水乙醇或0.6倍体积的异丙醇,颠倒混匀,室温下静置5min,离心取沉淀;用70%的乙醇洗涤沉淀后,自然晾干,用30μL~50μL含有胰RNA酶(20 mg/mL)的TE溶解DNA,-20℃冷冻保存备用。
1.6 金黄色葡萄球菌DNA提取及质量评定
分别将菌液进行浓度梯度稀释,并利用上述方法分别进行DNA提取,所提取的菌液量均相同,对提取产物测定其A260、A280,然后进行2%琼脂糖凝胶电泳检测,确定其提取效果。
2 结果
不同方法提取金黄色葡萄球菌DNA质量比较结果见表1。
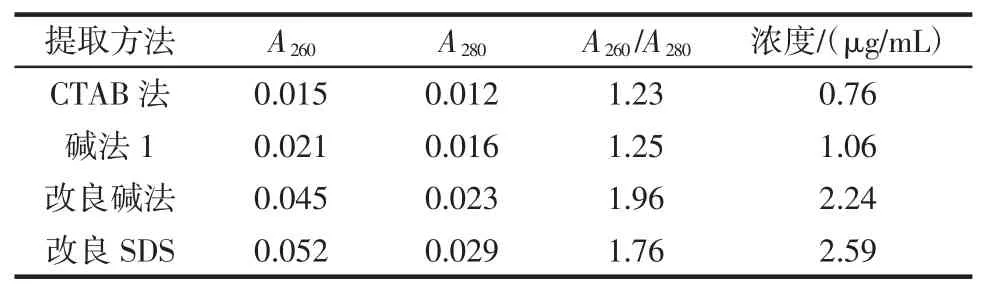
表1 不同方法提取金黄色葡萄球菌DNA质量比较Table1 The quality by different extraction methods of Staphylococcus aureus DNA
通过不同方法多次平行实验表明,改良型SDS法与两种碱法提取时间较短,仅用40min,CTAB法提取时间最长;改良型SDS法的A260/A280在1.75~1.85之间,两种碱法所提取的DNA均含有较多的杂质,而CTAB法A260/A280最小,说明其中含有大量的蛋白质。同时,不同方法提取DNA的电泳图见图1,通过比较可知改良型SDS法所得到的DNA所对应的条带最清晰,表明其提取效率高,纯度较好。综合各因素得知改良型SDS法是最佳方法。
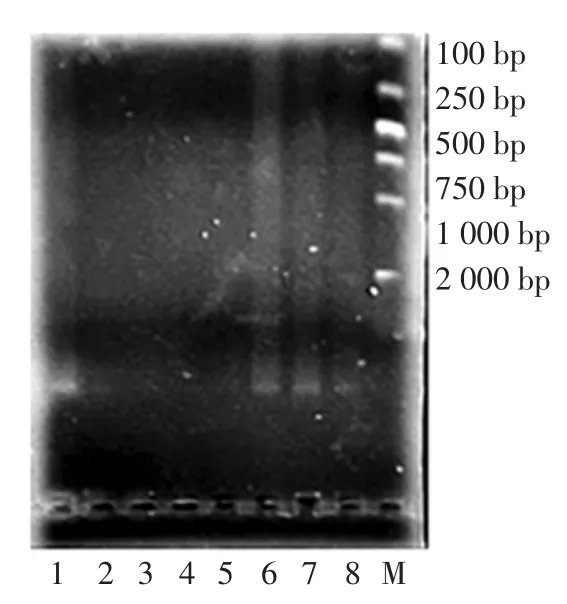
图1 不同方法提取金黄色葡萄球菌基因组DNA电泳图Fig.1 Agarose gel electrophoresis of total DNA from Staphylococcus Aures using different methods
2.2 应用改良型SDS法提取金黄色葡萄球菌基因组DNA
电泳结果见图2。

图2 改良型SDS法提取金黄色葡萄球菌基因组DNA电泳图Fig.2 Agarose gel electrophoresis of total DNA from Staphylococcus Aures using modified SDS method
3 讨论
分子生物学检测技术因其具有高度的特异性、灵敏度,已经被广泛应用于食品中致病菌的检测,但是致病菌的DNA提取速率及质量严重影响着PCR等分子生物学检测结果,进而影响到检测的灵敏度及准确性。金黄色葡萄球菌由于其具有很厚的细胞壁,因此,诸多传统的DNA提取方法受到限制,提取效率都比较低,且纯度较差。为此,针对不同的提取方法进行了比较研究及优化,最终筛选出适合金黄色葡萄球菌等革兰氏阳性菌的DNA提取方法。
SDS法是一种较为常用的DNA提取法,其中的SDS可以溶解细胞膜上的脂质和蛋白,从而破坏细胞膜,便于DNA的释放。唐俊妮等[8]用SDS法结合CTAB法提取金葡菌中的DNA,获得较好的DNA提取效果。在本实验中,采用了溶菌酶、SDS及蛋白酶K,依次加入反应体系,由于SDS不仅可以破坏细胞膜,而且可以促进溶菌酶溶液的乳化作用[9],两者结合,进一步促进了细胞的裂解,从而优化了DNA的提取步骤。两种碱法虽然均可以提取该菌的基因组DNA,且时间也为40min左右,但其提取的DNA中含有蛋白质、RNA等杂质。CTAB法不能有效破壁,提取效果不佳。实验结果表明:改良型SDS法提取金黄色葡萄球菌总DNA比传统的一系列方法(碱法、CTAB法等)耗时短,提取效果好,为其它革兰氏阳性菌总DNA的提取提供参考。
[1]高涛.食品中金黄色葡萄球菌肠毒素及检测方法的研究进展[J].福建分析测试,2003,12(2):1775-1778
[2]冯飞,梁景龙.不同方法对金黄色葡萄球菌基因组DNA提取方法的比较[J].广东农业科学,2010(10):153-155
[3]郭新梅,康冀川.CTAB法在金黄色葡萄球菌DNA提取中的应用[J].山地农业生物学报,2005,24(6):558-560
[4]杨洋,张伟,袁耀武.用PCR法检测乳中的金黄色葡萄球菌DNA提取方法比较[J].食品与发酵工业,2005,31(9):91-95
[5]张维铭.分子生物学实验手册[M].2版.北京:科学出版社,2007: 83-85
[6]徐义刚,李苏龙,谢小刚,等.食源性致病菌基因组DNA高效提取方法[J].东北林业大学学报,2009,37(2):73-78
[7]A Ramesh,B P P admapriya,A Chandrasekhar,et al.Application of a convenient DNA extraction method and multiplex PCR for the direct detection of Staphylococcus aureus and Yersinia enterocolitica in milk samples[J].Molecular and Cellular Probes,2002,16(2):307-314
[8]唐俊妮,龙飞,史贤明,等.金黄色葡萄球菌DNA提取方法的研究[J].中国卫生检验杂志,2008,18(8):1467-1469
[9]杨为进,许振华.SDS对溶菌酶溶液乳化作用的研究[J].化工冶金, 1996,17(3):254-258
Optimization of Genomic DNA Extraction Method of Staphylococcus aures
ZHANG Tao-tao1,WANG Lan1,*,GONG Pin1,CHEN Fu-xin2
(1.College of Life Science and Technology,Shaanxi University of Science and Technology,Xi'an 710021,Shaanxi,China;2.School of Chemistry and Chemical Engineering,Xi'an University of Science and Technology,Xi'an 710054,Shaanxi,China)
In this research,traditional methods,including CTAB method,alkaline method,modified alkaline method,and modified SDS method were applied to extract genomic DNA from Staphylococcus aures,also,the yield and quality of DNA were compared in order to establish an effective and economical method for total DNA extraction of Staphylococcus aure.Results showed Modified SDS method is an effective and economical method for DNA extraction of Staphylococcus aure,and can prompt cell lysis,reducing the time needed to only 40min. The yields of DNA extraction is improved,and A260/A280was1.76,which is between 1.75-1.85.
Staphylococcus aures;genome DNA;lysozyme
10.3969/j.issn.1005-6521.2014.03.003
2013-03-20
陕西省自然科学基金(No.2012JQ2011);陕西省教育厅自然科学基金(No.12JK0712,12JK0623);西安市未央区项目(No. 201112,201209)
张涛涛(1984—),女(汉),硕士研究生,主要从事食品安全检测。
*通信作者:王兰(1963—),女,教授,主要从事食品安全检测研究。

