红皮云杉球果原花青素提取优化及抗氧化活性评价
郑洪亮,何 飞,腾 飞,王 萍,王振宇,2,*,马思慧
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150086)
近年来,人们对自身健康越来越关注,掀起了天然产物开发热潮。尤其是具有强抗氧化活性的植物源原花青素,来源丰富,广泛分布于植物界,有多样的生理功效。据有关文献记载,葡萄籽中提取的原花青素具有抗肿瘤、抗氧化、抗动脉硬化、防治冠心病与中风等心脑血管疾病以及抗菌等作用[1]。以苹果、茶、葡萄、柑橘等为原料已经成功开发出原花青素[2],原花青素的独特化学结构与其独特化学性质密切相关,在食品、医药、化妆品等许多行业已经开发利用[3]。
红皮云杉是常绿乔木,松科云杉属,学名Picea koraiensis Nakai,在吉林山区海拔1400~1800m地带、东北小兴安岭地区分布比较丰富,球果呈卵状圆柱形或圆柱状矩圆形,是我国重要的生物资源。近年来,对松科植物原花青素的提取国内外研究不多。Duncan[4]以松树皮为原料,在脱氧热水中浸提(1min~20h)得到原花青素粗提物;黄启亮等[5]以松针为原料提取原花青素,并对其主要生物活性进行研究;李童等[6]以云南思茅松树皮为原料,研究思茅松原花青素的降度提取工艺。秦永剑等[7-8]研究了云南松多聚原花青素降解产物抗氧化活性和低聚原花青素抗氧化活性。
本研究考察了温度、料液比、溶剂浓度和提取时间对原花青素得率的影响,再通过响应曲面实验,确定提取最优条件。利用D4020大孔树脂对红皮云杉原花青素粗提物进行纯化,然后对红皮云杉原花青素精制物进行抗氧化活性评价实验,较系统的分析了原花青素的提取优化工艺及抗氧化能力。
1 材料与方法
1.1 材料与仪器
红皮云杉球果 黑龙江省苇河林业局提供,采集时间为2011年9月,将球果鳞片(去掉中间木质轴)低温干燥后粉碎过80目筛后-20℃密封冷冻,备用;1,1-二苯基苦基苯肼(DPPH)、ABTS、5,6-联苯基-3-(2-吡啶基)-1,2,4-三吖嗪(Ferrozine)、维生素E 美国Sigma公司;儿茶素 色谱级,上海源叶公司;FRAP试剂盒 碧云天试剂公司;抗坏血酸、浓硫酸、甲醇、硫酸亚铁、30%过氧化氢、三氯乙酸(TCA)、浓盐酸、磷酸二氢钠、磷酸氢二钠、柠檬酸、硫酸亚铁、氯化亚铁、无水乙醇 国产分析纯;蒸馏水。
RT-6000酶标仪 深圳雷社生命科技股份有限公司;TDL-5台式离心机 上海科兴仪器有限公司;T6紫外可见分光光度计 北京普析通用公司;旋转R-205B蒸发仪 上海申胜仪器公司;NDJ-1电热恒温水浴锅 北京医疗电子仪器厂;FJ-200高速万能粉碎机 天津泰斯特仪器公司;DHG-9240电热恒温鼓风干燥箱 上海一恒科技有限公司;YP200lN电子天平 上海精天电子仪器厂;XW-80A漩涡混合器 江苏海门市其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 儿茶素标准曲线的建立 采用香草醛-硫酸法[9]。
配制儿茶素不同浓度标准溶液:0.03、0.06、0.09、0.12、0.15、0.18、0.21、0.24、0.27、0.30mg/mL。精确移取1.0mL分别置于10支10mL相同规格试管中,然后分别加入2.5mL、4%香草醛-甲醇溶液和2.5mL、30%浓硫酸-甲醇溶液,混合均匀,于30℃水浴中避光静置15min,以甲醇代替显色剂为空白对照,在500nm波长下测定溶液吸光值,平行测样三次。以标准溶液浓度为横坐标,吸光值为纵坐标,建立标准曲线并拟合回归方程。根据方程计算提取物中花青素浓度,然后根据样品质量进一步换算成得率。
1.2.2 红皮云杉球果原花青素提取优化实验
1.2.2.1 单因素实验设计
a.乙醇浓度对提取效果的影响:固定提取时间4h,料液比1∶20(g/mL),提取温度为60℃,分别以乙醇浓度0%、20%、40%、60%、80%、100%提取,并计算原花青素得率。
b.提取温度对提取效果的影响:固定提取时间4h,乙醇体积分数为60%,料液比1∶20(g/mL),分别以提取温度30、40、50、60、70、80℃提取,并计算原花青素得率。
c.料液比对提取效果的影响:固定提取时间4h,提取温度50℃,乙醇体积分数60%,分别以料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)提取,并计算原花青素得率。
d.提取时间对提取效果的影响:固定提取温度50℃,料液比1∶40(g/mL),乙醇体积分数为60%,分别以提取时间1、2、3、4、5、6h提取,并计算原花青素得率。
1.2.2.2 响应面实验设计 在单因素实验基础上,以料液比(X1)、提取时间(X2)、提取温度(X3)、乙醇浓度(X4)4个因素为自变量,以原花青素得率为响应值,设计四因素三水平的响应曲面实验见表1,原花青素得率公式如下。
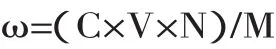
式中,ω为原花青素得率(mg/g);C为原花青素的质量浓度(mg/mL);V为提取液体积(mL);N为稀释倍数;M为样品质量(g)。

表1 红皮云杉球果原花青素提取响应面实验因素水平及编码Table 1 Coded values and corresponding actual values of factors in BBD design
1.2.3 红皮云杉球果原花青素粗提物的纯化[10]原花青素提取物2.5mg/mL,作为上样液。在处理好的D4020型大孔吸附树脂柱加入上样液,径高比1∶25,以2.0BV/h的流速上样,吸附4h,将大孔树脂柱用蒸馏水洗至流出液呈无色后,用70%、4BV的乙醇对大孔树脂吸附柱洗脱,洗脱流速1.5BV/h,将70%乙醇洗脱液收集,减压浓缩至无醇味后,备用。
1.2.4 原花青素的抗氧化能力评价
1.2.4.1 DPPH·清除作用 红皮云杉球果原花青素提取物精制后,配制成浓度为10、20、30、40、50、60、70、80、90μg/mL的溶液。分别在10.0mL试管中加入2.0mL上述不同浓度样品溶液,之后加入2.0mL 1×10-3mol/L DPPH·溶液(用95%乙醇配制),混合均匀,暗处反应30min,在517nm处测定其吸光值,用2.0mL无水乙醇替代2.0mL样品液作参比,测定吸光值A,同时以乙醇溶液为参比测定DPPH空白溶液吸光度值A0,用Trolox作阳性对照,同时做平行实验[11]。计算DPPH·清除率RSA:
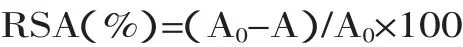
以清除率RSA对样品浓度进行回归处理,计算提取物的半数抑制浓度(IC50)数值。
1.2.4.2 ABTS+·清除作用 在96孔板的样品检测孔和对照孔中依次加入45μL不同浓度的样液;空白对照孔中加入45μL PBS缓冲液;然后检测孔和空白孔中依次加入300μL ABTS+·自由基工作液,对照空中加入等量的PBS缓冲液,避光反应6min,于734nm波长下测吸光值[12]。
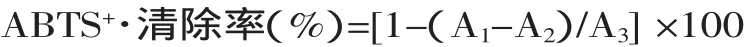
其中:A1为加测定溶液后ABTS+·的吸光值;A2为测定溶液在测定波长下的吸光值;A3为未加测定溶液时ABTS+·的吸光值。
1.2.4.3 总抗氧化能力的测定 采用FRAP法[13]。
a.FeSO4标准曲线的准备:称取27.8mg FRAP试剂盒提供的FeSO4·7H2O,溶解并定容到1mL,此时浓度即为100mmol/L。取适量100mmol/L FeSO4溶液稀释至0、100、200、300、400、500μg/L。可以使用蒸馏水或样品配制溶液配制标准品。FeSO4溶液宜新鲜配制使用。
b.总抗氧化能力的测定:96孔板的检测孔中加入180μL FRAP工作液(现用现配)。空白对照孔中加入40μL蒸馏水;样品检测孔内加入40μL各种浓度的样品或Trolox作为阳性对照,轻轻混匀。37℃孵育3~ 5min后测定A593。根据标准曲线计算出样品的总抗氧化能力[13]。
2 结果与分析
2.1 原花青素含量标准曲线的绘制
原花青素质量浓度与吸光度曲线的回归方程如图1所示。回归方程y=2.1658x+0.0178,R2≈0.9995,式中:y—溶液在500nm处的吸光度;x—溶液中的原花青素质量浓度(mg/mL)。
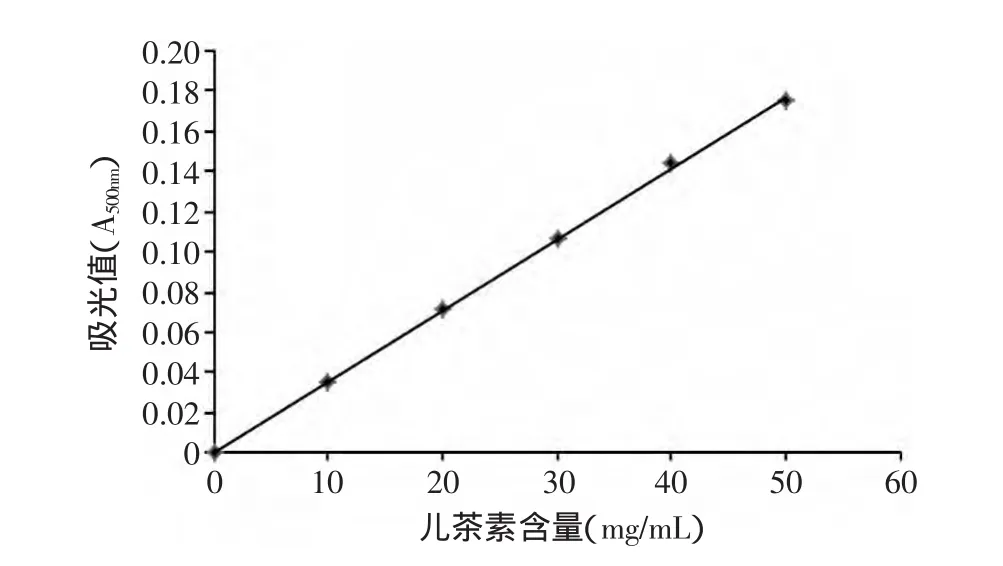
图1 儿茶素标准曲线Fig.1 Catechin standard curve
2.2 红皮云杉球果原花青素提取单因素实验
2.2.1 乙醇浓度对提取效果的影响 乙醇浓度对原花青素提取效果的影响如图2所示。

图2 乙醇浓度对原花青素提取得率的影响Fig.2 Effect of different ethanol concentrations on extraction rate
浓度小于60%时,随着乙醇浓度增大,溶剂中原花青素含量也增加;大于60%时,随着乙醇浓度增大,溶剂中原花青素含量有所降低,可能是由于乙醇浓度继续增加会加大醇溶性杂质、色素、亲脂性等成分的溶出,这些成分与原花青素竞争,同乙醇水分子结合,同时组织的通透性下降,从而导致原花青素的溶解度下降[14],因此乙醇浓度选为60%。
2.2.2 提取温度对提取效果的影响 温度对原花青素提取效果的影响如图3所示。
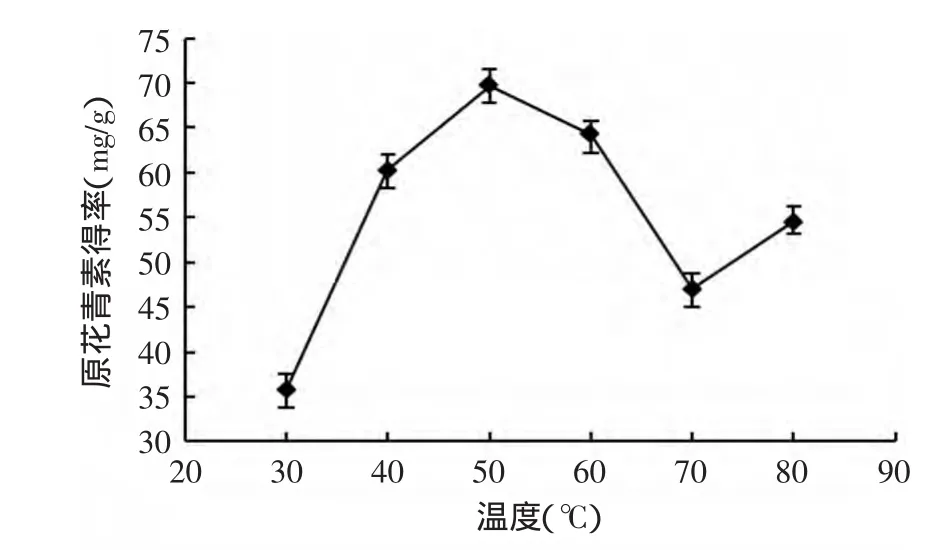
图3 提取温度对原花青素提取得率的影响Fig.3 Effect of different temperature on extraction rate
温度升高,分子热运动加快,有利于传质过程的进行。小于50℃时,随着温度增加,红皮云杉原花青素大量溶出,从而溶剂中其含量增加;温度超过50℃而小于70℃时,原花青素的含量开始下降,是由于温度升高导致原花青素开始降解,其结构发生变化[15];当温度超过70℃时,原花青素溶解量又开始略有增加,是因为可能与较高温度下,其他杂质物质大量溶出有关[16],故50℃为原花青素最佳提取温度。
2.2.3 料液比对提取效果的影响 料液比对原花青素提取效果的影响图4所示。
由图4可知料液比对得率影响较大。当料液比大于1∶10(g/mL)时,随着料液比增加,原花青素得率明显增加,这是因为有机溶剂能抑制原花青素与植物中的蛋白、多糖等物质结合,增加料液比有利于原花青素更大限度的浸出[17],但料液比继续增大又会增加原花青素与空气接触的机会,而原花青素容易氧化降解,所以得率有所降低,同时料液比增加还会造成原料的浪费[18],因此选择料液比为1∶40(g/mL)。
2.2.4 提取时间对提取效果的影响 提取时间对原花青素提取效果的影响如图5所示。
在提取时间低于2h时,原花青素浓度随时间增长而增大,溶剂中原花青素浓度低,红皮云杉球果粉末原花青素含量高,两个体系有高浓度差,传质动力大,原花青素浸出速率快[19]。2h后,原花青素浓度随时间变化的得率减小,是由于随着时间的进一步延长,可能是由于原花青素对热敏感,时间过长会造成其被氧化变性,考虑到缩短工艺时间,提高效率,最佳提取时间为2h。
2.3 红皮云杉球果原花青素提取响应面优化实验
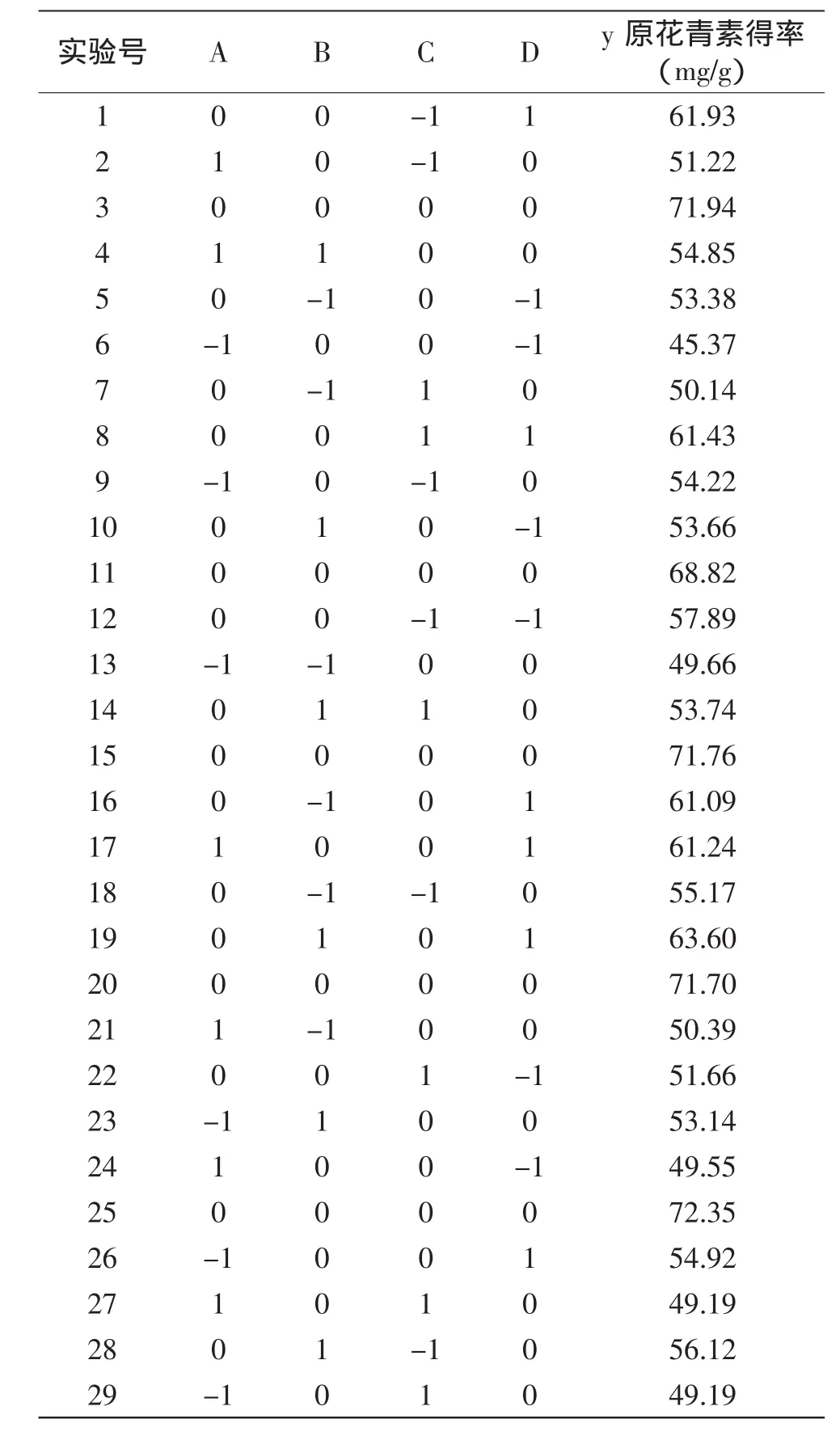
表2 响应面分析及结果Table 2 Experiment design and results of response surface method
2.3.1 响应曲面法实验设计及结果 在单因素实验基础上,设计了乙醇浓度、温度、时间、料液比的4因素3水平响应面法实验设计,其因素水平见表1,所得实验结果见表2。
选用中心复合模型,做四因素三水平共29个实验点(5个中心点)的响应面分析实验。这29个实验点分为两类:其一是析因点,自变量取值在各因素所构成的三维顶点,共有24个析因点;其二是零点,为区域的中心点,零点实验重复5次,用以估计实验误差。红皮云杉球果原花青素提取率为响应值(指标值)。使用响应曲面法分析软件对表2中原花青素得率大小的数据进行处理,分析后得出的回归方程为:y= 142.63+1.65A+2.55B-3.53C+8.79D+0.49AB+1.50AC+ 1.07AD+1.33BC+1.12BD+2.86CD-24.14A2-16.14B2-16.90C2-10.95D2。
采用响应面法软件对实验结果进行方差分析,其结果见表3。
模型误差p<0.0001,显著;失拟项p=0.2120>0.05,差异不显著,说明了方程对实验拟合的情况好,实验误差小;变异系数值为3.47,说明了实验可靠;模型的校正系数R2adj=0.9366,说明该模型能解释93.66%响应值的变化,仅有总变异大约6%不能用此模型来解释。
时间、料液比的一次项,乙醇浓度、温度、时间、料液比的二次项对得率的影响极显著;温度的一次项影响为显著;乙醇浓度及4因子的交互的影响不显著。通过F值还能看出,实验中各因素对原花青素得率的影响大小顺序为:料液比<时间<温度<乙醇浓度。此回归模型得出BBD实验的最优提取条件为:乙醇浓度为60.42%,温度50.91℃、时间1.97h、料液比为1∶44(g/mL),此时原花青素得率为72.46mg/g。
2.3.2 响应面结果验证实验 为检验响应面法优化红皮云杉球果原花青素提取工艺的可靠性,采用优化后提取工艺条件进行验证实验,参考实际操作,将优化后工艺参数调整为:乙醇浓度为60%,温度51℃、时间2h、料液比为1∶44(g/mL),在此最佳条件下,提取红皮云杉球果原花青素得率为(71.23±0.25)mg/g,与模型预测值的比较误差为1.70%。
2.4 红皮云杉球果原花青素精制物的制备
红皮云杉球果原花青素经D4020的纯化,纯化前原花青素纯度为29.45%±1.33%,纯化后纯度为68.57% ±1.78%,回收率为88.27%±3.18%。
2.5 红皮云杉球果原花青素精制物的抗氧化评价
2.5.1 红皮云杉球果原花青素精制物对DPPH·的清除作用 如图6所示,红皮云杉球果原花青素精制物对DPPH·自由基具有显著的清除作用。以Trolox做阳性对照,在90μg/mL时清除率分别为90.7%±2.07%和69.58%±1.56%。红皮云杉球果原花青素精制物和Trolox在实验浓度的IC50值分别为(41.04±1.12)μg/mL、(16.62±0.98)μg/mL。从总体上看,红皮云杉球果原花青素精制物清除DPPH·自由基能力较强,但低于Trolox。
2.5.2 红皮云杉球果原花青素精制物对ABTS+·的清除作用 如图7所示,不同浓度红皮云杉球果原花青素精制物对ABTS+·自由基均具有很显著的清除作用。以Trolox做阳性对照,在相同浓度条件下,阳性对照Trolox的清除率均超过红皮云杉球果原花青素精制物。红皮云杉球果原花青素精制物和Trolox在实验浓度的IC50值分别为(20.45±1.08)μg/mL、(32.94± 0.65)μg/mL。从总体上看,红皮云杉球果原花青素精制物具有很强的清除ABTS+·自由基能力,接近于阳性对照Trolox。
2.5.3 红皮云杉球果原花青素精制物的还原能力(FRAP) 用FeSO4做标准品,标准曲线为y=0.123x-0.007,R2=0.9982。
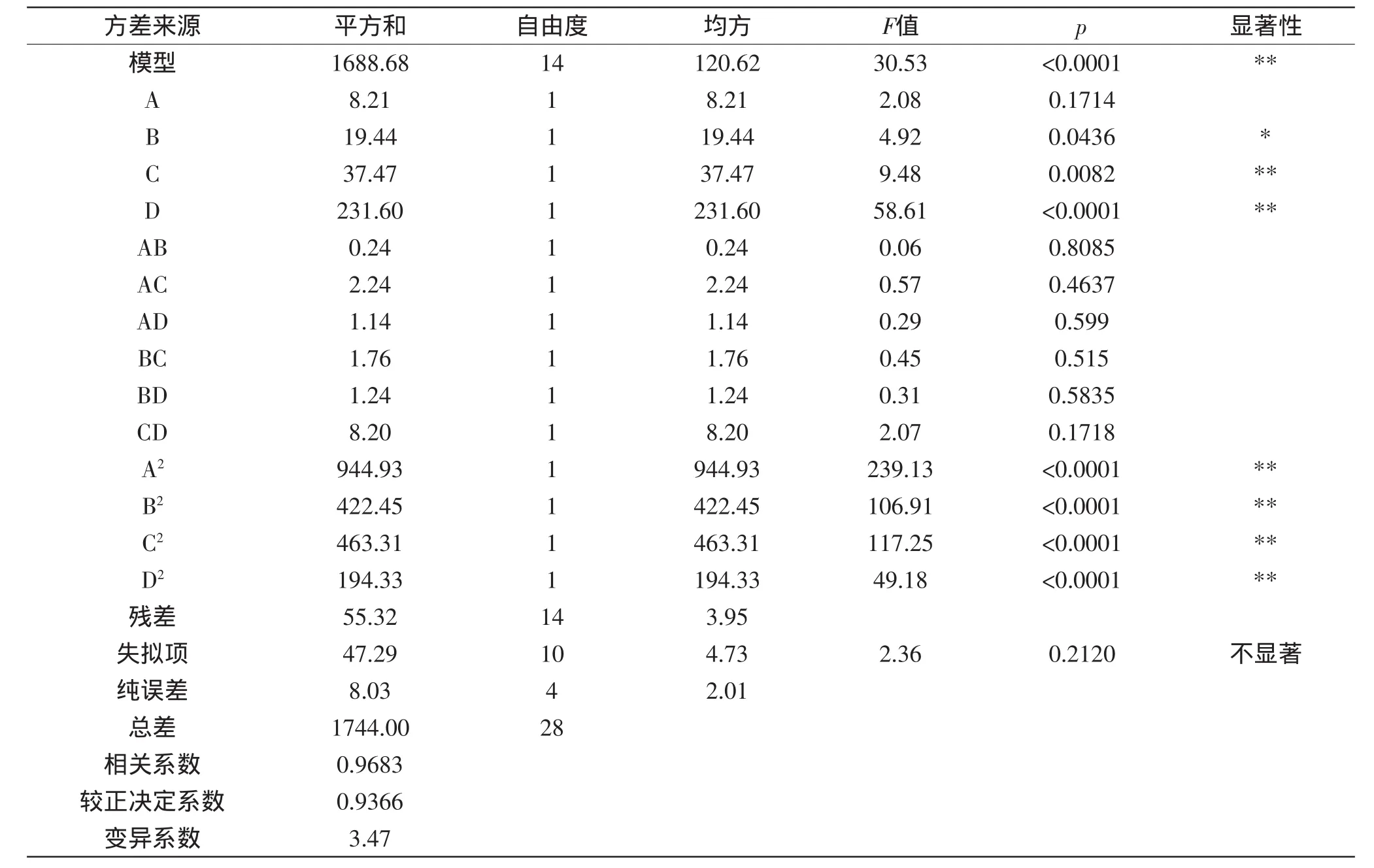
表3 回归模型方差分析表Table 3 ANOVA for Response Surface Quadratic Model

图6 红皮云杉球果原花青素对DPPH·清除作用Fig.6 DPPH radical scavenging activity of proanthocyanidins from Picea koraiensis Nakai’s cones

图7 红皮云杉球果原花青素对ABTS+·清除作用Fig.7 ABTS radical scavenging activity of proanthocyanidins from Picea koraiensis Nakai’s cones

图8 FeSO4标准曲线Fig.8 FeSO4standard curve
研究表明,植物提取物的抗氧化能力与还原能力之间具有很好的相关性,还原能力可以作为一种衡量抗氧化能力的指标[20]。具有还原能力的物质可以通过提供氢质子将体系中铁离子还原,从而抑制自由基的产生[21]。由图9可以看出,红皮云杉球果原花青素、Trolox的还原能力与浓度之间呈现出显著的相关性,相关系数R2分别为:0.9959、0.9907。红皮云杉球果原花青素还原能力略高于Trolox。红皮云杉球果原花青素、Trolox还原力的半效浓度值(EC50值)依次为(34.95±0.55)、(39.31±0.98)μg/mL。
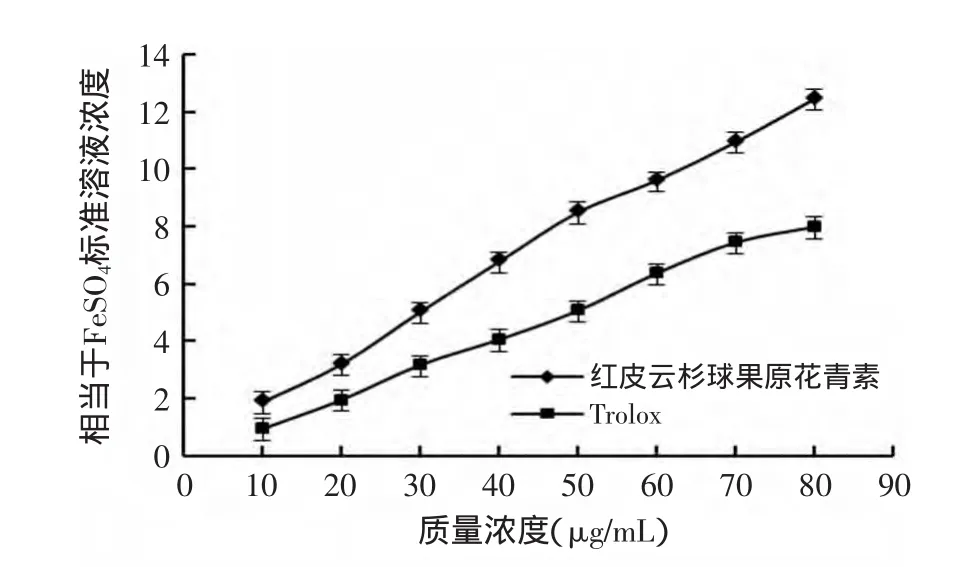
图9 红皮云杉球果原花青素精制物的还原能力Fig.9 Reducing power of proanthocyanidins from Picea koraiensis Nakai’s cones
3 结论
本实验通过对红皮云杉球果原花青素的提取工艺研究,获得最佳条件为:乙醇浓度为60%、温度51℃、时间2h、料液比为1∶44(g/mL),此时原花青素得率为(71.23±0.25)mg/g。红皮云杉球果原花青素精制物的体外抗氧化活性研究结果表明红皮云杉球果原花青素精制物具有较强的清除自由基能力和还原能力,并且在实验浓度范围时,清除ABTS+·能力和还原能力高于阳性对照Trolox。这说明红皮云杉球果原花青素具有较强的抗氧化能力,有待进一步进行深入研究。
[1]步文磊,王茵.原花青素的生物活性及作用机制研究进展[J].国外医学(卫生学分册),2007(5):311-315.
[2]周坦洋,罗芙蓉,白彬.葡萄籽原花青素生物药理活性的研究进展[N].哈尔滨医科大学学报,2012,46(1):94-96.
[3]王忠合,朱俊晨,陈惠音.葡萄籽原花青素提取物的保健功能与应用[J].食品科技,2006(4):135-139.
[4]李莹,李才国.原花青素分离纯化方法的研究进展[J].食品工程,2008(1):9-11.
[5]黄启亮.松针原花青素的制备及主要生物活性研究[D].浙江:浙江师范大学,2012.
[6]李童,张加研,秦永剑,等.思茅松树皮原花青素的化学降度提取工艺[J].西南林业大学学报,2012(3):92-96.
[7]秦永剑,田珩,张加研,等.云南松多聚原花青素降解产物抗氧化活性研究[J].西南林业大学学报,2011(3):77-79,91.
[8]秦永剑,张加研,于勇刚.云南松低聚原花青素抗氧化活性研究[J].安徽农业科学,2011(19):11563-11564.
[9]孙芸,谷文英.硫酸—香草醛法测定葡萄籽原花青素含量[J].生产与科研经验,2009,29(9):43-45.
[10]杨青,何传波,魏好程,等.大孔树脂纯化山竹壳原花青素的研究[N].热带作物学报,2013,34(3):569-573.
[11]Suksomtip M,Ukpisdawithid S,Bhusawang P,et al.Phenolic compound content,antioxidant and radical-scavenging properties of methanolic extracts from the seed coat of certain thai tamarind cultivars[J].Journal of Food Biochemistry,2010,34(5),916-931.
[12]田福.三种野生浆果花色苷的提取、纯化及抗氧化活性研究[D].哈尔滨:东北林业大学,2008.
[13]罗云.槲皮万寿菊素-铁(III)配合物的合成与性质[J].光谱实验室,2010(6):2512-2515.
[14]Giorgia S,Lorenza T,Dante M D.Effects of extraction time temperature and solvent on concentration and antioxidant activity of grape marc phenolics[J].Journal of Food Engineering,2007(81):200-208.
[15]汪志慧,孙智达,谢笔钧.莲房原花青素的稳定性及热降解动力学研究[J].食品科学,2011(7):77-82.
[16]金海英.沙棘籽原花青素提取单因素实验研究[J].沙棘,2005(4):29-32.
[17]黄慧华.多酚-蛋白质络合反应的影响因素研究[J].食品科学,2003,24(4):22-25.
[18]温志英,曹妍.响应面法优化花生红衣原花青素微波辅助提取工艺[N].中国粮油学报,2011,26(6):97-101.
[19]刘新,韩琴,徐洁.荔枝核中原花青素超声波提取工艺研究[J].安徽农业科学,2011,39(6):3282-3285.
[20]Yen GC,Chen HY,Peng HH.Evaluation of the cytotoxicity,mutagenicity and anti-mutagenicity of emerging edible plants[J]. Food Chemical Toxicology,2000(11),1045-1053.
[21]Tassoni A,Durante L,Ferri M.Combined elicitation of methyl-jasmonate and red light on stilbene and anthocyanin biosynthesis[J].Plant Physiology,2012,169:775-781.

